虚拟单色CT图像应用于放射治疗计划过程的初步评估
2021-08-31杜斌李霞刘登洪朱智慧傅玉川
杜斌,李霞,刘登洪,朱智慧,傅玉川
四川大学华西医院放疗科,四川成都610041
前言
近年来,双能CT 成像在放射科受到了越来越多的关注[1-2]。相较于普通CT 成像,这种虚拟单色CT图像可以提供诸如有效原子序数、电子密度(ED)和质量密度等更有价值的信息,从而凸显出其在临床诊断中的应用价值,如尿路结石分化、肺栓塞成像、神经影像学或肺结节分化等[3]。在放射治疗领域,包括近距离放射治疗、光子外照射治疗、电子束和质子束治疗等,使用X 射线的CT是最常用的成像方式[4],因为基于CT 影像可以将Hounsfield 单位(HU)相对容易地校准成电子密度,非常适合于放射治疗中的精确剂量计算[5]。而使用双能CT和进一步的能量解析可以为改善图像质量和进一步降低辐射剂量提供巨大的潜力[6]。目前,有关如何使用双能CT 成像的新策略来优化放射治疗链中多个环节方面的研究正处在起步阶段[7]。理论上,利用图像域和投影域方法从双能CT 合成出的虚拟单色图像能够消除光谱束硬化伪影[8]。虽然剂量计算只能在投影域实现,将虚拟单色图像应用于放射治疗计划(RTP)时,仍有可能进行更准确的剂量分布计算。另外,可针对性地给出身体特定部位更清晰的CT 图像,为医生提供更准确的靶区和正常器官勾画基础[9]。然而,在临床实践中,将以快速电压切换模式获得的虚拟单色CT 图像作为放射治疗计划的基础图像之前,必须将虚拟单色图像的质量与在不同管电压和相同辐射剂量下采集的多色单能量图像的质量进行比较,给出定量的数据差异,验证其可行性。本文以科室新安装的双能CT 采集系统为例,通过测试不同能量下不同物质在两次扫描内CT 值(质量保证的重要因素)的可重复性,比较测量值与理论值之间的CT 值差异,研究CT值到ED的转换曲线随能量变化的关系,初步评估将虚拟单色CT 图像应用于放射治疗计划剂量计算的可行性[10]。
1 材料与方法
1.1 双能CT采集系统
GE 双能CT 采集系统(Revolution ES, GE Healthcare,美国)采用单源单探结构,在射线源-探测器对围绕物体旋转时,射线源在高、低管电压(kV)间以高达4.8 kHz 的频率进行快速切换,并利用GE 宝石探测器的快速响应在数微秒内捕获临时注册的两个投影数据集。这种宝石光谱成像(Gemstone Spectral Imaging,GSI)功能可以更精确、更灵敏地识别材料,产生新用途或应用,从而实现比普通CT 成像更精确的定量功能。
1.2 理论计算
使用双能量预重建算法由材料密度图像创建合成单色的CT 图像。其基本假设是:在诊断X 射线能量范围内,所有材料能量依赖线性衰减系数可以用足够的精度表征为光电系数和康普顿系数的线性组合。能量为E时CT 图像每个体素的线性衰减系数为:

其中,μL(E)是每个体素在X射线能量为E(kVp)下的线性衰减系数,dα和dβ是双能CT 确定的位于体素位置的基础材料α和β的密度或浓度。因此,需要两种材料的信息来计算线性衰减系数,而且它们的原子序数Z 以及其光电效应和康普顿衰减特性应有足够的差异。μM(E)α和μM(E)β是材料α和β的质量衰减系数。在CT 中,线性衰减系数的积分∫μL(γ,E)由每个焦点和探测器元件的位置决定:

其中,δi是以g·cm-2为单位的基础材料i的面积密度,di(γ)是以g·cm-3为单位的基础材料i的局部密度。
对于投影中的每条光线路径,等效区域密度δα和δβ都是确定的。可通过测量两种不同的能量(光谱)的衰减来解决。X 射线的衰减遵循比尔-朗伯定律(即指数衰减定律):
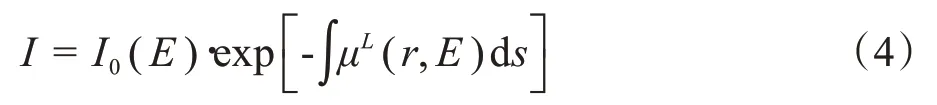
其中,I和I0是衰减强度和初始强度,等效区域密度δα和δβ可由每条路径的两个非线性方程式得出:
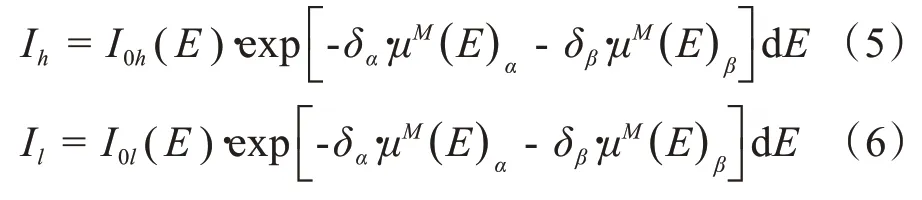
其中,下标h和l指的是高和低的kVp 能量。由于质量衰减系数可以用单能X射线源测量,所以一旦等效区域密度确定了,投影数据就可以被计算出来。对于任意的单能E0射线(以keV 为单位),都可以用已知的区域密度值乘以相应基础材料的质量衰减系数计算:

其中,μM(E0)I取自Storm 和Israel 的报告[11]。然后将投影数据置于标准重建过程,以Hounsfield 单位(HU)生成CT 图像。在常规CT 中,HU 或CT 值(CT#)的计算为:

其中,μL(E)ω是给定能量E下纯水的线性衰减。在双能CT中,要计算E0处的CT#,转换方程要使用线性质量关系μL= ρμM,并将式(1)代入式(8):
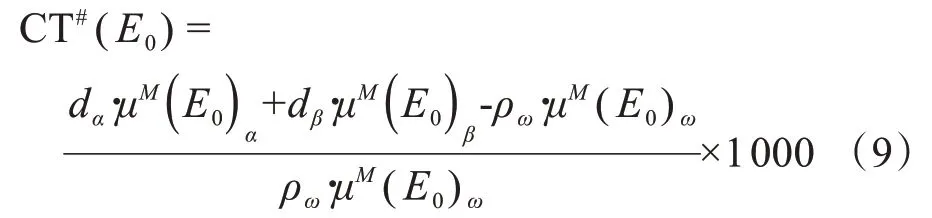
其中,ρω和μM(E0)ω分别是纯水在能量E0下的质量密度和质量衰减系数。在常规模式下获取多色图像的同时,该单色图像的合成工作流程也在GSI模式下实现。
1.3 CT模体及影像采集
采用CIRS 062M 电子密度模体,该模体由组织等效材料组成。9 组不同的组织等效电子密度插件可放置于扫描场内17 处不同的位置,图1显示插件在模体中的位置,表1给出了各插件的物理特性。
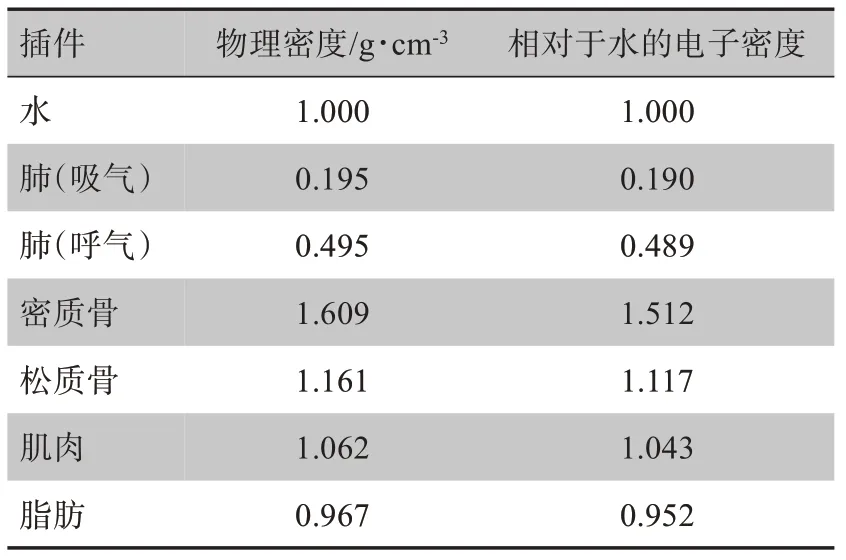
表1 CT模体插件的物理性质Tab.1 Physical characteristics of CT phantom rods

图1 模体中插件的位置Fig.1 Phantom rod alignment
1.4 测量
使用校准好的激光指示系统将模体放置在机架的等中心点处,以确保模体的中心轴和横向平面分别精确地位于纵轴和成像平面上。由于螺旋扫描通常用于RTP 的CT 模拟中,因此所有的测量均需通过常规模式和GSI模式下的螺旋扫描。两种模式均采用Helical 扫描,旋转时间(RotationTime)为0.5 s,层厚(SliceThickness)为0.625 mm,以“常规”模式重建标准的120 kVp 图像,GSI模式重建40(相对较低的设置)、60、80、100、120 和140 keV(最高设置)的单色图像,其中70 keV约等于120 kVp多色X射线束产生的有效能量。表2列出了主要的扫描参数和重建参数。此外,为了验证CT 值的可重复性,相隔26 d 后重复以上操作,获得第二组数据集。
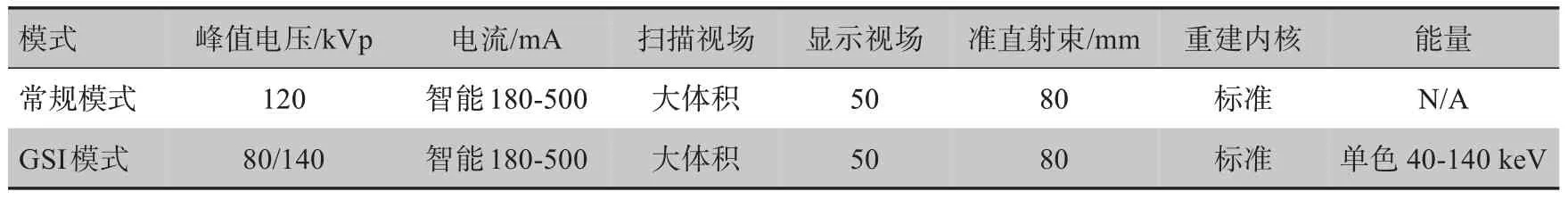
表2 两种模式下的扫描参数和重建参数Tab.2 Parameters for scanning and reconstruction in two imaging modes
1.5 CT值与ED值
将两种模式下获得的所有影像输入至临床使用的治疗计划系统(Pinnacle39.8,PHILIPS,美国),随机获取每个插件中心层面5 个点的CT 值,其平均值即被设定为该插件的CT 值。根据表1的材料性质可得到电子密度ED与CT值的对应关系。
使用NIST XCOM 程序[12]根据质量衰减系数计算出模体中插件的真实CT 值,程序中使用插件的材料组成由生产商提供。该程序使用以下公式:

其中,ρj和μM(E0)j分别是材料j的质量密度和在能量E0下材料的质量衰减系数。在室温下,将20 ℃下的0.998 23 g·cm-3作为水的质量密度。
2 结果
2.1 不同材料在不同扫描模式及单色能量组合下的CT值
如图2所示,在能量较低的图像中,高密度插件周围有或明或暗的伪影。随着单色图像能量的增加,这些伪影逐步减小。然而,在较高能量时,观察到这些地方又出现了轻微的伪影。图3反映了在间隔26 d的两次扫描中GSI模式下不同材料与虚拟单色能量的关系(实线为第一次扫描,虚线为第二次扫描)。高密度材料的CT值发生显著的变化,但是密度小于或等于水的材料的CT值的变化却很小。对于高密度材料而言,在高能图像中的CT值小于其在低能图像中的CT值。如密质骨材料,在40 keV时CT值为3 209 HU,而在140 keV时CT值为1 526 HU,约为高能量下CT值的2.1倍。

图2 不同模式和参数下的CT图像Fig.2 CT images obtained under different modes and parameters
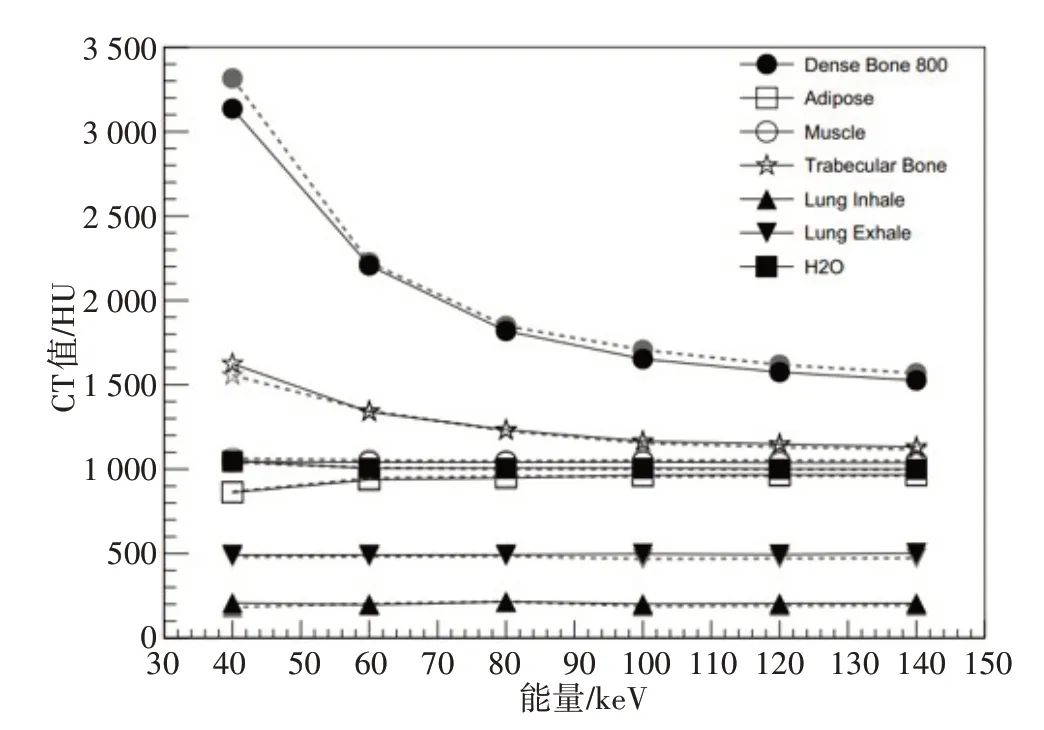
图3 两次扫描中不同材料的CT值分布Fig.3 Distribution of CT numbers of different materials in two scans
2.2 CT值的可重复性
图4显示在两次扫描中,GSI模式下的CT 值差异。随着能量的增加CT 值的差异逐渐减小,100 keV到140 keV的CT值差异逐步稳定。
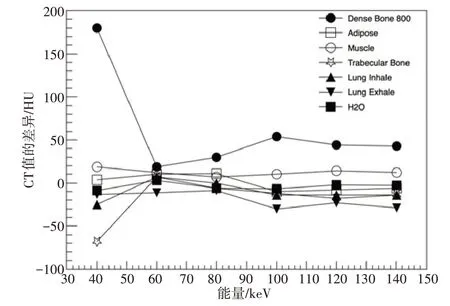
图4 GSI模式下两次扫描CT值的差异Fig.4 Difference of CT numbers between two scans in GSI modes
2.3 虚拟单色图像CT值和理论值之间的差异
为了验证扫描实测的准确度,我们根据第1.2 节的理论计算公式,计算不同材料插件的理论CT 值。图5显示了扫描实测CT 值(在Pinnacle39.8 中水的基准CT 值为1 000 HU,所以在进行计算时需要先将基准值换算为0 HU)减去理论值之后的差异值分布。由图5可以看到,CT值差异随着能量的增加而变小。对于较低密度的材料,CT 值差异均在±50 HU 范围内。但较高密度材料(如Dense Bone 800)的CT 值随能量的变化而显著变化,这说明对于较高密度材料而言,理论计算值和实测值之间的差异增大,特别是对于较低能量的图像,这种差异是不能被忽略的。

图5 单色图像CT值与理论值之间的差异Fig.5 Difference of measured and theoretical CT numbers of monochrome image
2.4 虚拟单色图像的CT值到ED转换曲线
图6显示各种单色图像的CT到ED的转换曲线,这些曲线是采用第一次扫描数据生成的。第二次扫描数据绘制出的曲线也显示出相似的趋势,因此此处未显示。标准的CT 图像曲线显示了一个聚集在0 HU附近的双线性关系。在CT值<水(0 HU)时,曲线之间没有显著性差异。70 和120 kVp 时的曲线形状相似。随着能量的增加,双线性关系逐渐消失,当能量达到140 keV 时,对应的CT-ED 曲线几乎是线性的。

图6 各种单色能量下CT-ED的转化曲线Fig.6 CT to electron density conversion curves obtained at different monochromatic energies
3 讨论和结论
由双能CT 获得的虚拟单色图像除了可以提供更清晰的形态学信息外,还能提供临床上有用的材料特定信息[13-14]。作为将双能CT应用于RTP的第一步,必须评估GSI扫描模式下获得的单色图像上ED已知材料的CT 值[15]。在GSI模式下,“单色图像”是从80 kVp 和140 kVp 投影计算得出的“单色投影”重构出来的。换句话说,不是通过单能X射线投影获得单色图像,而是使用多色的80 kVp和140 kVp X射线投影“合成”单色图像,因此可称为虚拟单色图像。这种单色图像也可以抑制多色X 射线束穿过被成像的物体时产生的光束硬化现象(伪影)。在不同的单色图像中,较高密度材料的CT 值发生了显著的变化,这是由光电效应相对于康普顿效应的优势引起的。因此,在将虚拟单色图像用于放射治疗的剂量计算之前,有必要对各种扫描模式和条件下CT 值进行全面的比较和分析。
对于任何使用CT 值的应用程序(如TPS 系统),CT 值的可重复性是非常重要的[16]。目前,很少有关于超过1 d或1个月内的CT值稳定性的报告,仅有在短时间内研究相关材料CT 值稳定性的报告[17]。我们的结果显示了在较长时间间隔内的两次扫描中CT值的重复性,从而验证了双能CT机的稳定性。
准确的CT-ED 转化关系是放射治疗计划设计获得准确剂量分布的前提,在此基础之上才能最大程度地减少计划剂量与实际剂量之间的差异。AAPM报告指出软组织的CT值变化20 HU,骨骼的CT值变化250 HU,对于脑部病例,机器跳数(Monitor Unit,MU)变化约为1%,对于肺部和骨盆病例,MU 变化约为2%[18]。因为CT 值是归一化到水的,所以这些结果也可以转化到单色图像的剂量计算中。我们的实验结果表明,在较低的能量时(例如低于60 keV),分次扫描间的单色图像CT 值差异大于上述标准(即软组织20 HU,骨骼250 HU)。这意味着在低于60 keV能量的单色图像上进行剂量计算,会导致较大的剂量差异。剂量计算的另一个重要因素是模体尺寸,因为尺寸的大小会改变X 射线衰减以及周围材料的散射,从而导致CT 值的变化。密质骨的CT 值在不同的能量下、不同尺寸的模体中都有显著的不同。
观察虚拟单色图像的CT-ED转换曲线,在140 keV时为线性关系,但在较低能量时则是双线性的,双线性的分叉点大约在0 HU 附近。使用这些CT 到ED的转换曲线,需要进行剂量学研究以进一步评估剂量计算的准确性,从而挖掘虚拟单色图像在放射治疗领域中的应用潜力,例如利用单色图像来解决常规CT 产生金属伪影的缺点[19]。在RTP 过程中,利用低能级虚拟单色图像改善图像质量时,由于HU 估计不准确有可能导致剂量误差较大[20]。对应到不同的临床治疗技术而引起的最终临床计划结果,有些可能无关紧要,有些则需要尽量避免。在本文的初步评估基础上,利用实际的临床患者数据,今后可望推进影像学和剂量学结合的进一步研究。
