生长抑素受体显像剂在神经内分泌肿瘤中的临床研究进展
2021-08-31冯柳金晨涛田梅
冯柳 吴 爽 金晨涛 田梅
浙江大学医学院附属第二医院核医学科,杭州 310009
神经内分泌肿瘤(neuroendocrine tumors,NETs)是一类起源于神经内分泌细胞的异质恶性肿瘤,分化良好的NETs可过度表达生长抑素受体(somatostatin receptor,SSTR)。奥曲肽、兰瑞肽等生长抑素类似物(somatostatin analogue,SSA)可与SSTR特异性结合。放射性核素标记的SSA可用于NETs的功能代谢显像,对疾病的早期诊断和精准定位具有重要意义。
1 放射性同位素标记的SSTR激动剂
SSTR属于G蛋白偶联受体家族,共有5个亚型(SSTR1~5),以SSTR2最为常见[1]。奥曲肽、兰瑞肽和地普奥肽等是人工合成的SSTR激动剂,可与SSTR特异性结合,其中以奥曲肽的应用最为广泛。奥曲肽为八肽氨基酸序列,对SSTR具有较高的亲合力,尤其是SSTR2和SSTR5[2]。随着核医学分子影像技术的不断发展,不同放射性核素标记的SSA已得到成功研发,并应用于SPECT和PET的显像诊断(表1)。
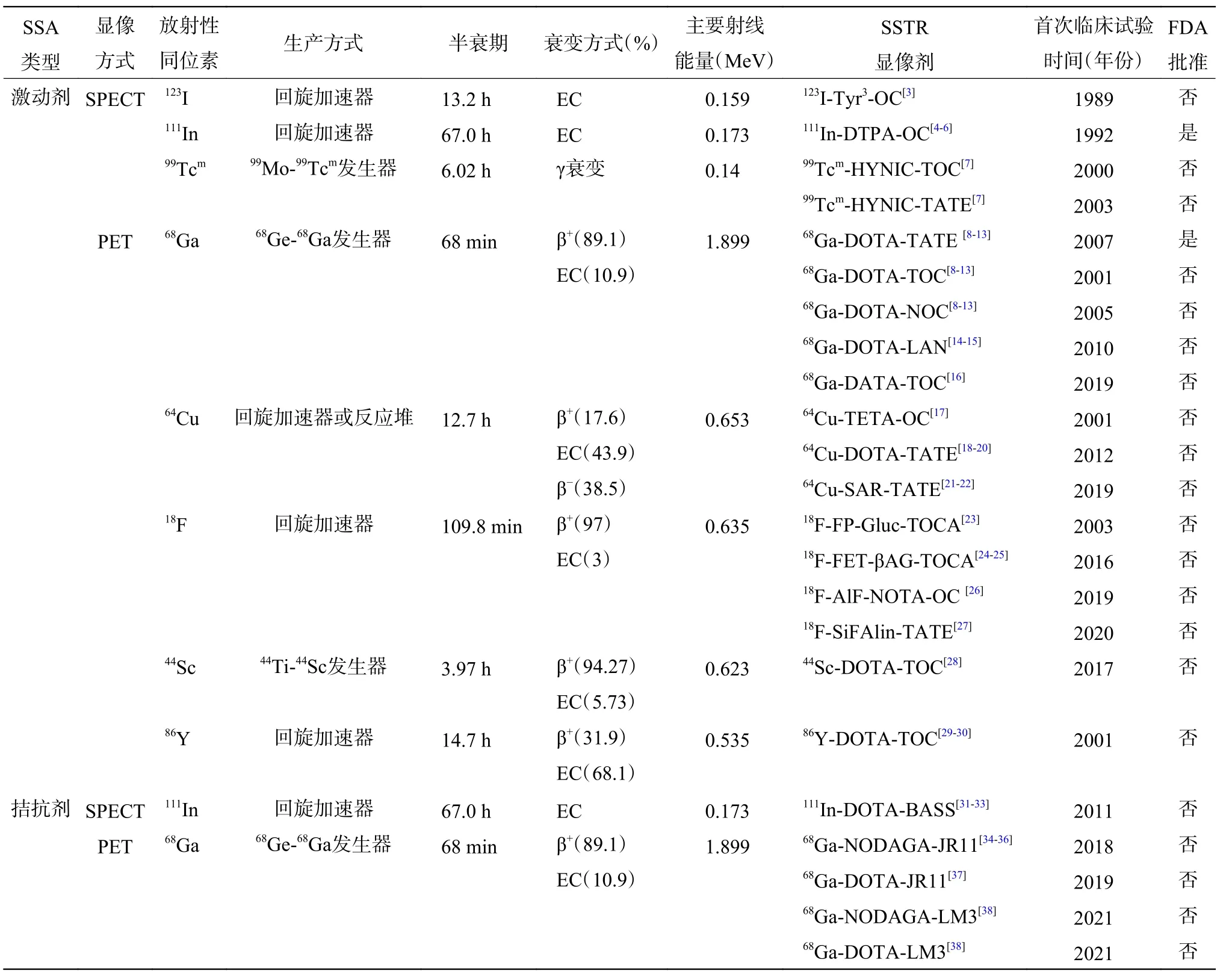
表1 放射性同位素标记的SSTR显像剂的分类及特征Table 1 Classification and characteristics of radioisotope labeled somatostatin receptor imaging agents
1.1 SPECT显像剂
20世纪90年代初,111In 和123I标记的奥曲肽SSTR功能显像剂便已应用于临床[3]。111In-二亚乙基三胺五乙酸-奥曲肽(111In-diethylene-triaminepentaacetic acid-octreotide,111In-DTPA-OC)被美国食品与药品监督管理局(Food and Drug Administration,FDA)批准为NETs显像剂[4],是过去20年NETs功能显像的“金标准”显像剂[5]。以111In-DTPA-OC为显像剂的闪烁扫描显像技术(包括γ相机、SPECT、SPECT/CT)对NETs病灶均具有较高的检出率(50%~100%)[6]。虽然111In-DTPA-OC已广泛应用于NETs患者的诊断,但仍然存在一定的局限性:(1)111In的半衰期较长(67 h),导致辐射剂量较高;(2)111In发射的两种γ射线能量和丰度(0.173 MeV,89%和0.247 MeV,94%)相对较高,导致图像的空间分辨率降低;(3)111In-DTPA-OC在体内定位分布缓慢,耗费的时间成本较高[4]。
99Tcm-乙 二 胺N,N-二 乙 酸-酪 氨 酸3-奥 曲 肽[(99Tcm-ethylenediamine N, N-diacetic acid, EDDA)-Tyr3-octreotide,99Tcm-EDDA-TOC]、99Tcm-乙 二 胺N, N-肼 基 烟 酰 胺-酪 氨 酸3-奥 曲 肽[(99Tcmethylenediamine N, N-hydrazino-nicotinamide,HYNIC)-Tyr3-octreotide,99Tcm-HYNIC-TOC]和99Tcm-肼基烟酰胺-酪氨酸3-苏氨酸8-奥曲肽酸(99Tcm-HYNIC-Tyr3-Thr8- octreotade,99Tcm-HYNIC-TATE)的研发成功克服了111In-DTPA-OC的部分局限性。相较于111In-DTPA-OC,99Tcm-HYNIC-TOC具有更高的T/NT、更好的病灶定位能力和更高的诊断准确率,但受显像技术的影响,它对淋巴结和肝脏中长径<1 cm病变的检测能力仍然较差[7]。
1.2 PET显像剂
1.2.168Ga标记的SSTR显像剂
68Ga-SSA在NETs中的临床研究最为广泛,主要分为两大类。第一类是以1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-N,N',N'',N'''-tetraacetic acid,DOTA)为螯合剂,如68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-苯丙氨酸1-酪氨酸3-奥曲肽(68Ga-DOTA-Phe1-Tyr3-OC,68Ga-DOTA-TOC)、68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四 乙 酸-酪 氨 酸3-奥 曲 肽 酸(68Ga-DOTATyr3-octreotade,68Ga-DOTA-TATE)、68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-碘化钠3-奥曲肽(68Ga-DOTA-NaI3-OC,68Ga-DOTA-NOC)和68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-兰瑞肽(68Ga-DOTA-lanreotide,68Ga-DOTA-LAN)。前三者已成为NETs SSTR显像的新标准显像剂[8],其中68Ga-DOTA-TATE已获美国FDA批准应用于临床[5],并被纳入NETs诊断的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[9]。该指南提出,68Ga-DOTA-TATE PET/CT可作为NETs初始诊断、原发肿瘤的定位以及肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)的首选方案[9]。
在肺、胃肠道和胰腺的NETs诊断方面,68Ga-DOTA-TATE与111In-DTPA-OC具有相似的特异度(93%),但是68Ga-DOTA-TATE的灵敏度和总体准确率均高于111In-DTPA-OC(分别为96%vs.72%和94%vs.84%)[10]。与99Tcm-HYNIC-OC相比,68Ga-DOTA-TATE对NETs病灶的诊断灵敏度更高(60%vs.96%),并且可以发现更多胰腺、胃肠道及骨的转移病灶,假阴性率也相对更低[11]。68Ga-DOTA-TOC、68Ga-DOTA-NOC 和68Ga-DOTA-TATE的配体均为奥曲肽衍生物,虽然3种显像剂对不同的SSTR亚型亲和力不同,但总体来说三者的诊断性能差异无统计学意义[12]。在NETs的初始诊断中,
68Ga-DOTA-TOC、68Ga-DOTA-NOC、68Ga-DOTATATE PET显像的总体灵敏度为91%(95%CI,85%~94%)、特异度为94%(95%CI,86%~98%)。在分期和再分期中,68Ga-DOTA-TOC、68Ga-DOTA-NOC、68Ga-DOTA-TATE PET显像对原发或转移性病灶的诊断灵敏度为78.3%~100%、特异度为83%~100%[13]。68Ga-DOTA-LAN主要与SSTR3和SSTR4结合,与SSTR2的亲和力较低[14],而NETs以表达SSTR2为主。因此,68Ga-DOTA-LAN PET在NETs诊断和分期方面的价值不如68Ga-DOTA-TOC。对68Ga-DOTA-TOC摄取不佳或不摄取的NETs,可考虑选择68Ga-DOTA-LAN PET显像[15]。
另一类68Ga-SSA是以6-氨基-1,4-二氮杂三乙酸酯(6-amino-1,4-diazepine triacetate,DATA)为螯合剂,如68Ga-DATA-TOC。DATA是一种新型螯合剂,其与68Ga标记的SSTR显像剂结合具有更高的稳定性[16]。68Ga-DATA-TOC的合成更为简便、经济和高效,具有作为68Ga-DOTA-TOC有效安全替代品的潜力。
1.2.264Cu标记的SSTR显像剂
64Cu作为一种半衰期长(12.7 h)、低正电子能量(Eβ+max=0.653 MeV)的放射性核素,在肿瘤显像和靶向治疗中的应用价值受到越来越多的关注。其最大正电子能量远低于68Ga(Eβ+max=1.899 MeV),可具有更高的PET空间分辨率。64Cu标记的SSA显像剂主要有3种,即64Cu-DOTA-TATE、64Cu-1,4,8,11-四氮杂环十四烷-N,N′,N″,N′″-四乙酸-奥曲肽(64Cu-1,4,8,11-tetraazacyclotetradecane-N,N′,N″,N′″-tetraacetic acid-octreotide,64Cu-TETA-OC)和64Cu-5-(8-甲基-3,6, 10,13,16,19-六氮杂-双环[6,6,6]二十烷-1-基氨基)-5-氧戊酸-酪氨酸-奥曲肽[64Cu-5-(8-methyl-3,6,10,13,16,19-hexaaza-bicyclo[6,6,6]icosan-1-ylamino)-5-oxopentanoic acid-Tyr3-OC,64Cu-SARTATE]。
临床初步试验结果显示,64Cu-TETA-OC的血液清除率和膀胱排泄率均较111In-DTPA-OC更高,且显像效果更好,可检测到更多NETs转移灶[17]。64Cu-DOTA-TATE和68Ga-DOTA-TOC的灵敏度相当,但64Cu-DOTA-TATE检测到病灶的真阳性率更高[18]。64Cu-DOTA-TATE注射后1 h和3 h的PET显像比较结果显示,两个时间点检测到的病灶数差异无统计学意义[19],较宽的显像时间窗提高了其用于NETs显像的便利性和灵活性。148 MBq(4.0 mCi)的64Cu-DOTA-TATE即可获得具有诊断质量的PET/CT显像,其灵敏度和特异度均较高(分别为100%和96.8%)[20]。该剂量可作为后续Ⅲ期临床研究的最佳注射剂量。64Cu-SAR复合物较64Cu-DOTA的生物性状更稳定[21],64Cu-SAR-TATE的临床试验结果表明,该显像剂具有良好的安全性[22]。其在注射后4 h或24 h的显像与68Ga-DOTA-TATE注射后1 h的显像相比,显示出的病灶数差异无统计学意义[22],这不仅提高了显像时间的灵活性,也增加了64Cu-SAR-TATE在核素治疗前多时间点剂量测定的可能性。
1.2.318F标记的SSTR显像剂
已用于NETs临床研究的18F标记的氟化物主要有4类,包括18F-氟丙烯酸-4-硝基酯(18Ffluoropropionic acid-4-nitrophenyl ester,18F-FP)、18F-氟化铝 (18F-AlF2+)、18F-氟甲烷(18F-fluoroethane,18F-FEA)和18F-硅基氟化物(18F-silicon-based fluoride acceptor,18F-SiFA)。
Nα-(1-脱氧-D-果糖基)-Nε-(2-18F-氟丙酰基)-Lys0-Tyr3-奥曲肽酸[ Nα-(1-deoxy-D-fructosyl)-Nε-(2-18F-fluoropropionyl)-Lys0-Tyr3-octreotade,18FFP-Gluc-TOCA]的肿瘤摄取及血液清除速率快,在注射时间(16±9) min和(34±12) min时,肿瘤与本底的比率分别高达80%和90%[23]。但由于18FFP-Gluc-TOCA的合成过程复杂,制备时间较长(3 h),且放射化学产率有限(20%~30%),限制了其在临床中的应用。18F-氟乙基三唑-酪氨酸3-奥曲肽(18F-fluoroethyltriazole-Tyr3-octreotide,18F-FETβAG-TOCA)的临床研究结果已证实其安全性和人体可耐受性,在NETs转移的主要部位均显示出较高的肿瘤摄取以及T/NT[24]。与68Ga-DOTA-TATE相比,18F-FET-βAG-TOCA显像的灵敏度更高(92.8%vs.87.5%)[25]。18F-Al-1, 4, 7-三氮杂环壬烷-1, 4, 7-三乙酸-奥曲肽(18F-Al-1, 4, 7-triazacyclononane-1,4, 7-triacetate-octreotide,18F-AlF-NOTA-OC)在NETs患者体内表现出良好的生物学分布特性、动力学特性和肿瘤靶向性,其肝脏生理性摄取低,可发现更多肝脏病变[26]。新型显像剂18F-对二叔丁基氟硅基-苯 甲 醛-奥 曲 肽 酸[18F-p-(di-tert-butylfluorosilyl)benzaldehyde-octreotade,18F-SiFAlin-TATE]在人体内的生物学分布与68Ga-DOTA-TOC基本类似,大多数NETs病灶对18F-SiFAlin-TATE摄取较高,特别是NETs的常见转移部位对18F-SiFAlin-TATE的摄取均高于68Ga-DOTA-TOC,如肝脏(SUVmax:18.8±8.0vs.12.8±5.6)、淋巴结(SUVmax:23.8±20.7vs.17.4±16.1)和骨转移灶(SUVmax:16.0±10.1vs.10.3±5.7)[27]。18F-SSA的临床研究尚处于早期阶段,需要更多前瞻性Ⅱ/Ⅲ期临床研究检验其诊断性能。
1.2.444Sc标记的SSTR显像剂
44Sc是用于PET显像的新型放射性核素,可通过回旋加速器大量获得,且其具有良好的物理性质(T1/2=3.97 h;Eβ+max=0.623 MeV)。44Sc-DOTA-TOC在临床试验中显示出良好的显像特性,延迟扫描可检测到非常小的病灶[28]。此外,47Sc是适用于核素治疗的放射性核素之一,44Sc标记的显像剂可与47Sc标记的治疗药物联合用于NETs的治疗前显像、治疗方案制定及疗效监测,实现NETs的诊疗一体化。但目前相关研究甚少,44Sc-SSA在NETs中的诊断价值还需更多的临床试验结果证实。
1.2.586Y标记的SSTR显像剂
90Y标记的SSA已用于NETs的临床治疗,但由于90Y是一种发射纯β-射线的核素,无法直接用于显像。以往多用111In-DTPA-OC进行90Y-SSA核素治疗前显像和剂量估算,但111In-SSA与90Y-SSA在体内的生物学分布不同。理论上,86Y-SSA是90Y-SSA治疗前显像更为理想的显像剂。相较于111In-DTPA-OC SPECT,86Y-DOTA-TOC PET的图像质量更高,能更精确地估算90Y-SSA核素治疗所需剂量[29-30]。但86Y也存在一定的局限性,除β+射线外,86Y还发射0.628 MeV(32.6%)、0.703 MeV(15.4%)和1.077 MeV(82.5%)等多种额外的高能γ射线,导致显像背景噪音增强,空间分辨率降低,限制了其在临床中的实用性[29-30]。
2 放射性同位素标记的SSTR拮抗剂
SSTR显像领域另一个重要的发展是SSTR拮抗剂的研发。SSTR拮抗剂比SSTR激动剂具有更多的受体结合位点,与受体结合后不易解离,可能更适合作为SSTR显像的探针[31]。BASS[p-NO2-Phe-cyclo(D-Cys-Tyr-D-Trp-Lys-Thr-Cys)D-Tyr-NH2]是第1代SSTR2拮抗剂,可与SSTR2特异性结合[32]。111In-DOTA-BASS对NETs病灶的检测性能优于111In-DTPA-OC,并且肾脏吸收更低[33]。第2代SSTR2拮抗剂有JR11(Cpa-c[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]-D-Tyr-NH2)和LM3[p-Cl-Phe-cyclo(D-Cys-Tyr-D-Aph(Cbm)-Lys-Thr-Cys)D-Tyr-NH2][34],以68Ga 标记的68Ga-1,4,7-三氮杂环壬烷,1-戊二酸-4,7-乙酸(1,4,7-triazacyclononane,1-glutaric acid-4,7-acetic acid,NODAGA)-JR11,即68Ga-OPS202和68Ga-DOTA-JR11常用于临床研究。
虽然68Ga-OPS202和68Ga-DOTA-JR11对SSTR2的亲和力均较68Ga-DOTA-TATE低,但肿瘤对二者的摄取均高于68Ga-DOTA-TATE[31]。68Ga-OPS202血液清除速率快,背景活性低,尤其是在肝脏和胃肠道中,表现出良好的生物学分布和显像特性[35]。在胃肠道和胰腺NETs患者中,68Ga-DOTA-TOC比68Ga-OPS202具有更高的T/NT,对肝转移瘤的检出率更高,基于病灶的整体灵敏度也更高:肽剂量50 μg和15 μg的68Ga-OPS202灵敏度分别为94%和88%,而肽剂量15 μg的68Ga-DOTA-TOC灵敏度为59%(P<0.001)[36]。68Ga-DOTA-JR11相较于68Ga-DOTA-TATE可检测到更多的肝转移灶(552vs.365),但对骨转移的检出率低于68Ga-DOTATATE(158vs.388),而两者对原发灶和淋巴结转移灶的检出率差异无统计学意义[37]。Huo等[38]的前瞻性研究对68Ga-NODAGA-LM3和68Ga-DOTALM3在16例高分化NETs患者中应用的安全性和生物学分布情况进行评估,结果显示,68Ga-DOTALM3组中2例患者出现恶心和呕吐症状,其余14例患者的PET显像显示,两种示踪剂均有较高的肿瘤摄取和滞留。但正常组织对68Ga-DOTA-LM3的摄取较68Ga-NODAGA-LM3更低,前者检测到的病灶数略多于后者(20/38vs.18/38)。68Ga-NODAGALM3和68Ga-DOTA-LM3在NETs中的诊断价值仍需要进一步的研究来评估。
随着更多放射性核素标记的SSTR拮抗剂药物进入临床研究阶段,放射性核素标记的SSTR拮抗剂也将具有更为广泛的应用前景,待扩大临床样本量进一步证实。
3 小结与展望
多种靶向SSTR的显像剂已得到成功研发,为临床精准诊治NETs提供了更多选择。111In、68Ga、64Cu和18F等放射性核素标记的SSTR受体激动剂在NETs诊断方面表现出较高的灵敏度和特异度,显著提高了NETs病灶的检出率,其中111In-DTPAOC和68Ga-DOTA-TATE已获美国FDA批准应用于临床。另外,68Ga标记的SSTR拮抗剂在早期临床研究中显示出良好的生物学特性和肿瘤靶向性,有可能成为更有前景的显像剂类型。更重要的是,治疗核素(如177Lu)标记的SSA对NETs疗效显著,68Ga-SSA、177Lu-SSA已可应用于临床实现患者诊疗的一体化。随着更多高特异度和高灵敏度的显像剂陆续得到研发,NETs患者的临床管理也将不断走向个体精准化。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明冯柳负责文献资料的整理、综述的撰写;吴爽、金晨涛负责综述的修改;田梅负责命题的提出、综述的审阅。
