芳香烃受体抑制剂SR1对小鼠造血系统辐射损伤的防护作用
2021-08-31周晓靓李德冠徐文清王浩
周晓靓 李德冠 徐文清 王浩,2
1中国医学科学院放射医学研究所,天津市放射医学与分子核医学重点实验室 300192;2天津大学医学工程与转化医学研究院 300072
急性电离辐射能够导致急性辐射综合征,造血系统是辐射最敏感的器官系统,经0.5 Gy以上剂量照射后,即可观察到造血系统损伤的临床表现[1]。电离辐射引起的造血系统损伤可表现为一过性或者长期的中性粒细胞减少症、血小板减少症和淋巴细胞减少症,这主要归因于辐射造成的造血干细胞(hematopoietic stem cell,HSC)和祖细胞的杀伤呈剂量积累性以及某些淋巴细胞的凋亡[2]。外周血WBC的凋亡也是大多数免疫指标受到抑制的关键机制,而辐射后免疫功能的远期恢复也取决于早期胸腺祖细胞来源的骨髓衍生的HSC的恢复[3]。
芳香烃受体(aryl hydrocarbon receptor,AHR)是一类配体激活转录因子,能够被一系列芳香烃类内源性或外源性配体激活。AHR在人体除骨骼肌之外的各个器官中均有表达,其主要功能为调节异生物质的代谢酶活性。StemRegeini 1(SR1)作为高选择性AHR抑制剂,有刺激造血细胞增殖和分化的能力[4],包括体外促进HSC增殖以及体内促进造血祖细胞增殖。在骨髓移植的临床治疗中,已经有学者尝试将SR1用于体外的HSC增殖的研究[5]。本研究通过采用4 Gy X射线全身照射小鼠模型,研究SR1对造血系统中外周血血象、活性氧(reactive oxygen species,ROS)水平以及免疫细胞百分比等指标的影响。
1 材料与方法
1.1 主要仪器和试剂
Gammacell®40 Exactor137Cs γ射线照射源购自加拿大Best Theratronics公司,剂量率为0.99 Gy/min;Accuri C6流式细胞仪购自美国BD公司;MEK-7222K全自动血液分析仪购自日本光电工业株式会社。SR1(纯度>99%)购自美国MedChemExpress公司;兔还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)多克隆抗体购自武汉三鹰生物技术有限公司;其他抗体均购自美国BD公司;2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)染料购自上海碧云天生物技术有限公司。
1.2 实验动物
雄性C57BL/6J小鼠15只,6~8周龄,体重(20±2)g,由北京维通利华实验动物技术有限公司提供[无特定病原体级,实验动物许可证编号为SCXK(京)2016-0006]。实验小鼠饲养于中国医学科学院放射医学研究所动物中心。饲养环境为无特定病原体级动物房屏障环境,小鼠自由饮用无菌水和进食无特定病原体级鼠繁殖饲料,饲养温度18~25℃,相对湿度40%~70%。
1.3 照射及给药方法
采用随机化区组设计将C57BL/6J小鼠分为3组:对照组、4 Gy单独照射组(简称照射组)和4 Gy照射+SR1组(简称照射给药组),每组5只。其中照射组和照射给药组给予4 Gy全身γ射线照射,照射给药组在照射前5 d至照射后5 d连续灌胃给予SR1(50 mg/kg),对照组给予等量生理盐水。照射后第9天处死全部小鼠。
1.4 外周血血细胞计数
经小鼠眼底取血获取外周血约200 μL,使用事先加入乙二胺四乙酸三钾溶液作抗凝处理的离心管收集,通过全自动血液分析仪分析并计数小鼠外周血血细胞。
1.5 骨髓有核细胞(bone marrow nucleated cell,BMNC)计数和粒细胞-巨噬细胞集落形成单位(colony-forming units-granulocyte-macrophage,CFU-GM)的检测
用冷PBS冲洗单侧股骨,得到的细胞悬液用全自动血液分析仪进行BMNC计数;将小鼠单侧股骨冲洗后得到的骨髓细胞悬液稀释为1×106个/mL,取0.2 mL细胞悬液加入到2 mL M3534培养基中,混匀后加入到24孔板中,培养5 d后进行CFU-GM计数,以细胞数≥30个为阳性集落进行计数。
1.6 BMNC和HSC中ROS和NOX4水平的测定
改良文献[6]中的方法并进行实验,在小鼠骨髓细胞悬液中加入biotin-CD5、CD4、CD8、CD11b和Ter-119抗体的混合液,冷孵育30 min后洗涤,加入Percp-streptavidin、Sca-1和CD117-APC抗体,室温避光染色30 min后加入2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)染料,37℃水浴孵育后使用流式细胞仪检测ROS的水平(用平均荧光强度表示)。
将骨髓细胞染色后固定破膜过夜,加入兔NOX4多克隆抗体和羊抗兔二抗,使用流式细胞仪检测NOX4的水平(用平均荧光强度表示)。
1.7 外周血中免疫细胞百分比的检测
在经抗凝处理的小鼠外周血中加入biotin-CD3e和CD45R/B220抗体混合液,冷孵育30 min后洗涤,使用流式细胞仪检测免疫细胞的百分比。
1.8 统计学分析
应用GraphPad Prism 8.0软件对数据进行统计学分析。符合正态分布的计量资料用x¯±s表示,组间两两比较采用Studentt检验(方差齐)。P<0.05为差异有统计学意义。
2 结果
2.1 SR1对照射后小鼠外周血血象的影响
4 Gy γ射线全身照射后第9天小鼠的外周血血细胞计数结果(图1)显示:与对照组相比,照射组小鼠的WBC和血小板数量明显减少,且差异均有统计学意义(均P<0.05),虽然RBC数量减少和红细胞压积(HCT)水平下降,但差异均无统计学意义(t=2.209、2.234,均P>0.05);与对照组相比,照射给药组RBC数量明显减少,红细胞压积(HCT)明显降低,且差异均有统计学意义(t=4.301、4.144,均P<0.05);与照射组相比,照射给药组的WBC明显增加[(3.060±0.650)×109个/mL对(4.680±1.134)×109个/mL,P<0.05],而血小板数量未增加(t=0.464,P>0.05)。
2.2 SR1对照射后小鼠BMNC及CFU-GM的影响
由图1可见,与对照组相比,照射组小鼠BMNC数量减少,而照射给药组比照射组的BMNC数量明显增加[对照组:(32.333±6.788)×109个/mL,照射组:(28.375±6.811)×109个/mL;照射给药组:(49.125±12.532)×109个/mL,均P<0.05];照射组小鼠骨髓中的CFU-GM(3.4±1.7)明显降低,仅为对照组(27.0±8.3)的13%,照射给药组小鼠的CFU-GM(13.6±6.7)恢复至对照组的50%,且差异均有统计学意义(均P<0.05)。以上结果表明,SR1能够明显缓解全身照射引发的小鼠骨髓造血功能损伤。

图1 SR1对4 Gy γ射线全身照射后小鼠外周血血象、BMNC和CFU-GM的影响 a表示与对照组相比,差异均有统计学意义(t=4.144~8.671,均P<0.05);b表示与照射组相比,差异均有统计学意义(t=2.770、3.231、3.323,均P<0.05)。照射给药组为4 Gy γ射线全身照射+50 mg/kg SR1。SR1为StemRegenin 1;BMNC为骨髓有核细胞;CFU-GM为粒细胞-巨噬细胞集落形成单位Figure 1 Effects of StemRegenin 1 on the peripheral blood hemogram, numbers of bone marrow nucleated cells and colony-forming unitsgranulocyte-macrophage of mice exposed to 4 Gy γ-ray whole-body radiation
2.3 SR1对照射后小鼠BMNC和HSC中ROS和NOX4水平的影响
由图2可见,与对照组相比,照射组小鼠BMNC和HSC中ROS水平明显升高,分别为对照组的1.3 倍和3.2倍,而照射给药组能明显降低照射引起的小鼠BMNC和HSC中ROS水平的升高,分别降低至照射组的63%和73%(t=3.962、2.530,均P<0.05);照射后小鼠BMNC和HSC中NOX4水平与ROS水平的变化规律一致,SR1能够明显降低照射引起的NOX4水平升高(t=2.310、2.848,均P<0.05)。以上结果表明,SR1可能通过降低NOX4 的水平,从而减少NOX4诱导产生的ROS,发挥保护造血细胞的作用。
2.4 SR1 对照射后小鼠免疫细胞的影响
由图2可见,与对照组相比,照射组小鼠CD3+T细胞百分比明显降低,而照射给药组小鼠的CD3+T细胞百分比较照射组明显升高,接近照射前水平[ 对照组: (20.938±2.761)%,照射组: (8.512±3.716)%,照射给药组:(16.140±1.969)%,t=6.002、4.056,均P<0.05];与对照组相比,照射组小鼠B220+B细胞百分比明显降低,而照射给药组小鼠的B220+B细胞百分比较照射组明显升高[对照组:(1.884±0.920)%,照射组:(0.608±0.267)%,照射给药组:(7.240±2.828)%,t=2.978、4.027,均P<0.05]。
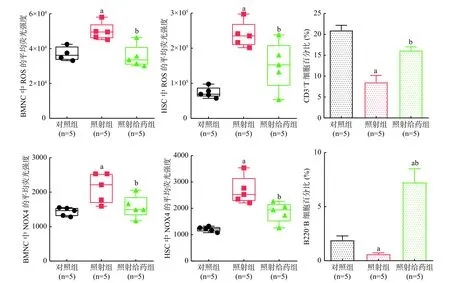
图2 SR1对4 Gy γ射线全身照射后小鼠BMNC和HSC中ROS、NOX4 水平以及免疫细胞的影响 a表示与对照组相比,差异均有统计学意义(t=2.978~9.305,均P<0.05);b表示与照射组相比,差异均有统计学意义(t=2.310~4.056,均P<0.05)。照射给药组为4 Gy γ射线全身照射+50 mg/kg SR1。SR1为StemRegenin 1;BMNC为骨髓有核细胞;HSC为造血干细胞;ROS为活性氧;NOX4为还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4Figure 2 Effects of StemRegenin 1 on the levels of reactive oxygen species and nicotinamide adenine dinucleotide phosphate oxidase 4 in the bone marrow nucleated cells and hematopoietic stem cells, and immunocytes of mice exposed to 4 Gy γ-ray whole-body radiation
3 讨论
造血系统是维持外周血血细胞数量稳定和免疫稳态的重要器官,在结构和功能上都与免疫系统息息相关[7]。其中,HSC是保持造血功能、胸腺免疫细胞发育功能,以及辐射引起骨髓抑制后实现多谱系重建的核心。造血功能主要在骨髓和胸腺的特殊部位(龛)实现,干细胞龛可为干细胞提供特殊的微环境,从而在调节成体干细胞的存活、更新和分化方面发挥重要作用。外周血血象是电离辐射损伤最灵敏的检测指标之一,根据国际放射防护委员会(ICRP)第118号出版物中的报道:经2~10 Gy照射后,辐射引起的骨髓抑制可导致一过性的或长期的中性粒细胞减少症、血小板减少症和淋巴细胞减少症[8]。本研究结果表明,小鼠4 Gy γ射线全身照射后第9天,WBC明显减少,而SR1照射前给药能够明显改善辐射造成的WBC减少。然而,SR1对于照射后血小板数量的减少未表现出保护作用,且与对照组相比,照射给药组的RBC数量明显减少,红细胞压积(HCT)明显降低,该作用可能与AHR功能受到抑制后,导致成熟RBC分化减少有关。BMNC的数量和功能是评价骨髓造血功能的重要指标,本研究结果表明,4 Gy照射后,BMNC数量显著减少,CFU-GM数量也明显减少,而SR1能够使BMNC的数量明显增加,同时将CFU-GM恢复至照射前的50%,这进一步说明SR1对骨髓造血功能有保护作用。
ROS的形成是电离辐射造成细胞损伤的重要诱因,我们对BMNC和HSC中ROS水平的研究结果显示,照射后第9天仍能够观察到BMNC和HSC中ROS水平升高,而SR1能够下调ROS水平,在对NOX4水平的检测中也观察到了相同的趋势。Wang等[9]报道,辐射能够诱导NOX4的表达和细胞内ROS水平的升高,从而激活核因子κB,促进炎症反应;抑制NOX4能够明显抑制辐射诱导的小鼠HSC中ROS水平,同时降低全身照射诱导产生的DNA氧化损伤和双链断裂,而且小鼠后代含不稳定染色体畸变的细胞数量也会减少。Kim等[10]的研究结果表明,四氯二苯并-对-二恶英(TCDD)诱导的AHR活化能够通过激活NOX4诱导氧化应激和炎症反应。Eleftheriadis等[11]也进一步报道了AHR能够通过调节乏氧诱导因子1α和核因子E2相关因子2等通路参与体内氧化应激反应。因此,我们推断SR1对BMNC和HSC中ROS的调节可能是通过调节体内NOX4通路的直接或间接效应实现的。
AHR是非常重要的免疫系统调节剂,是自体免疫调控的重要靶点,在T细胞的功能调节方面发挥着重要作用。本研究结果表明,4 Gy全身照射后,T细胞和B细胞的百分比均降低,而SR1能够明显使T细胞和B细胞百分比得到回升。有研究者也报道了SR1能够在体外诱导造血系统的淋巴祖细胞及祖T细胞的产生,但是对于B细胞的调节作用还没有达成共识[12-13]。因此,本研究中B细胞百分比升高是AHR调控的直接效应还是辐射引起的全身炎症反应的间接效应仍需要进一步的实验证明。
综上,本研究初步探讨了AHR抑制剂SR1对全身照射引起的小鼠造血系统辐射损伤的保护作用,主要评估了外周血血象、BMNC数量和功能、免疫细胞百分比等指标。本研究结果表明,SR1对辐射引起的骨髓抑制有一定的缓解作用,部分作用与其体外刺激HSC增殖和分化的作用一致,其中进一步的分子机制仍有待探究。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明周晓靓负责实验数据的分析、论文的撰写;李德冠负责实验的设计与实施;徐文清负责论文的审阅;王浩负责研究命题的提出、实验的设计。
