血浆微生物游离DNA 宏基因组下一代测序在感染性疾病中的研究进展*
2021-08-30王莉莉吴文娟同济大学附属东方医院南院检验科上海200123
王莉莉,吴文娟(同济大学附属东方医院南院检验科,上海 200123)
感染性疾病是临床常见病之一,若不及时诊断治疗,极有可能进展为脓毒症,造成患者多器官功能衰竭,甚至死亡。对引起感染的微生物进行鉴定是患者成功治疗、康复和安全的关键。目前,传统的病原学诊断方法主要是鉴定标本中的活微生物,其培养时间长且难以检测苛养菌、胞内菌、病毒等病原体。常见的分子诊断技术包括基于核酸的诊断(如普通PCR 检测和多重PCR 检测)[1-2]、微阵列芯片[3]、液滴数字PCR 技术(digital droplet PCR,ddPCR)[4]等,但这些诊断技术不适用于复杂或包含多种微生物的临床标本。宏基因组下一代测序(metagenomic next-generation sequencing,mNGS)一次运行可同时得到几百万到几千万条核酸分子的序列,从而对标本中所有病原体,尤其是复杂感染性疾病中少见、新发或不典型的病原体进行鉴定和分型,具有敏感性高、精确性强、检测时间短等优势。该技术已被广泛应用于各种临床标本,如血浆、脑脊液、泪液及支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)等。结合血浆标本的无创性、易获得性和mNGS的高灵敏、高通量,血浆微生物游离DNA(microbial cell-free DNA,mcfDNA)mNGS在改善感染性疾病的诊断和治疗方面显示出广阔的应用前景。
1 血浆mcfDNA 概述
1948年,Mandel和Metais 首次报道了来自患者或健康人体细胞释放到体液中的游离DNA(cell-free DNA,cfDNA)[5]。在健康个体中检测到的血浆cfDNA 浓度差异很大,通常为0~100 ng/mL,有时甚至超过1 500 ng/mL。在某些疾病状态下,尤其是炎症性疾病(如系统性红斑狼疮、癌症)和感染性疾病(如脓毒症),cfDNA 的浓度有所增加[6]。cfDNA以多种形式存在于循环中,包括核基因组、线粒体基因组和微生物基因组的片段[7]。其中,人源DNA 占绝大多数(>90%,甚至>99%),而外源的mcfDNA只占小部分,0.08%~4.85%来自细菌,0.00%~0.01%来自真菌,0.00%~0.16%来自病毒或噬菌体。通过对1 例血培养阳性患者的血浆标本进行双端测序,发现鲍曼不动杆菌cfDNA片段在150~200 bp 处存在主峰;相较于核基因组片段(正态分布),mcfDNA呈偏态分布[8]。
血浆mcfDNA的两大来源包括微生物菌体入血和核酸片段入血。微生物菌体入血可能由于全身性血流感染致循环系统中存在微生物,或局灶感染时微生物短暂地侵入血液循环系统,造成一过性的菌血症。这些入侵的微生物可被抗感染药物和宿主免疫系统杀灭[9],导致微生物DNA 释放进入循环,在核酸外切酶的作用下形成小的DNA片段,即mcfDNA。核酸片段入血是由于血供丰富的器官发生局灶感染(如肺部),在巨噬细胞的免疫作用下,吞噬病原体后凋亡,向血液循环系统释放出微生物核酸片段,或病原体感染人体细胞,造成人体细胞凋亡,向血液循环系统释放出微生物核酸片段。研究表明,mcfDNA 的半衰期仅几分钟,短于核基因组片段(10~15 min),且主要通过肝脏清除[10]。
2 血浆mcfDNA mNGS 流程
作为非侵入性诊断技术,血浆mcfDNA mNGS通过捕获和识别血液循环中高度片段化的mcfDNA 来诊断常见甚至罕见的感染。在微生物学实验室中,mNGS 分析涉及湿试验、干试验两部分(图1)。
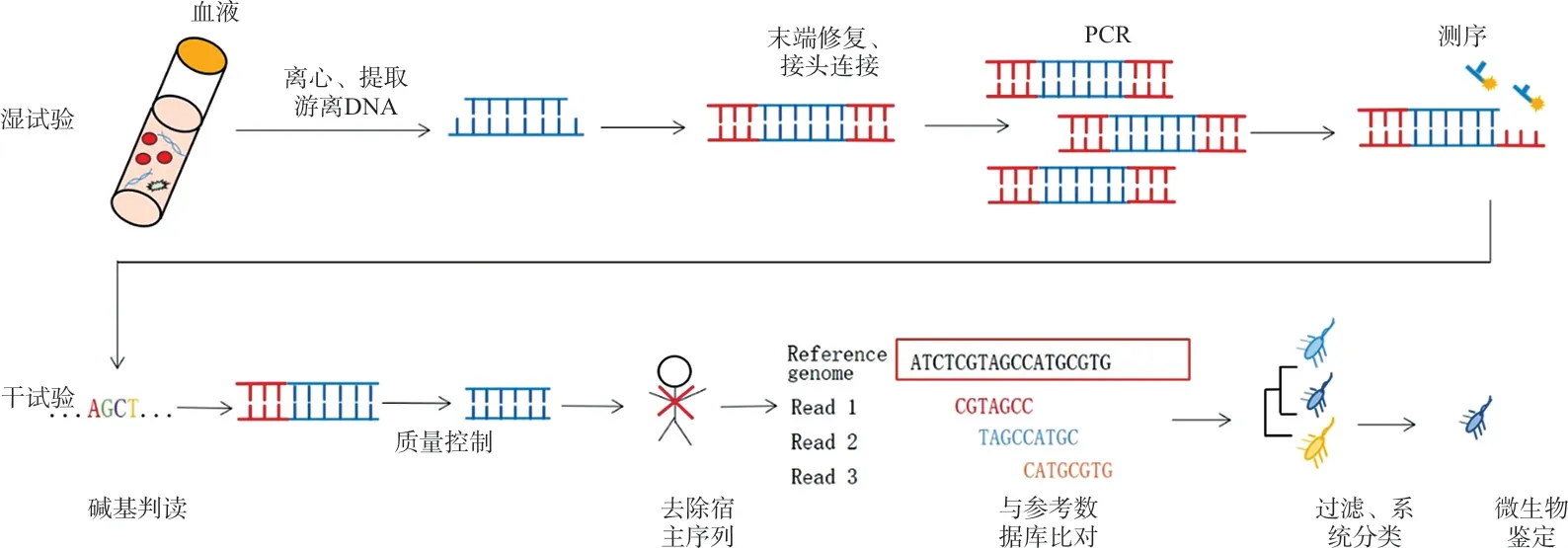
图1 血浆微生物游离DNA宏基因组下一代测序的技术原理
2.1 湿试验 湿试验包括血浆标本处理、游离核酸提取、文库制备和上机测序。
不同于其他临床标本,血浆中人源和病原体核酸均以短片段游离形式存在,标本前处理无需破壁。血浆标本的宿主DNA含量高达90%~99%且存在异质性,易干扰病原体检出序列数。可向血浆标本中加入已知浓度的内标(非人源和病原核酸序列)以去除人源背景的影响,对病原的真实载量进行评估[11]。
常用的血浆游离核酸提取方法包括磁珠法和提取柱法[12](表1),核酸提取后可直接用于建库。文库构建是对片段化核酸进行末端修复后,在两端加上已知序列信息的寡核苷酸接头以便于区分每个文库。单个文库构建完成后,可经过PCR扩增再将文库等量混合后上机测序[13]。主流深度测序方法包括DNA 纳米球测序、边合成边测序和半导体测序。测序平台的测序长度一般为50~200 bp,少数仪器可达300~400 bp;测序数据量至少为10 兆条核酸序列数,根据实验需求可适当增加测序数据量以提高检测灵敏度[14]。PCR可同比放大微生物和人源核酸,而NGS按比例抽样,如HiSeq2500测序运行时只检测原始数据量的0.02%,因此,也可选择PCR-free的文库构建方法[15]。

表1 血浆游离DNA提取试剂盒
最近,Wang等[16]开发了自动化设备NGSmaster以实现湿试验自动化,包括核酸提取、PCR-free文库的制备和纯化,将从标本处理到结果报告的时间由24~28 h缩短至16 h,降低人工操作且减少微生物污染。
2.2 干试验 干试验是mNGS 的重要环节,是对测序产生的原始数据进行处理和分析,包括生物信息学分析及实验室对数据的解释。生物信息学分析包括数据质控、人源序列比对过滤、微生物物种检测等流程,由数据质控软件(如FastQC)、比对软件(如BWA)、物种分析软件(如Taxonomer[17])共同完成。解读报告时,作为无菌标本,血浆应与正常有菌部位,如呼吸道、开放性伤口等进行区分。但也需排除临床采样污染、实验室环境背景微生物等对检测结果的干扰。
3 血浆mcfDNA mNGS 在感染性疾病中的应用
近30年来,血浆cfDNA逐渐成为临床检测中不可缺少的生物标志物,常用于产前筛查、移植和肿瘤个体化治疗等。随着对mcfDNA的认识加深,血浆mcfDNA mNGS 在感染性疾病检测中取得快速进展,临床主要应用于血流感染、常见呼吸系统细菌性感染以及侵袭性真菌感染等。
3.1 血流感染 血流感染易导致脓毒症甚至感染性休克。2016年,Grumaz等[18]报告了一个完整的mNGS 诊断流程,从采样到结果报告的30 h内,从血浆标本中识别出导致脓毒症的病原体。该研究还显示,脓毒症患者与健康志愿者相比,血浆mcfDNA浓度显著升高(9.82% vs 3.50%)。本实验室及其他团队研究表明,与传统培养方法相比,mcfDNA mNGS显著提高了脓毒症标本的病原体检出率(约提高20%~30%)(表2),为制定合理的抗生素治疗方案和揭示脓毒症患者的病原体谱提供有用的信息[19-22]。2019 年,Blauwkamp等[11]提出了第一个商业化的定量血浆mNGS 试验(Karius试验),以每微升血浆中mcfDNA分子数作为检测信号值,可准确评估不同基因组大小的病原体丰度,从而识别和量化血浆中1 250个临床相关细菌、DNA 病毒、真菌和寄生虫来源的mcfDNA。同时,通过检测350 例疑似脓毒症患者的血浆标本,发现mNGS诊断脓毒症的敏感性为92.9%,特异性为62.7%;更有价值的是,对于2 周内接受过抗菌治疗的患者,mNGS 的病原体检出率明显优于血培养(47.9%vs 19.6%)。文献报道,在血流感染发生前3天,通过mNGS检测血浆中mcfDNA来预测儿科癌症患者血流感染发生的预测敏感性为75%(高于其预先定义的50%的有利值),特异性超过80%,显示mNGS 或可更好地辅助临床医生对血流感染发病时间作出预测[23]。但该研究未能覆盖到所有免疫低下人群,方法应用价值需要进一步探索。
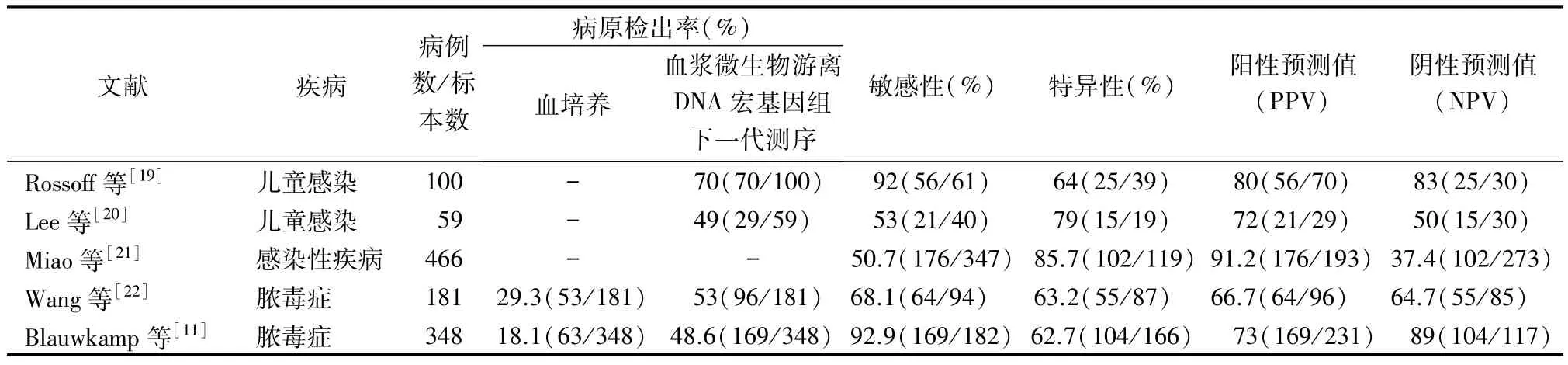
表2 血浆微生物游离DNA宏基因组下一代测序与初始血培养的性能比较
3.2 呼吸系统细菌感染 为了鉴定呼吸道病原体,通常进行细菌培养、PCR和抗原检测,但只能鉴定某一类目标微生物。Farnaes等[24]利用血浆mcfDNA 诊断社区获得性肺炎的敏感性达到86%(13/15),且47%(7/15)的儿童在抗生素管理方面发生了变化,而使用标准培养和PCR 方法识别出病原体的比例为47%。对于疑似肺部感染患者,Chen等[25]建议同时送检BALF和血液标本,mNGS 检测发现BALF 与早期血浆中的病原体高度一致,提示重症肺炎患者的病原体可能从肺部播散到血流,即血液中的病原体可能部分预测了肺部存在感染。与血浆相比,BALF 标本人源背景较高,导致微生物读数减少,从而降低了mNGS 的灵敏度[13]。为了对结核病进行早期诊断,可通过检测血液中的mcfDNA来确定感染的存在[26]。即使没有分枝杆菌血症,痰涂片阳性结核病患者的血浆中也可以检测到结核分枝杆菌复合群DNA[27]。Nomura等[28]发现对有心脏病手术史且存在分枝杆菌感染的患者进行血浆mNGS,可在标本采集后的第4天(中位数)检测到分枝杆菌,比标准的抗酸杆菌培养快1 个多月;并且发现即使患者存在抗生素暴露,也可以从血浆中检测到病原体cfDNA,表明mcfDNA可能是结核病检测和治疗监测中的一项有价值的生物标志物。
3.3 侵袭性真菌感染(invasive fungal infection,IFI) 2018年,Hong等[29]首次报道使用血浆mNGS 检测到IFI 患者感染的病原体核酸,其确诊依据为穿刺液或组织真菌培养或靶向测序。运用血浆mNGS,还在一名患有播散性疾病的肺炎患者中发现了侵袭性真菌病原体——组织胞浆菌[30],并在一名62岁患有移植物抗宿主病的造血干细胞移植(hematopoietic stem cell transplantation,HSCT)受者中检测到2种引起侵袭性疾病的真菌(小克银汉霉和Aspergillus lentulus),即混合感染[31]。Zhang 等[32]研究表明,与涂片及β-D-葡聚糖试验等常规方法相比,mNGS对肺孢子菌肺炎的检出率较好,并在血液、组织、BALF 和痰液中均检出肺孢子菌,检出病例中有3例为血浆mNGS 检出的不耐受支气管镜检查或拒绝侵入性手术的患者。本实验室对一名67岁重症肺炎患者连续2次进行血浆mNGS送检,均检出肺孢子菌,且随着病情进展,检出序列数逐渐增多且血清G 试验阳性。这与Zhang等[32]的报告一致,可能是由于患者免疫系统受损,导致肺孢子菌的核酸片段穿透局部感染部位而进入外周血。2019年欧洲癌症研究和治疗组织/侵袭性真菌感染协作组(European Organization for Research and Treatment of Cancer/Mycoses Study Group,EORTC/MSG)侵袭性真菌感染指南更新中指出,在痰液、BALF 等真菌易定植部位的标本中检出肺孢子菌和隐球菌核酸不可作为确诊指标[33]。血液中抗原、抗体和游离核酸的检测为不能体外培养的真菌感染的检测提供有力的支持依据。Armstrong等[34]报道mNGS能成功检测出儿科肿瘤、血液病和HSCT患者中的侵袭性真菌病原体,与从肺组织、胰腺假性囊肿液和头皮伤口中培养分离出的真菌相关,证明了血浆mNGS 能够从各种部位感染中检测出种水平的真菌病原体。
4 血浆mcfDNA mNGS 面临的挑战
4.1 分析前 合格的血浆标本是mcfDNA mNGS 成功的关键。实验室应制定合理的标本接收和拒收标准,若不满足接收标准但又不能对患者重新采样,可与临床有效沟通后实施让步mcfDNA mNGS。且mNGS 操作复杂,需要培养训练有素的实验室人员,在处理标本时避免错误和交叉污染。在Karius商品化试验中,标本需要满足以下标准:(1)使用EDTA-K2抗凝;(2)血浆量不少于1.2 mL;(3)必须在采血后96 h内分离血浆;(4)应将新鲜(在抽血后4 d内)或冷冻的标本送往实验室[11]。由于血浆标本中mcfDNA的水平通常是微量的,人源DNA容易降低mcfDNA的检测灵敏度(导致假阴性),而外源微生物DNA 污染将增加结果解释的复杂性(导致假阳性),因此,可通过一系列方法减少DNA污染。例如,在取样和处理标本过程中,医务人员应该穿上防护服和保护设备(实验室外套、口罩和一次性手套)覆盖所有暴露的皮肤,以减少污染物进入标本[35]。实验流程如耗材和试剂的制备、血浆分离和分样等,需尽可能在干净、隔离的工作环境中完成。此外,阴性对照(如取样空白对照)、试剂评估是监测实验室和标本交叉污染的重要方法[15]。
4.2 分析中 提取试剂决定了回收cfDNA的质量。一项商业化cfDNA提取试剂盒评估试验发现,提取柱法得到的游离核酸片段大小分布与原始添加的较为一致且总回收率更高,而磁珠法比提取柱法成本更低、流程更简单[36]。研究发现,脓毒症患者血浆中mcfDNA 在150~200 bp 处有一个主峰,且比人类cfDNA更碎片化[8]。基于此,Burnham 等[7]开发了用于cfDNA 测序的单链DNA(ssDNA)文库制备方法,其被证明在回收血浆中细菌和病毒的短片段cfDNA方面比双链DNA(dsDNA)文库制备方法更灵敏。除了提取试剂盒,全流程中各种试剂的选择都应考虑生产过程中的工程菌和环境污染微生物的核酸残留及其对检测的影响。
湿实验部分操作时间长,存在重复的移液操作,为减轻工作人员压力,可将工作流程分成多个独立的步骤,通过人员轮换来执行,有助于避免实验室错误。为了确保mNGS分析的质量和稳定性,需要具有良好特性的参考标准和对照样本。可以开发由微生物核酸组成的混合物作为外部对照,以确定检测限。常见的阴性对照为不含任何微生物核酸的标本,可使用经确认的临床阴性标本、商品化的人源模拟标本或核酸提取试剂的洗脱缓冲液等。自制的质控品均应有详细的制备流程及验证记录,可供查询[37]。
4.3 分析后 针对血浆mcfDNA 进行mNGS 检测时,检出序列可能属于致病微生物、标本污染、死亡微生物裂解,或是定植菌群所致的一过性菌血症,需要从临床的角度综合分析。目前,mNGS 发现的微生物的感染依据主要有[38]:(1)覆盖率(物种水平)明显大于任何其他微生物或阴性对照中的覆盖率,或严格比对序列数位于微生物列表的前几位;(2)与传统检测方法结果一致;(3)在治疗过程中,测序读数或病原体载量显著减少;(4)经靶向抗菌药物治疗后患者病情好转。然而,对mNGS 结果的报告在临床上仍未实现标准化和统一化。为了对测序结果进行合理和准确的解释,可参考以下方法:(1)对健康人血浆进行测序,以建立和维护一个基准数据库,显示阴性人群中微生物cfDNA 的类型和数量。(2)生信分析结果中疑似背景菌同样会对病原诊断结果产生影响,应该建立本实验室的背景微生物数据库以控制假阳性结果。(3)开发统计模型,以提高自动识别真实病原体的能力。Brenner 等[39]创建了脓毒症指示量器(SIQ)评分,以区分信号读数与脓毒症患者血液标本中的污染物或共生物种引起的干扰。(4)在向临床报告最终阳性结果之前,应考虑其他方法(如培养、血清学检测、组织病理学、ddPCR、Sanger测序等)来交叉验证病原体或感染的存在。有文献认为,现有的血浆cfDNA 测序技术仍需提高灵敏度,因此不能作为独立或排除试验使用,需结合临床证据及常规培养手段[40]。(5)有必要建立一个多学科的团队来评估检测结果的临床意义或对实验室人员进行生物信息学和生物学方面的综合培训[13]。此外,mcfDNA mNGS无法鉴定与人类感染相关的RNA病毒,包括丙型肝炎病毒、人类免疫缺陷病毒、鼻病毒、呼吸道合胞病毒、冠状病毒、诺如病毒等。为了鉴定以上RNA病毒,常见的替代方法包括血清学测试、qPCR、RNA-seq以及非靶向的mNGS RNA检测技术。
5 结语
综上所述,在一个新病原体不断出现的时代,除了用改进的技术提高检测效率外,不应盲目期待单一技术的完美结果。尽管血浆mcfDNA mNGS 在临床检测技术上仍有诸多挑战,但其在疾病的预测、诊断、预后等方面均取得了较好的结果,改变了既往感染性疾病的诊断模式。相信在不久的未来,越来越多的实验室可以进行本地化的血浆mcfDNA mNGS,有机结合流行病学、临床表现、影像学和其他生物标志物等参数,改善患者诊疗、预后和抗菌药物管理。
