黄桃表面污染真菌的分离与鉴定
2021-08-28孟佳佳郭文博王建华聂冬霞
孟佳佳,范 楷,郭文博,王建华,聂冬霞,韩 铮
(上海市农业科学院农产品质量标准与检测技术研究所,上海市设施园艺技术重点实验室,上海201403)
我国是桃原产国,也是产桃大国。上海地区桃树栽培历史悠久,“南汇水蜜桃”、“金山蟠桃”和“奉贤黄桃”相继被列为国家地理标志保护农产品[1]。黄桃(Amygdalus persicaL.),又称黄肉桃,属于蔷薇科桃属,黄桃的果皮、果肉均呈金黄色至橙黄色,肉质致密而韧,粘核者多。黄桃果实含有丰富的维生素C和大量人体所需的纤维素、胡萝卜素、番茄黄素、番茄红素及多种微量元素[2],具有益气血、生津液、抗肿瘤、增强免疫力等功效,在抗癌药物及保健品的研制上具有良好的开发应用前景[3]。近年来,南方地区鲜食黄桃的消费量持续上升,促使黄桃种植面积逐年扩大[4]。
黄桃一般成熟于高温多雨的夏季,采收、贮藏、运输、销售等各个过程均会造成其结构、营养物质和生理品质的变化,并且果实富含糖分及其他营养成分,易受到微生物的侵染,从而导致腐烂或腐败,严重影响其商品性及经济价值,部分霉菌还可能产生真菌毒素,给消费者带来了巨大的安全隐患[5-6]。真菌毒素是真菌在适宜条件下产生的有毒次级代谢产物,可导致DNA损伤和细胞毒性,低浓度下即可对人和动物健康造成危害,使肝脏、肾脏和胃肠道发生病变,甚至致癌、致畸、致突变等[7-8]。据报道,在被真菌侵染的桃、樱桃等水果中均能检测出少量的链格孢菌毒素和赭曲霉毒素,且去除腐烂部位后仍可检测到毒素的存在[9-10]。Reddy等[11]从桃等多种水果中检测出了展青霉毒素。可见,真菌污染在桃上的发生极其常见,但有关黄桃中污染真菌的种类及发生规律目前尚不清楚。本研究拟对上海地区黄桃样本中的真菌进行分离鉴定,旨在明确黄桃中污染真菌的种类及污染程度,分析可能造成的毒素污染风险,为防控黄桃中真菌毒素污染提供理论依据。
1 材料与方法
1.1 试剂与培养基
PDA培养基(上海源叶生物科技有限公司),基因组DNA小量制备试剂盒(TIANGEN,DP305),DNA凝胶回收试剂盒(美国AXYGEN公司),LA Taq DNA聚合酶(上海桑尼生物科技有限公司)和DNA Marker[宝生物工程(大连)有限公司]。
1.2 样品采集
从上海市奉贤区、闵行区、长宁区、徐汇区和嘉定区的超市内随机采集生理成熟度一致、大小均匀的黄桃样品各3份,共15份,同时从上海市农业科学院庄行综合试验站和上海市农业科学院金山果树试验站采集黄桃样品,各4份,共8份,合计23份黄桃样品,每份样品5个黄桃。样品采集后装入无菌塑料包装袋中,带回实验室后4℃保存,并于当天进行菌株的分离。
1.3 试验方法
1.3.1 菌株的分离
对采集的黄桃样品进行预处理:用75%的乙醇漂洗2—3 min,无菌水冲洗2—3次,用灭菌滤纸吸干多余水分,置于无菌滤纸上晾干。用无菌刀切取黄桃果实健康部位与病斑交界处的新鲜组织(0.5 cm×0.5 cm)置于PDA培养基上,28℃黑暗培养2—3 d后,采用尖端菌丝挑取法,挑取形态不同的菌丝或菌落,将其移接到新鲜PDA培养基上进行纯化,之后转接到斜面培养基上,4℃保存备用。
1.3.2 真菌的形态鉴定
用灭菌牙签挑取纯化后菌株的少量菌丝于PDA平板中央,于28℃真菌培养箱中黑暗培养5—10 d后观察菌落的培养性状和显微特征。在载玻片中央滴加1—2滴无菌水,用灭菌牙签挑取少量真菌菌丝,放入载玻片上的无菌水中,使菌丝充分浸入,用牙签让菌丝分开,避免菌丝堆叠。加盖洁净的盖玻片,轻轻按压制成压片,于显微镜(Eclipse E200,Nikon,日本)下观察菌丝和孢子形态。
1.3.3 真菌的ITS分子鉴定
采用试剂盒进行真菌基因组DNA的提取,采用通用引物ITS1∕ITS4[12]对真菌ITS区进行PCR扩增,引物序列如下,ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTATTGATATGC-3’。PCR扩增体系:DNA模板1μL(约20 ng),10×PCR Buffer(含2.5 mmol∕L Mg2+)5μL,5 U∕μL Taq聚合酶1μL,10 mmol∕L dNTP 1μL,10 mmol∕L ITS1和ITS4引物各1.5μL,dd H2O加至50μL。反应程序:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,35个循环;72℃延伸5 min,4℃保存。PCR产物经AxyPrep DNA凝胶回收试剂盒回收纯化后由上海桑尼生物科技有限公司进行序列测定,获得菌株完整的ITS序列;用NCBI Blast程序将拼接后的序列文件与NCBI核酸数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息;通过Bankit将获得的菌株ITS序列提交至NCBI数据库,利用MEGA 6.0软件进行同源性比对,采用邻近法(Neighbor-Joining,NJ,bootstrap=1 000)构建系统发育树,分析序列进化关系。
2 结果与分析
2.1 黄桃表面污染真菌的分离与鉴定
从上海地区采集的23份黄桃样品中共分离得到59株真菌,通过形态学特征和18SrDNA的ITS序列比对分析对分离到的真菌进行鉴定,结果显示:59株真菌分属于12个属,包括链格孢属Alternaria、镰刀菌属Fusarium、拟茎点霉属Phomopsis、枝孢属Cladosporium、曲霉属Aspergillus、青霉属Penicillium、葡柄霉属Stemphylium、耐碱酵母属Galactomyces、拟青霉属Paecilomyces、丝核菌属Rhizoctonia、小丛壳属Glomerella、拟暗球腔菌属Phaeosphaeriopsis。其中链格孢属的真菌有24株,比例高达40.7%,镰刀菌属真菌12株,占20.3%(表1)。可见,链格孢属和镰刀菌属真菌为黄桃表面污染的主要真菌。
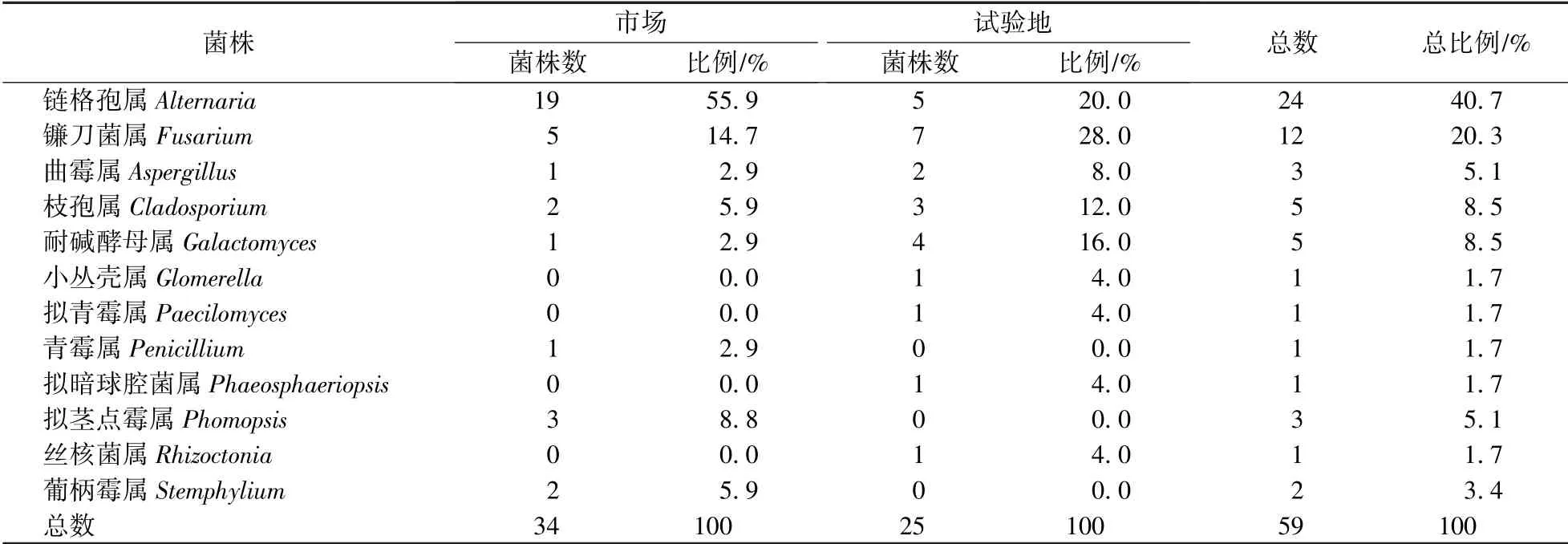
表1 上海地区黄桃样本中污染真菌鉴定结果Table 1 Identification of fungi contamination on surface of yellow peach collected from Shanghai
2.2 不同来源黄桃表面真菌的比较
比较不同来源(市场和试验地)的黄桃样本表面真菌差异(表1)发现,从市场采集的黄桃样品中,链格孢菌的数量最多,比例高达55.9%,其次为镰刀菌,比例为14.7%。从试验地里采集的黄桃样本中镰刀菌属菌株分离数量最多,比例为28.0%,其次是链格孢属真菌,比例为20.0%。从市场采集的黄桃样本中分离得到的菌株数量(34株)明显高于从试验地里分离到的菌株数(25株)。
2.3 主要真菌的形态学鉴定
从23份黄桃样本中共分离得到59株真菌,其中链格孢属和镰刀菌属是最主要的两种类型,占60%以上(表1)。如表2所示,分离到的24株链格孢属真菌中共有3个种,分别为A.tenuissima、A.alternata、A.ochroleuca,其中A.tenuissima的数量最多,占比高达62.5%,且其主要是从市场采集的样品中分离得到。A.alternata在链格孢属中的分离比例达29.2%。A.ochroleuca在链格孢属中的分离比为8.3%,在试验地和市场样品中的分离比例为1∶1。分离到的12株镰刀菌属真菌至少有3个种,分别为砖红镰刀菌F.lateritium、尖孢镰刀菌F.oxysporum和厚垣镰刀菌F.chlamydosporum。另外,还有3株镰刀菌未鉴定出种的类型。砖红镰刀菌F.lateritium的种类最多,比例达58.3%,且其主要是从市场采集的样品中分离得到。3株未鉴定出种的真菌均是从试验地采集的样品中分离得到。
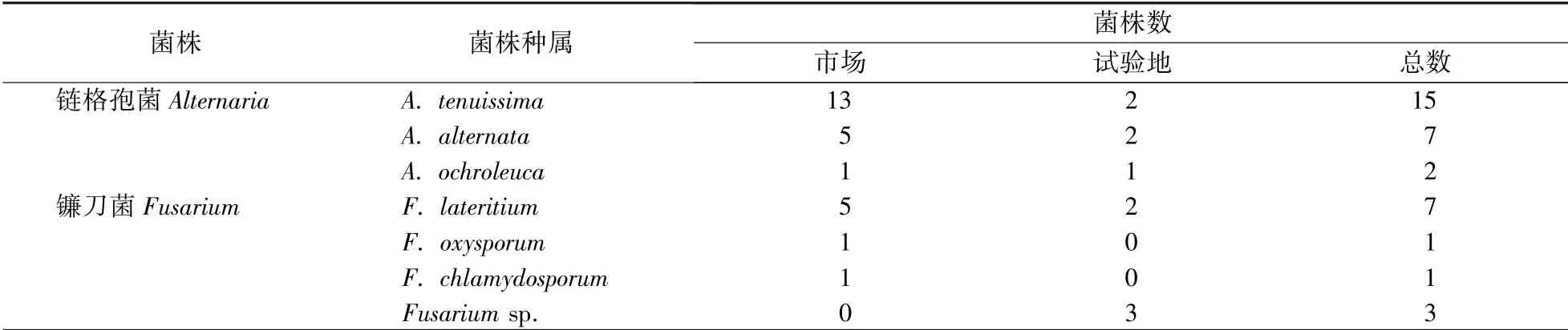
表2 链格孢属和镰刀菌属菌株数量Table 2 Number of Alternaria and Fusarium fungi
以菌株YP28为例,对典型的链格孢属真菌进行鉴定,发现菌株YP28在PDA培养基上生长迅速,2 d后长出乳白色簇状菌丝,随着培养时间的延长,菌丝体由白色变成灰褐色,最后变成黑色(图1)。菌丝褐色,中间有分隔。菌株产孢量丰富,孢子淡褐色至褐色,表面光滑或有微刺。分生孢子倒棍棒形、卵形或近椭圆形,具横隔、纵隔或斜隔,分隔处缢缩明显,孢身中部的隔膜较粗,呈黑褐色,喙呈柱状。通过查阅中国真菌志[13]将其鉴定为交链格孢(A.alternata)。
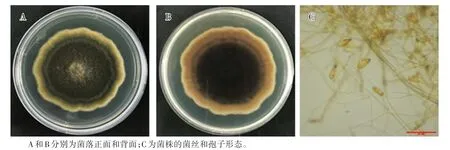
图1 菌株YP28的形态特征Fig.1 Morphological characterization of isolate YP28
以菌株YP05为例,对典型的镰刀菌属真菌进行鉴定,发现菌株YP05在PDA培养基上生长5 d后,呈圆形或近圆形菌落,边缘整齐呈放射状。菌株生长迅速,初期为白色,后期呈浅粉色。小型分生孢子为单孢、假头状着生,呈卵圆形或肾形;大型分生孢子呈镰刀形,略弯曲,两端细胞稍尖,1—7个隔膜,多数为3个隔膜。厚垣孢子呈球形或近球形,表面光滑,壁厚,产孢细胞直接生长在菌丝上,或丛生状着生在分生孢子座上。查阅中国真菌志[13]将其鉴定为尖孢镰刀菌(F.oxysporum)。
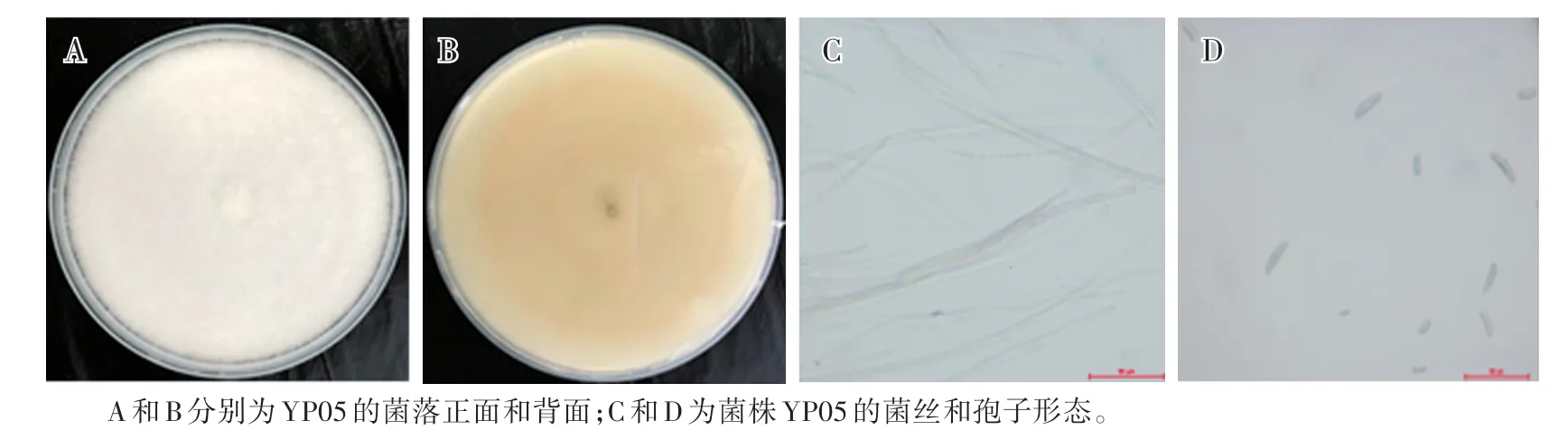
图2 菌株YP05的形态特征Fig.2 Morphological characterization of isolate YP05
2.4 主要真菌的分子生物学鉴定
用ITS1∕ITS4引物对真菌DNA进行扩增,获得18SrDNA的ITS序列。测序结果表明,菌株YP28的ITS片段为525 bp(图3a),经BLASTn比对,所得到的ITS序列与链格孢菌属(Alternariasp.)的真菌序列相似度达99.8%。系统进化分析显示,YP28的ITS序列与GenBank数据库已报道的A.alternata亲缘关系很近(图4a),故将其命名为A.alternateYP28(GenBank登录号为MT647244)。
菌株编号为YP05的ITS片段大小为516 bp(图3b),经BLASTn比对后,该株菌的ITS序列与镰刀菌属(Fusariumsp.)ITS序列相似性为99.61%。系统进化分析显示,所分离得到的YP05菌株与已报道的F.oxysporum亲缘关系较近(图4b),故将其命名为F.oxysporumYP05(GenBank登录号为MT647243)。
图3 黄桃中链格孢菌(a)和镰刀菌(b)ITS区PCR产物电泳检测Fig.3 PCR product of ITS sequence of Alternaria sp.(a)and Fusarium sp.(b)isolated from yellow peach
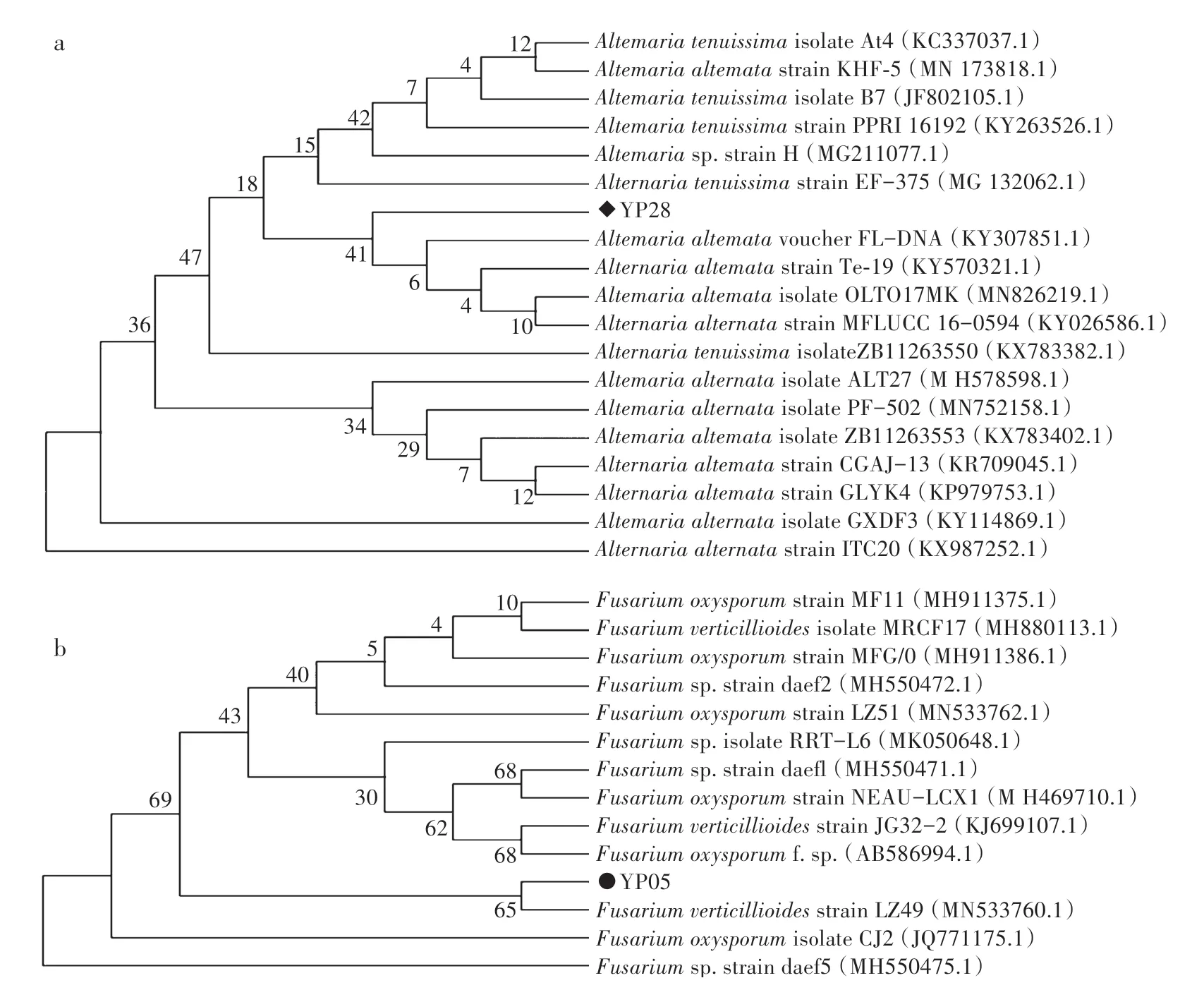
图4 链格孢菌属(Alternaria sp.)和镰刀菌属(Fusarium sp.)真菌的系统发育树Fig.4 Phylogenetic trees of Alternaria sp.and Fusarium sp.
3 讨论
黄桃是上海及周边地区重要的经济型果树,上海地区黄桃成熟期正值梅雨季节,高温、高湿的特殊环境致使黄桃易遭受多种真菌的侵染,导致果实腐烂或腐败,严重影响其商品性,且病斑处产生的大量真菌毒素等次生物质会给人畜带来一定的安全风险。本研究从上海地区黄桃样本中共分离得到59株真菌,分属于12个属,其中链格孢属的真菌所占比例高达40.7%,镰刀菌属真菌占20.3%,表明黄桃污染真菌种类复杂、多样,其中链格孢属和镰刀菌属真菌为污染黄桃的主要真菌。本研究为有针对地进行病害防治及潜在真菌毒素的污染筛查奠定了基础。
与传统的形态学鉴定相比,分子生物学方法在真菌鉴定上更为有效,在进行污染菌种鉴定时,越来越多的科研工作者将形态学观察与分子生物学的方法相结合以保证鉴定结果准确可靠[14-15]。ITS区高度保守、进化速度快、片段小、易于分析,被广泛应用于真菌属内不同种间或近似属间的系统发育研究[16]。霍鹏升[17]利用形态学方法将从桃黑斑病病枝和病果中分离纯化的菌株初步鉴定为杏链格孢(A.armeniacae),通过ITS序列分析,发现分离菌株与GenBank中链格孢属真菌相似性达99%。纪兆林等[18]利用rDNA-ITS序列和系统进化分析对我国8个不同产区桃褐腐病病原菌进行分离和鉴定,发现我国桃产区褐腐病菌主要以果生链核盘菌(Monilinia fructicola)为主。本研究利用形态学方法将从黄桃上分离到的2株菌株分别鉴定为链格孢属真菌(Alternariasp.)和镰刀属真菌(Fusariumsp.),ITS序列分析显示菌株YP28和YP05与A.alternate和F.oxysporum的相似性分别为99.8%和99.6%,这与形态学鉴定结果相吻合。
黄桃受真菌污染的原因很多,田间收获时,果园管理水平、环境温度、湿度、栽培品种、果实的损伤状况等均会造成黄桃不同程度的真菌污染[19-20]。黄桃采摘后所处的储藏环境及搬运过程中受到的损伤均会造成黄桃表面污染真菌的变化[21]。本研究中,试验地里采摘的黄桃表面的污染真菌与市售黄桃表面的污染真菌的种类存在一定的差异,试验地采集的黄桃样本中,镰刀菌是主要污染真菌,这可能与试验地的栽培环境密切相关。而市售的黄桃样本中链格孢菌为主要真菌,这或许是由黄桃在运输、储藏等过程中的真菌暴露水平不同所引起。
很多链格孢属真菌的菌种均可产生链格孢霉毒素,而交链格孢(A.alternate)被认为是主要的产毒菌种,其他的产毒菌种有细极链格孢(A.tenuissima)、乔木链格孢(A.arborescens)等[22]。本研究分离得到24株链格孢菌株,其中细极链格孢(A.tenuissima)15株,交链格孢(A.alternate)7株,说明黄桃中存在链格孢霉毒素污染的风险。镰刀菌(Fusariumsp.)是最主要的植物病原菌之一,可引起100多种植物发病,严重影响农作物的产量,大多数的镰刀菌均可产生镰刀菌毒素[23]。本研究共分离到红镰刀菌(F.lateritium)7株、尖孢镰刀菌(F.oxysporum)1株和厚垣镰刀菌(F.chlamydosporum)1株,另外,还有3株镰刀菌未鉴定出种的类型。可见,黄桃中也存在镰刀菌毒素污染的潜在风险。上述结果为了解可能造成黄桃污染的真菌毒素提供了一定的科学依据。
4 结论
本研究对上海地区黄桃样本中的污染真菌进行分离和鉴定,共鉴定出59株真菌,其中链格孢属和镰刀菌属真菌的污染严重,这为后续黄桃的病害防治奠定了基础。
