ALI时MicroRNA-21通过PTEN调控PI3KAKT途径影响MSC存活的研究
2021-08-27邵建平蔡施霞孙运波方巍刘冰李连弟
邵建平 蔡施霞 孙运波 方巍 刘冰 李连弟
感染、创伤、休克、输血等均可造成肺毛细血管内皮细胞弥漫性损伤、肺泡上皮细胞弥漫性损伤,进而出现急性肺损伤(acute lung injury,ALI)[1]。急性肺损伤是以机械通气为主的器官支持治疗,肺损伤的修复主要依靠残留肺组织自身的增殖和分化修复能力受到限制,且容易导致损伤后肺泡结构的毁损和肺纤维化;因此,外源性给予间充质干细胞(mesenchymal stem cells,MSC)为ALI的损伤修复提供了新的途径。外源性予以间充质干细胞(mesenchymal stem cells,MSC)源于中胚层,具有高度自我更新能力和多向分化潜能;临床前期试验证实予以外源性间充质干细胞可以归巢至损伤肺组织,分化为肺泡上皮细胞、肺血管内皮细胞促进损伤肺组织的修复,提高急性肺损伤的生存率。但MSC移植后存活率极低,移植入肺自身细胞的数量少,MSC能表达多种microRNAs(miRNAs)在自身增殖及凋亡中发挥重要作用;因此,探讨ALI时调节MSC凋亡、增殖相关的miRNAs及其作用机制有助于为增加移植后的细胞存活率找到新的治疗靶点[2]。本研究观察急性肺损伤时miRNA-21通过磷酸酯酶一张力蛋白同源物(phosphatase and tensin homology,PTEN)调控PI13K/AKT信号通路途径影响间充质干细胞存活的研究,现报道如下。
1 资料和方法
1.1 试验动物
2020年3 月—2020年9月中国人民解放军第三军医大学大坪医院动物中心提供的清洁级SD大鼠120只,体质量为50 g,雄性,许可证号SCXK(渝)2012-0005。根据随机对照法分组,分为空白对照组(n=40)、ALI组(n=40)、MSC处理组(n=40),三组的平均体质量、性别等资料大体一致(P>0.05),差异不具有统计学意义。
1.2 仪器与试剂
细胞培养室、苏州净化设备有限公司生产的超净工作台、美国Thermo提供的二氧化碳恒温培养箱、德国Eppendorf Centrifuge高速冷冻离心机、实时定量荧光PCR仪、赛默飞Applied Biosystems基因扩增仪、Invitrogen微型水平电泳仪、美国BIO-RAD伯乐高压电泳仪、日本OLYMPUS生产的TMS-1015型光学倒置显微镜、德国OLYMPUS生产的倒置荧光显微镜,广州迪奥生物科技有限公司Deaou-380C恒温荧光检测仪、Bio-Rad蛋白电泳和转印系统、德国Forma Scientic -80℃低温冰箱、电子天平、德国 Forma Scientic A200S型电子分析天平、Spectre Max 250 酶标仪等设备。武汉博士德生物公司生产的兔抗大鼠PTEN多克隆抗体、兔抗大鼠P-AKT多克隆抗体、兔抗大鼠T-AKT多克隆抗体,广州锐博生物科技公司生产的Mir-21模拟物及阴性对照。
1.3 方法
(1)H2O2/SD刺激间充质干细胞,明确miR-21对MSC凋亡和增殖的调节及其机制:分离培养SD大鼠脊髓间充质干细胞(MSC),流式细胞学检验细胞表面标志,诱导分化能力检测,1 h、2 h、6 h或24 h后,Annexin V-FTTC+PI FCM分析细胞凋亡;MTS法分析细胞增殖;台盼蓝染色法LDH测定细胞活力;RT-PCR法检测PTEN、PI3K、Akt、Bcl2基因表达;westem blot检测PTEN、PI13j、Akt Bcl2蛋白表达;(2)高表达miR-21的MSC在ALI小鼠体内凋亡和肺保护作用的研究:分离培养SD大鼠脊髓MSC,流式细胞学检验细胞表面标志,诱导分化能力检测,分为野生型MSC、miR-21MSC、沉默PTEN的miR-21-MSC、LY294002处理的miR-21-MSC;SD雄性大鼠,分为三组,空白对照组:气道注入NS;ALI组气道注入LPS;MSC处理组气道注入LPS;MSC处理组30 min后尾静脉注射MSC;ALI组30 min后尾静脉注入NS;1 h、6 h、24 h或3 d后处死;荧光显微镜观察MSC存留率、免疫荧光共定位、Tunel法分析MSC细胞凋亡情况;活体发光荧光成像系统分析MSC移植后凋亡情况;损伤肺组织评分分析肺组织病理学;肺湿/干重比Evans蓝检测肺血管屏障通透性分析肺水渗出情况。
1.4 评估标准
阳性信号评估标准[3]:棕黄色颗粒状为阳性表达信号,Bcl-2、AKT mRNA、PI3K阳性信号位于细胞质,AKT位于细胞膜及细胞质,PI3K mRNA阳性信号位于细胞核及细胞质。Tunel法表达评估标准[4]:阳性信号:黄绿色荧光,蓝色荧光为无凋亡小体的细胞核,凋亡指数:每张切片在高倍镜下选择不同视野5个,观察每个视野的100个细胞,计算凋亡细胞所占的百分比,并计算平均值,平均值为凋亡细胞计数与细胞总数的百分比。
1.5 统计学方法
全部数据传输至SPSS 21.0软件处理分析,计量资料为t检验,采用(±s)表示,计数资料为χ2检验,采用(n,%)表示,P<0.05则差异具有统计学意义。
2 结果
2.1 空白对照组、ALI组、MSC处理组的PTEN、PI3K、Akt、Bcl2基因和蛋白表达水平分析
ALI组、MSC处理组的PTEN、PI3K、Akt、Bcl2基因和蛋白表达高于空白对照组,差异具有统计学意义(P<0.05);MSC处理组的PTEN、PI3K、Akt、Bcl2基因表达低于ALI组,差异具有统计学意义(P<0.05),见表1~3。
表1 空白对照组、ALI组PTEN、PI3K、Akt、Bcl2基因和蛋白表达分析 (±s)
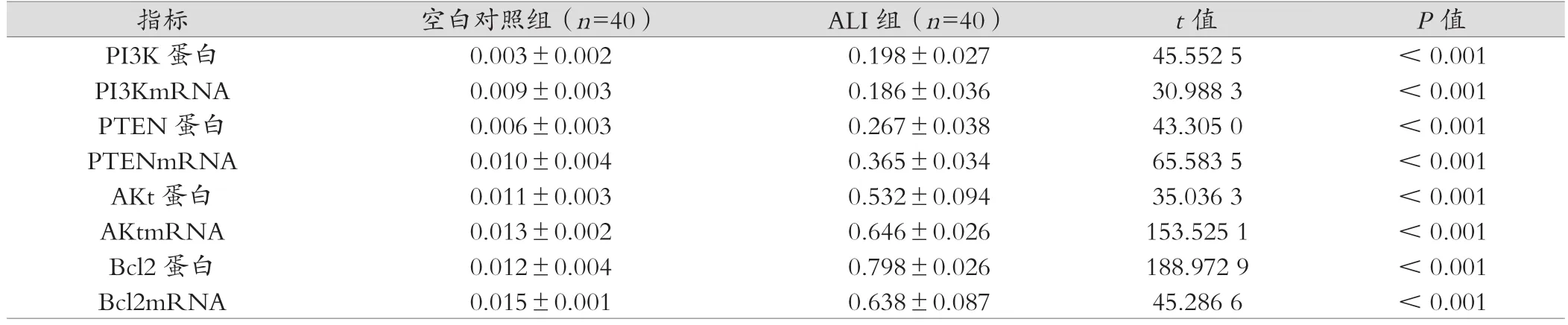
表1 空白对照组、ALI组PTEN、PI3K、Akt、Bcl2基因和蛋白表达分析 (±s)
指标 空白对照组(n=40) ALI组(n=40) t值 P值PI3K 蛋白 0.003±0.002 0.198±0.027 45.552 5 < 0.001 PI3KmRNA 0.009±0.003 0.186±0.036 30.988 3 < 0.001 PTEN 蛋白 0.006±0.003 0.267±0.038 43.305 0 < 0.001 PTENmRNA 0.010±0.004 0.365±0.034 65.583 5 < 0.001 AKt蛋白 0.011±0.003 0.532±0.094 35.036 3 < 0.001 AKtmRNA 0.013±0.002 0.646±0.026 153.525 1 < 0.001 Bcl2 蛋白 0.012±0.004 0.798±0.026 188.972 9 < 0.001 Bcl2mRNA 0.015±0.001 0.638±0.087 45.286 6 < 0.001
2.2 不同MSC细胞表面标记诱导分化的MSC存留率、MSC移植后细胞存活率分析
LY294002处理的miR-21-MSC标记细胞、沉默PTEN的miR-21-MSC标记细胞的MSC存留率、MSC移植后细胞存活率高于miR-21-MSC、野生型MSC细胞,肺湿/干重比低于miR-21-MSC、野生型MSC细胞,差异具有统计学意义(P<0.05),见表4。
表4 不同MSC细胞标记诱导分化的MSC存留率、MSC移植后细胞存活率分析(±s)

表4 不同MSC细胞标记诱导分化的MSC存留率、MSC移植后细胞存活率分析(±s)
注:*P<0.05,与其他组相比;#P<0.05,与miR-21-MSC细胞、野生型MSC细胞相比
细胞表面标记 MSC存留率(%) MSC移植后细胞存活率(%) 肺湿/干重比LY294002 处理的 miR-21-MSC 79.09±10.69* 76.36±9.78* 4.34±0.16*沉默的 PTENmiR-21-MSC 64.60±7.85# 60.89±6.25# 4.52±0.21#MiR-21-MSC 细胞 30.01±3.23 28.64±0.98 6.35±0.36野生型 MSC 细胞 20.01±2.36 18.83±1.53 8.40±0.43
3 讨论
本研究观察急性肺损伤(ALI)时miRNA-21通过磷酸酯酶一张力蛋白同源物(PTEN)调控PI13K/AKT信号通路途径影响间充质干细胞(MSC)存活情况,结果显示:ALI组、MSC处理组的PTEN、PI3K、Akt、Bcl2基因和蛋白表达高于空白对照组,差异具有统计学意义(P<0.05);MSC处理组的PTEN、PI3K、Akt、Bcl2基因表达低于ALI组,差异具有统计学意义(P<0.05);LY294002处理的miR-21-MSC标记细胞、沉默PTEN的miR-21-MSC标记细胞的MSC存留率、MSC移植后细胞存活率高于miR-21-MSC、野生型MSC细胞,肺湿/干重比低于miR-21-MSC、野生型MSC细胞,差异具有统计学意义(P<0.05),与张莉珊等[5]的研究结果大体一致,间充质干细胞可通过旁分泌调节内皮和上皮的通透性,调节免疫减轻炎症反应,以及抑制细菌的生长[6-7];体外模拟急性肺损伤时MSC的生存环境,观察MSC的凋亡和增殖,miRNA-21及其靶基因PTEN和PI3K/Akt信号通路相关因子的表达,明确miRNA-21对ALI时MSC凋亡和增殖调节作用及其具体分子机制[8];通过移植入高表达miR-21的MSC,在体实验证实ALI时miR-21能通过靶基因PTEN和PI3K/Akt信号通路促进MSC增殖、抑制凋亡,提高MSC移植后存活效率,并能增强在体MSC修复肺损伤和保护肺功能的作用[9-10]。
本研究的创新点在于关注miR-21对ALI时MSC凋亡和增殖的作用及调节机制。首次提出miR-21通过其靶基因PTEN及PI3K/Akt信号途径调控ALI时MSC的凋亡和增殖,增加ALI时MSC移植后存活率的假设[11-12];通过转染调节miR-21的表达,测定其靶基因PTEN及PI3K/Akt信号通路关键分子的变化,并观察MSC的凋亡和增殖,阐明miR-21调控MSC存活的具体机制,为提高MSC治疗ALI的疗效提供了理论依据。研究发现,大鼠MSC中PTEN可能是miR-21潜在的作用靶基因;氧化应激条件下,MSC的miR-21的表达与PTEN的蛋白表达呈负性相关;MSC可减轻LPS诱导的ALI小鼠的病理改变和肺水的渗出。
表2 空白对照组、MSC处理组PTEN、PI3K、Akt、Bcl2基因和蛋白表达分析 (±s)
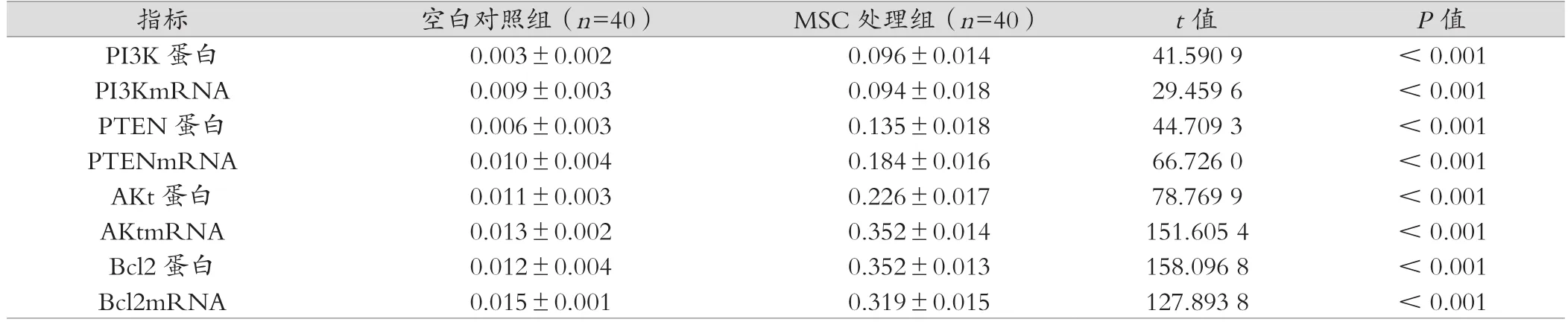
表2 空白对照组、MSC处理组PTEN、PI3K、Akt、Bcl2基因和蛋白表达分析 (±s)
指标 空白对照组(n=40) MSC处理组(n=40) t值 P值PI3K 蛋白 0.003±0.002 0.096±0.014 41.590 9 < 0.001 PI3KmRNA 0.009±0.003 0.094±0.018 29.459 6 < 0.001 PTEN 蛋白 0.006±0.003 0.135±0.018 44.709 3 < 0.001 PTENmRNA 0.010±0.004 0.184±0.016 66.726 0 < 0.001 AKt蛋白 0.011±0.003 0.226±0.017 78.769 9 < 0.001 AKtmRNA 0.013±0.002 0.352±0.014 151.605 4 < 0.001 Bcl2 蛋白 0.012±0.004 0.352±0.013 158.096 8 < 0.001 Bcl2mRNA 0.015±0.001 0.319±0.015 127.893 8 < 0.001
表3 ALI组、MSC处理组PTEN、PI3K、Akt、Bcl2基因和蛋白表达分析 (±s)
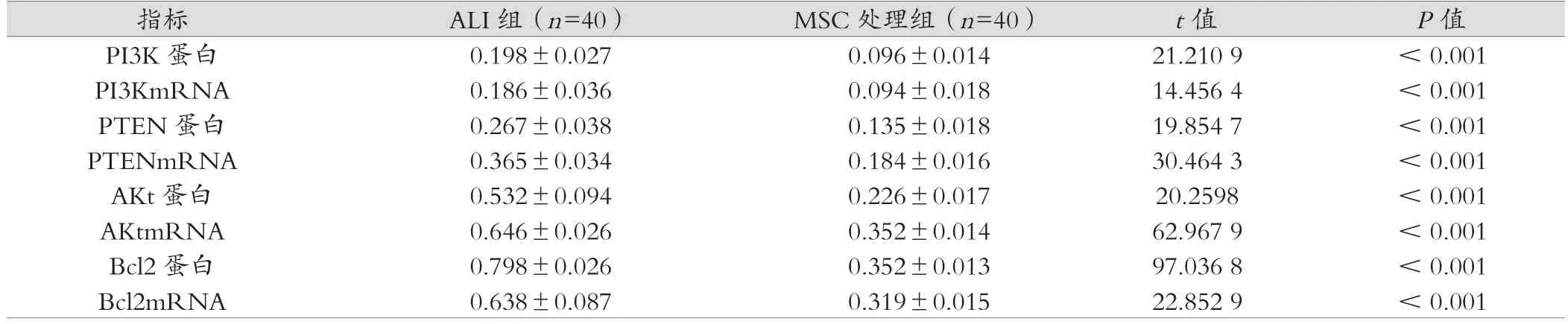
表3 ALI组、MSC处理组PTEN、PI3K、Akt、Bcl2基因和蛋白表达分析 (±s)
指标 ALI组(n=40) MSC处理组(n=40) t值 P值PI3K 蛋白 0.198±0.027 0.096±0.014 21.210 9 < 0.001 PI3KmRNA 0.186±0.036 0.094±0.018 14.456 4 < 0.001 PTEN 蛋白 0.267±0.038 0.135±0.018 19.854 7 < 0.001 PTENmRNA 0.365±0.034 0.184±0.016 30.464 3 < 0.001 AKt蛋白 0.532±0.094 0.226±0.017 20.2598 < 0.001 AKtmRNA 0.646±0.026 0.352±0.014 62.967 9 < 0.001 Bcl2 蛋白 0.798±0.026 0.352±0.013 97.036 8 < 0.001 Bcl2mRNA 0.638±0.087 0.319±0.015 22.852 9 < 0.001
综上所述,探讨ALI时调节MSC凋亡、增殖相关的miRNAs及其作用机制有助于为增加移植后的细胞存活率找到新的治疗靶点。
