左室射血分数<40%主动脉瓣关闭不全患者术后心功能恢复影响因素分析
2021-08-26岳凤捷尹宗涛韩劲松辛芳冉王辉山
岳凤捷,金 岩,祝 岩,尹宗涛,韩劲松,朱 岩,辛芳冉,王辉山
1.中国医科大学,辽宁 沈阳 110000;2.北部战区总医院 心血管外科,辽宁 沈阳 110016
近年来,主动脉瓣发病率及病死率逐年上升[1]。患者常因病情发现较晚或手术不及时,而出现严重的心力衰竭,或增加夹层动脉瘤的发生风险,其中,主动脉瓣病变包括主动脉瓣关闭不全(aortic incompetence,AI)、主动脉瓣狭窄(aortic stenosis,AS)或二者兼有,因主动脉瓣膜病变引起的左室容量负荷和/或压力负荷的明显增高[2],导致左室代偿性肥厚、增大,其中,以AI患者的预后更差,尤其是左室射血分数(left ventricular ejection fraction,LVEF)已经出现明显减低的患者[3-4],其超声特点为左室明显增大且收缩功能明显失代偿性减低。主动脉瓣置换(aortic valve replacement,AVR)仍是治疗此类患者积极主要的手段之一[5]。本研究旨在探讨AI合并LVEF<40%患者瓣膜手术后心功能恢复的影响因素。现报道如下。
1 对象与方法
1.1 研究对像 选取自2010年1月至2018年12月北部战区总医院收治的左室收缩功能减低(LVEF<0.40,Simpson法)的AI并行单纯AVR术的99例患者(伴有主动脉瓣不同程度的狭窄)为研究对象。排除标准:同时行冠状动脉旁路移植术的患者;同时行二尖瓣和/或三尖瓣置换的患者;合并先天性心脏病的患者,如房间隔缺损、室间隔缺损及动脉导管未闭的患者,但包括行主动脉瓣下隔膜剔除术及升主动脉置换术的患者。根据瓣膜术后6个月时左室收缩功能是否恢复将患者分为恢复组(n=52,LVEF≥0.50,Simpson法)与未恢复组(n=47,LVEF<0.50,Simpson法)。本研究经医院伦理委员会批准。患者均签署知情同意书。
1.2 研究方法 采用Philips iE33彩色多普勒超声诊断仪对患者进行检查,探头频率1~5 MHz。患者左侧卧位,平静呼吸,同步记录心电图,常规取标准心尖四腔心进行多普勒测量,脉冲多普勒测量二尖瓣口舒张早期前向血流峰速(Em)、三尖瓣口舒张早期前向血流峰速(Et)、二尖瓣舒张晚期前向血流峰速(Am)、三尖瓣舒张晚期前向血流峰速(At)。启动组织多普勒采集二尖瓣瓣环侧壁舒张早期峰速(Em′)、室间隔瓣环处舒张早期峰速(Ei′)及三尖瓣瓣环侧壁舒张早期峰速(Et′),计算二尖瓣Em/Em′、三尖瓣Et/Et′。启动连续多普勒检测三尖瓣反流峰速(tricuspid regurgitation velocity,TRV),以间接估测肺动脉收缩压(systolic pulmonary artery pressure,SPAP),SPAP=4V2+ΔP[ΔP为右房压力(10 mmHg),1 mmHg=0.133 kPa]。利用多普勒技术测量跨主动脉瓣瓣口的平均压差。应用连续及彩色多普勒对AI的程度进行分级评价,其半定量诊断标准:轻度为反流束颈宽<3.0 mm和/或反流频谱压力降半时间(pressure half time,PHT)>500 ms;中度为反流束颈宽3.0~6.0 mm和/或PHT 200~500 ms;重度为反流束颈宽>6.0 mm和/或PHT<200 ms[6]。所有数据采集均取患者呼气末3个心动周期的平均值。术后随访期间,所有患者均给予β-受体阻滞剂、血管紧张素转换酶抑制剂或血管紧张素受体阻滞剂及适当利尿等规范性抗心衰治疗。记录并比较两组患者术前的基本临床资料及超声数据。
1.3 AI行AVR的手术指征 (1)急性AI。一旦有明确的左心衰竭表现,应在明确诊断后限期或急诊手术;急性感染性心内膜炎者一旦发生急性AI,心功能显著恶化或出现左心衰竭,即使感染未能得到有效控制,也应限期或者急诊手术。(2)有症状的慢性AI。慢性AI一旦出现症状就是手术的绝对指征,而且是最佳的首要时机。因为,此时左室功能减退处于可逆阶段,术后左室功能和容积可以完全恢复正常。(3)无症状的慢性AI。这部分的手术指征尚未完全统一,目前,多认为有下列情况之一者,应手术治疗:①静息状态下心脏超声检查LVEF≤50%;②在保留型LVEF>50%的情况下,当注意到左心室舒张末期直径>70 mm或收缩末期直径>50 mm时,应考虑手术[7]。
1.4 外科手术方法 全身麻醉成功后,动、静脉穿刺置管测压,置飘浮导管。胸部皮肤消毒,铺无菌巾。取胸骨正中切口,心包悬吊,全身肝素化,行主动脉插管、经右心耳插腔房管,右上肺静脉根部留置左心引流管,建立体外循环,当鼻咽温降至30℃时,钳闭升主动脉,经左右冠状动脉开口顺行灌注心脏停搏液。常规行AVR术,观察瓣叶开闭是否良好,有无瓣周漏,左右冠状动脉开口显露清楚。用5-0prolene线双层连续缝合主动脉切口。头低位,升主动脉根部插排气针,排气,开放升主动脉,心脏除颤复跳,并行循环,循环稳定后逐步停体外循环,超滤。依次拔除主动脉插管、腔房管、左房管,鱼精蛋白中和肝素。缝心外膜起搏导线。分别置胸骨后、心包引流管各1根,严密止血,钢丝闭合胸骨,逐层关胸。
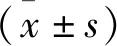
2 结果
2.1 两组患者的一般临床资料比较 两组患者的年龄、收缩压,以及高血压病病史、糖尿病病史、吸烟史、饮酒史、术前是否合并心房颤动的患者比例比较,差异均无统计学意义(P>0.05)。未恢复组患者的舒张压高于恢复组,差异有统计学意义(P<0.05)。见表1。
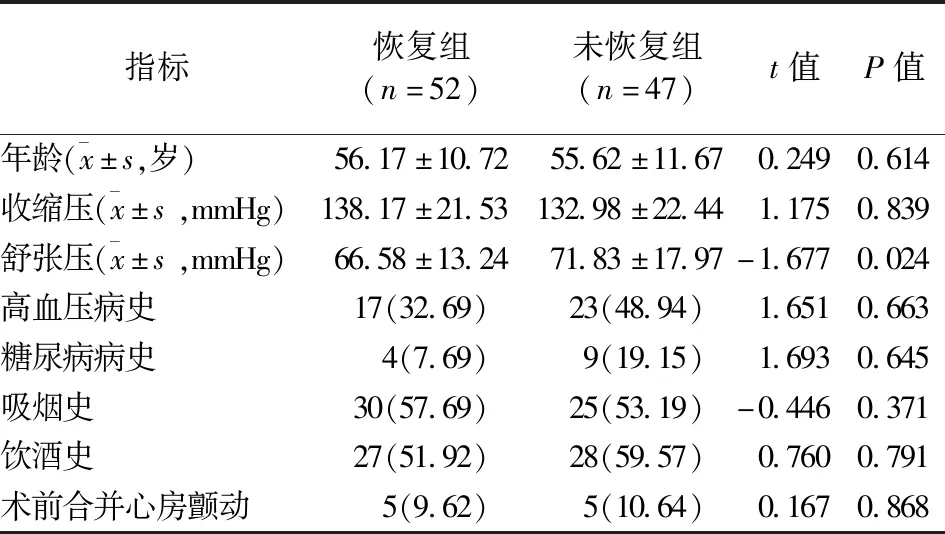
表1 两组患者的一般资料比较/例(百分率/%)
2.2 两组患者的超声相关指标比较 两组患者的术前LVEF、主动脉瓣瓣环内径主动脉窦部内径、主动脉窦管交界处内径、主动脉瓣前向血流峰速、估测主动脉瓣开口面积、主动脉瓣反流束宽、PHT、IVS、Em、Am、Em/Em′、Et、At、TRV及SPAP比较,差异均无统计学意义(P>0.05)。两组患者的术后LVEF、左房前后径(left atrial diameter,LAD)、左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、LVESV及Et/Et′比较,差异有统计学意义(P<0.05)。见表2。

表2 两组患者的超声相关指标比较
2.3 心功能减低的AI患者术后LVEF不能恢复的多因素分析 多因素分析结果显示,Et/Et′较高(P>0.001)和/或LVESV较大(P>0.016)是AVR术后LVEF不易恢复的危险因素,即术前出现右室舒张功能明显减低和/或LVESV明显增大是术后LVEF 不易恢复的危险因素。见表3。
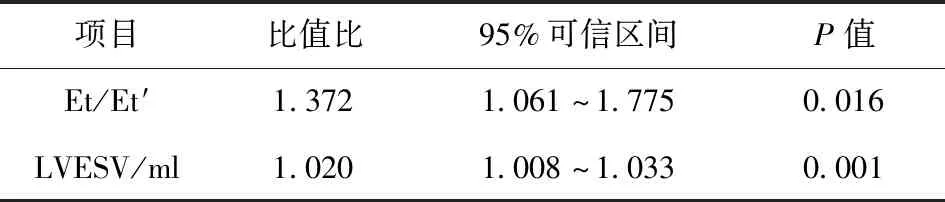
表3 心功能减低的AI患者术后LVEF不能恢复的多因素分析
2.4 右室舒张功能及LVESV的预测作用 术前Et/Et′为2.31~16.00,发现Et/Et′≥7.50与心功能明显减低AI患者术后LVEF不能恢复有显著关系(χ2=5.354,P>0.021,比值比=0.351,95%可信区间为0.142~0.865,敏感度0.40,特异度0.81);术前LVESV为43~407 ml,发现LVESV≥155 ml与心功能明显减低AI患者术后LVEF不能恢复有显著关系(χ2=19.505,P>0.001,比值比=0.095,95%可信区间为0.029~0.035,敏感度0.47,特异度0.92)。
3 讨论
AI病因较多,其中,以主动脉瓣自身的畸形、脱垂或缺如较为多见[8-10],会导致左心系统明显增高的容量负荷,病变后期还会引起二尖瓣的功能性关闭不全[11-12]。AI的发病年龄一般在青壮年居多,由于左室通过代偿性扩大而使患者常常能够耐受很长时间,并未引起足够的注意,只有在左心收缩功能明显减低时才被发现[13-14]。所以,外科医师急需一项特异性较强的指标来指导患者及时手术,以免延误病情。
本研究多因素分析结果显示,术前LVESV明显增大与心功能明显减低的AI患者术后LVEF不能恢复具有相关性(P<0.05),与既往研究报道[14-15]结果相符。这提示,LVESV明显增大的AI患者出现LVEF减低时,说明已经到了疾病的后期,心肌纤维间的排列失去有效连接,导致心肌间质纤维化,心肌相对性缺血等损害,逐渐进入心功能的失代偿阶段,心脏做功功率降低[16-19]。其中,LVESV更能特异性地反映心肌纤维收缩的代偿能力,当LVESV≥155 ml(敏感度0.47,特异度0.92)时,更应该评估心肌的受损状态,必要时需要行心肌核素扫描或心肌MRI检查。此外,本研究还发现,右室舒张功能具有预测AVR术后LVEF能否恢复的价值,即未恢复组患者的术前Et/Et′值明显增高是心功能明显减低的AI患者术后LVEF不能恢复的危险因素(P<0.05)。当病变持续时间较长或病情较重时,左室功能失代偿后,逐渐出现左房和肺静脉压升高,最终导致肺动脉压升高,右室功能也由代偿期走向失代偿期,出现右心衰竭的表现[20]。其中,首当其冲的就是右室舒张功能[21],右室的舒张功能比收缩功能较为更早地出现异常。当心功能减低的AI患者出现Et/Et′≥7.5(敏感度0.40,特异度0.81)时,其术后的LVEF更不易恢复。因此,面对LVEF明显减低的预行AVR患者,更应该关注其右室舒张功能的变化[20-22]。需要结合多种检查手段,以评估患者预后,制定可行的手术方案;对于多项指标均提示心功能明显减低、心肌严重纤维化的患者,可进行心脏移植。
综上所述,术前左室收缩末期内径较大和/或右室舒张功能出现减低是LVEF<0.40的AI患者术后心功能不易恢复的危险因素。当主动脉瓣达到中等或中等以上的反流量,应该缩短复诊间隔,一旦发现AI患者右室舒张功能减低趋势更应该尽早手术,避免病情发展累及右心系统,同时,也有利于患者术后LVEF的恢复[23-24]。心脏超声作为瓣膜评价不可替代的重要检查方式,要求超声科医师不仅要对瓣膜反流量进行定量、半定量的评价,更应该注重对患者左、右心室收缩及舒张功能的评价。
