全外显子组测序检测22q11.2微缺失综合征1例*
2021-08-26朱朝锋时盼来焦智慧孔祥东
朱朝锋,时盼来,焦智慧,孔祥东
郑州大学第一附属医院遗传与产前诊断中心 450052
22q11.2微缺失综合征(22q11.2DS)是人类最常见的染色体微缺失综合征,发病率为1/4 000~1/2 000[1],由于其临床表型多样且部分表型不典型,以及分子诊断技术的滞后,实际发生率可能更高。22q11.2DS大部分是由于非等位基因同源重组导致的新发变异,位于染色体22q11.2区域有0.7~3.0 Mb片段杂合性缺失,累及多系统异常表现,是引起先天性心脏病、发育迟缓和腭裂综合征的常见遗传性疾病[1]。22q11.2DS在胎儿中的患病率约为1/1 000,如有心脏检测结果异常,则发病率可高达1/100[2-3]。因此,对于22q11.2DS的早期诊断和预防具有多种优势,能够极大地减少医疗、情感和社会成本。目前,针对22q11.2DS进行产前诊断的方法主要包括染色体微阵列分析(CMA)/全基因组拷贝数变异检测(CNV-seq)、荧光原位杂交(FISH)和多重连接探针扩增技术(MLPA)等。但由于国内外关于22q11.2DS的研究主要着眼于出生后人群,在产前诊断方面的报道较少,22q11.2DS表型多种多样,仍然缺乏统一的筛查标准,而且90%以上为新发突变,临床上难以针对性地进行产前诊断。近年来,全外显子组测序(trio-WES)技术应用于超声结构异常胎儿的产前诊断的报道越来越多[4-8]。trio-WES检测作为一种有效、全面的临床检测手段,不受表型的影响,可一次性检测与大多数疾病相关的基因变异,阳性检出率提高至30%~60%。本研究通过trio-WES技术诊断出1例22q11.2DS,并通过CNV-seq方法进行验证,现报道如下。
1 资料与方法
1.1一般资料 孕妇,25岁,孕2产0,因2次胎儿超声异常妊娠史来本科室进行遗传咨询。第1次,孕24周超声提示胎儿心内膜垫缺失而终止妊娠;第2次,孕20+6周胎儿肺动脉闭锁伴室间隔缺损经遗传咨询后决定终止妊娠。夫妻2人非近亲结婚,身体健康,染色体核型检测均正常(图1)。本研究经本院医学伦理委员会批准(批准号Ks-2018-KY-36),家系成员均知情同意并签署知情同意书。
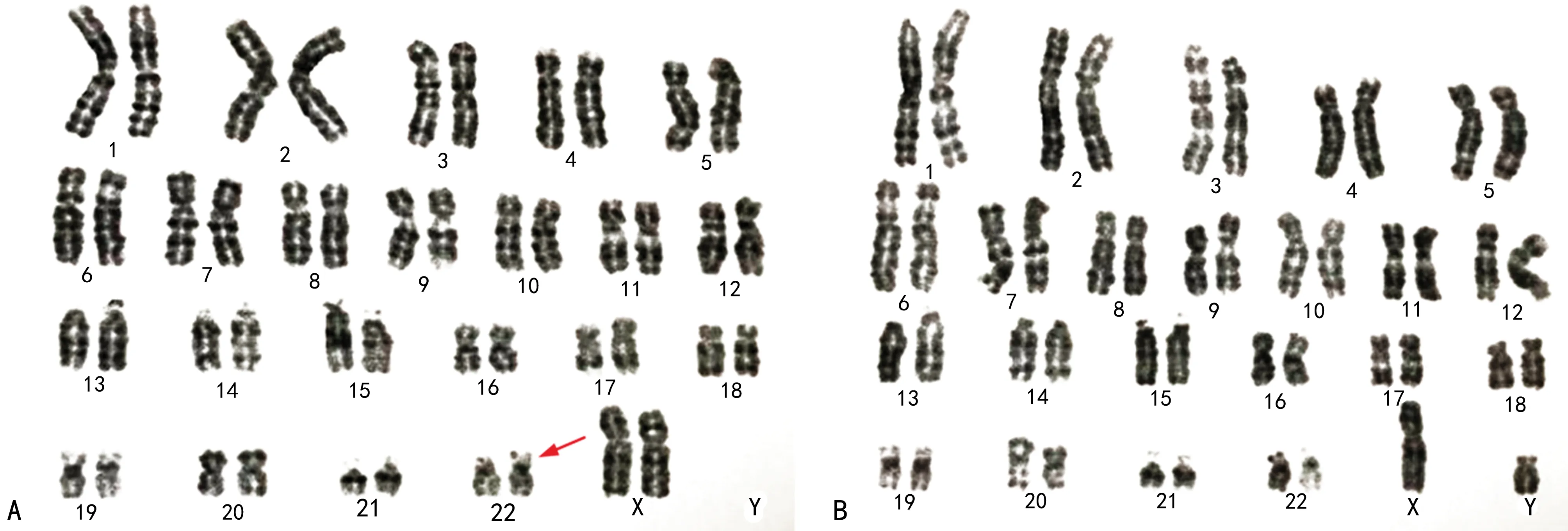
注:A为孕妇染色体结果46,XX,22ps+,箭头所示22号染色体随体增加;B为配偶染色体检查结果46,XY。
1.2基因组DNA的提取 采集孕妇及其配偶的外周血2 mL,乙二胺四乙酸二钾抗凝,同时采集引产胎儿皮肤组织,按照QIAamp DNA提取试剂盒操作说明提取全基因组DNA,TE溶液洗脱DNA,并利用NanoDrop紫外分光光度仪测定DNA在260 nm和280 nm处的吸光度(A)值,得出其浓度及纯度,保持A260/A280在1.7~2.0。
1.3trio-WES检测 trio-WES检测由北京贝瑞和康生物技术有限公司完成。简要过程如下:将提取的基因组DNA打断成250 bp左右片段,经末端修复、接头连接、纯化后利用IDT xGen®Exome Research Panel试剂盒进行全外显子片段捕获,构建测序文库。使用Illumina NovaSeq测序仪(美国Illumina公司)进行读长为150 bp的双端高通量测序,测序数据通过质控后进行生物信息学分析。测序数据通过Cruxome全外数据分析系统(北京贝瑞基因公司)进行分析。查阅OMIM、ClinVar、HGMD数据库进行已知或疑似致病突变筛选,依据美国医学遗传学与基因组学学会发布的序列变异解读标准和指南[9]对变异进行分级,综合判断变异的致病性。同时对测序数据进行外显子捕获区域基因拷贝数变异(CNV)分析。同批次样本的全外测序数据经质控后均一化计算,分析外显子水平的拷贝数变化。最后根据ACMG指南对CNV进行评估和致病性分类。
本研究对孕妇本人、配偶及胎儿全外显子组测序数据进行分析未检测到相关致病性单碱基转换/颠换(SNV)、缺失突变(InDel)变异,但是通过对捕获区域CNV进行分析,发现胎儿22q11.2区域有约1.41 Mb的杂合性缺失片段(chr22:18893882-20307516)和0.86 Mb的杂合性缺失片段(chr22:20706067-21563420),变异均来自父亲。
1.4CNV-seq 提取并纯化后的基因组DNA通过北京贝瑞和康公司科诺安试剂盒进行建库。构建好的文库通过Nextseq CN500测序平台进行单端测序产生8M 36 bp reads,约为0.1X全基因组测序深度。测序数据提交至科诺安分析平台进行CNV-seq分析。通过CNV-seq方法对胎儿及配偶的全外显子组测序结果进行验证,结果发现,胎儿22q11.2区域有约2.58 Mb的杂合性缺失片段(chr22:18900000-21480000),与配偶的检测结果相同。
2 讨 论
22q11.2DS的临床表型复杂多样,给临床诊断带来巨大挑战,22q11.2DS的发生机制目前尚不清楚。22q11.2区域复杂的基因组结构导致生殖细胞在减数分裂时易发生非同源基因同源重组(NAHR),NAHR可引起22q11.2再发性缺失[1,10]。大约90%的患者有3 Mb大小的典型缺失区域,8%存在1.5 Mb的微小缺失,另外还有一些不典型的小片段缺失和远端缺失。本研究检测的胎儿22q11.2DS缺失区域大小约为2.58 Mb(chr22:18900000-21480000),属于典型缺失区域。胎儿存在先天性心脏结构畸形,且该家系存在2次胎儿心脏畸形不良孕产史,疾病与22q11.2DS表型相符。本研究中胎儿22q11.2缺失区域遗传来自父亲,但父亲表型正常。1例22q11.2DS(chr22:21060359-21461607,hg19)缺失患者主要的临床表征为重度运动和认知障碍、脊柱裂、脊柱侧弯、巨头畸形、脑积水、小脑发育不全、特殊面容等,其母亲携带此缺失片段,无明显临床表征[11]。1例22q11.2DS(chr22:21046144-21460009,hg19)缺失患者主要的临床表征为运动延迟、智力障碍、新生儿肌张力减退、脑瘫等,其母亲携带此缺失片段,无明显临床表征[12]。因此,22q11.2DS表型的多样性被认为是遗传和环境因素共同作用的结果。
22q11.2DS尚无有效的治疗手段,目前主要是针对其表型(如低钙血症、T细胞功能缺陷、心脏发育异常、学习和语言能力低下等)进行对症治疗。因此,对22q11.2DS进行早期诊断和干预及遗传咨询是预防该病发生的关键。22q11.2DS发病率高,仅次于唐氏综合征,但由于其临床表型复杂,国内对该病的认识不足,未能建立完善的筛查体系,临床上很多病例仍不能得到确诊。目前,FISH技术是22q11.2DS经典的检测方法,但是其操作相对烦琐且分辨率十分有限。微阵列芯片(包括微阵列比较基因组杂交或单核苷酸多态性微阵列等)能够更精确地了解缺失片段的长度,多重连接探针扩增检测相对更加简单快速且经济实用,更适合于对先证者确诊后的家系验证。微阵列芯片及近年来发展的CNV-seq虽能对全基因组范围内微缺失微重复进行检测,但其分辨率为100 kb,对于点突变、小片段缺失/重复所致的单基因疾病无法检测。
trio-WES技术已广泛应用于临床遗传病的检测,但其主要针对相关基因编码区序列的SNV和50 bp以内插入InDel,对于染色体拷贝数变异水平的检测效能还缺乏明确结论。本研究显示,利用trio-WES技术检测22q11.2DS被认为是可行的,并且与当前其他现存检测技术相比具有明显优势。trio-WES可一次性检测人类基因组中约20 000个目标基因,分析相关的致病性SNV、InDel变异,同时还能对捕获区域进行CNV分析,缩短诊疗时间,将阳性检出率提升至30%~60%。22q11.2DS胎儿期临床表现不明确,目前报道的主要是超声检查可见先天性心脏缺陷,其中圆锥动脉干缺陷最常见,其他还有血管异常和左心发育不良。胸腺异常、泌尿系统缺陷及神经系统发育异常也有报道[11]。大多数结构异常要在18~24周通过超声才能检测到,因此要求能够尽快明确诊断。胎儿表型通常不明确,所以trio-WES检测可能是目前实现快速诊断的最有效的检测方案[12]。目前,关于trio-WES检测拷贝数变异的报道还较少,张彦[13]报道了2例遗传病家系通过trio-WES发现染色体拷贝数变异,片段大小从11.4 kb至13.03 Mb不等,结果得到了CMA等技术的验证。
总之,本研究通过trio-WES技术对2次孕中期超声心脏发育异常的家系进行测序,对检测发现的22q11.2DS缺失区域进行了遗传学分析和CNV-seq验证,明确了22q11.2DS约2.58 Mb杂合性缺失是其致病性变异,为该夫妇进行再次生育给予指导并提供了有效的遗传咨询。trio-WES技术应用于22q11.2DS的基因诊断是可行的。trio-WES技术应用于其他微缺失微重复综合征还需要更多的数据评估和验证。
