基于质谱技术的外泌体蛋白质组学在肿瘤诊断中的研究进展*
2021-08-26童学东综述审校
杨 柳,张 勇,童学东 综述,邓 昆△ 审校
重庆医科大学附属第三医院检验科,重庆 401120
早在1983年,在绵羊网织红细胞中发现了外泌体,其被认为是“细胞碎片”或细胞排出代谢废物的一种形式。有研究发现,血液中外泌体的浓度较高(>109particles/mL),肿瘤患者血液中的外泌体浓度普遍高于健康人,与肿瘤的大小、淋巴结转移数量及肿瘤细胞类型密切相关[1],进一步研究发现,由于囊泡内携带的生物信息分子(脂质、蛋白质、RNA等)存在差异,不同细胞来源的外泌体在人体内发挥不同的功能。如间充质干细胞来源的外泌体可修复组织损伤、抑制肿瘤细胞的增殖;而肿瘤细胞来源的外泌体可进入微环境,随体液循环在局部或远处操控肿瘤微环境,促进血管生成、肿瘤侵袭和转移[2]。在体液循环中,外泌体的尺寸和数量因受细胞间质压力、氧化应激、营养剥夺及pH值等的影响存在较大差异。由此可见,外泌体与肿瘤的发生和发展具有高度的相关性。以往的研究主要通过检测体液(如血液、尿液、唾液等)中蛋白质组成实现肿瘤标志物的筛选,然而这些复杂样本中的蛋白质浓度跨度达10~12个量级。现存的质谱技术鉴定蛋白浓度差仅为6~7个量级,所以这些样本中某些低丰度蛋白容易被技术忽略。相对于复杂的体液,外泌体内蛋白质浓度跨度较小,因此,应用液相色谱串联质谱技术(LC-MS/MS)研究外泌体蛋白质组学有望成为筛选肿瘤特异性生物标志物的有效方法。
1 外泌体蛋白质的组成及分类
外泌体是一种直径为30~150 nm的细胞外囊泡,由各种类型的细胞(免疫细胞、组织细胞、肿瘤细胞等)通过内溶酶体途径释放至细胞外。首先,细胞质膜向内凹陷形成内体,内体膜进一步向内凹陷,将细胞质内含物、跨膜蛋白和外周蛋白整合至囊泡内,形成多囊泡体(MVB)。然后,MVB通过与细胞质膜融合,以胞吐的方式释放到细胞外环境,成为脂质双分子膜包裹的纳米颗粒,也就是外泌体。内体分类复合物参与调节和引导特定分子进入MVB,主要的4个内体分类复合物(ESCRT 0、Ⅰ、Ⅱ和Ⅲ)负责将泛素化蛋白传递至溶酶体内降解或参与蛋白回收,因此,ESCRT系统的组件(TSG101和Alix等蛋白)在外泌体中表达丰富。但ESCRT并不是介导外泌体形成的唯一机制,其他独立于ESCRT的过程也可能参与外泌体生物的发生和释放。例如,四次跨膜蛋白家族中的CD9、CD63和CD81已被证明参与内体小泡的运输,这一类参与外泌体形成并在不同细胞来源的外泌体中稳定表达的蛋白被称为外泌体非特异性来源蛋白,主要包括四次跨膜蛋白家族成员(CD9、CD63、CD81、CD82)、膜融合和转运相关的蛋白(Annexins、Alix、TSG101)及细胞骨架蛋白(微管蛋白、肌丝蛋白、微丝结合蛋白),它们广泛应用于外泌体的表征(如蛋白质免疫印迹法和胶体金电镜)或作为蛋白标志物参与外泌体的分离纯化(如免疫亲和法),见图1。进一步深入研究发现,外泌体作为一种新型的信息交流载体,参与了人体内一系列的生理病理过程。介导外泌体与目的细胞相互作用的机制包括以下3种:(1)外泌体与细胞膜融合,释放外泌体内的生物信息分子;(2)外泌体通过胞吞作用进入受体细胞;(3)外泌体膜蛋白与目的细胞受体相互识别,激活目的细胞内信号通路。见图2。KALRA 等[3]研究发现,外泌体携带的β-catenin可与细胞上特异性受体识别,激活肿瘤细胞中的Wnt通路,这一类能够反映细胞来源和/或介导某一特定生理病理过程的蛋白质被称为外泌体来源特异性蛋白,它们与肿瘤的发生和发展密切相关,具有早期筛查或诊断肿瘤的潜力[4]。无论来源特异性蛋白或来源非特异性蛋白均可通过基于质谱技术的外泌体蛋白质组学进行鉴别,其中分离纯化外泌体是外泌体蛋白质组学分析的基础,为后续外泌体的功能研究或肿瘤标志物筛选提供了保障。
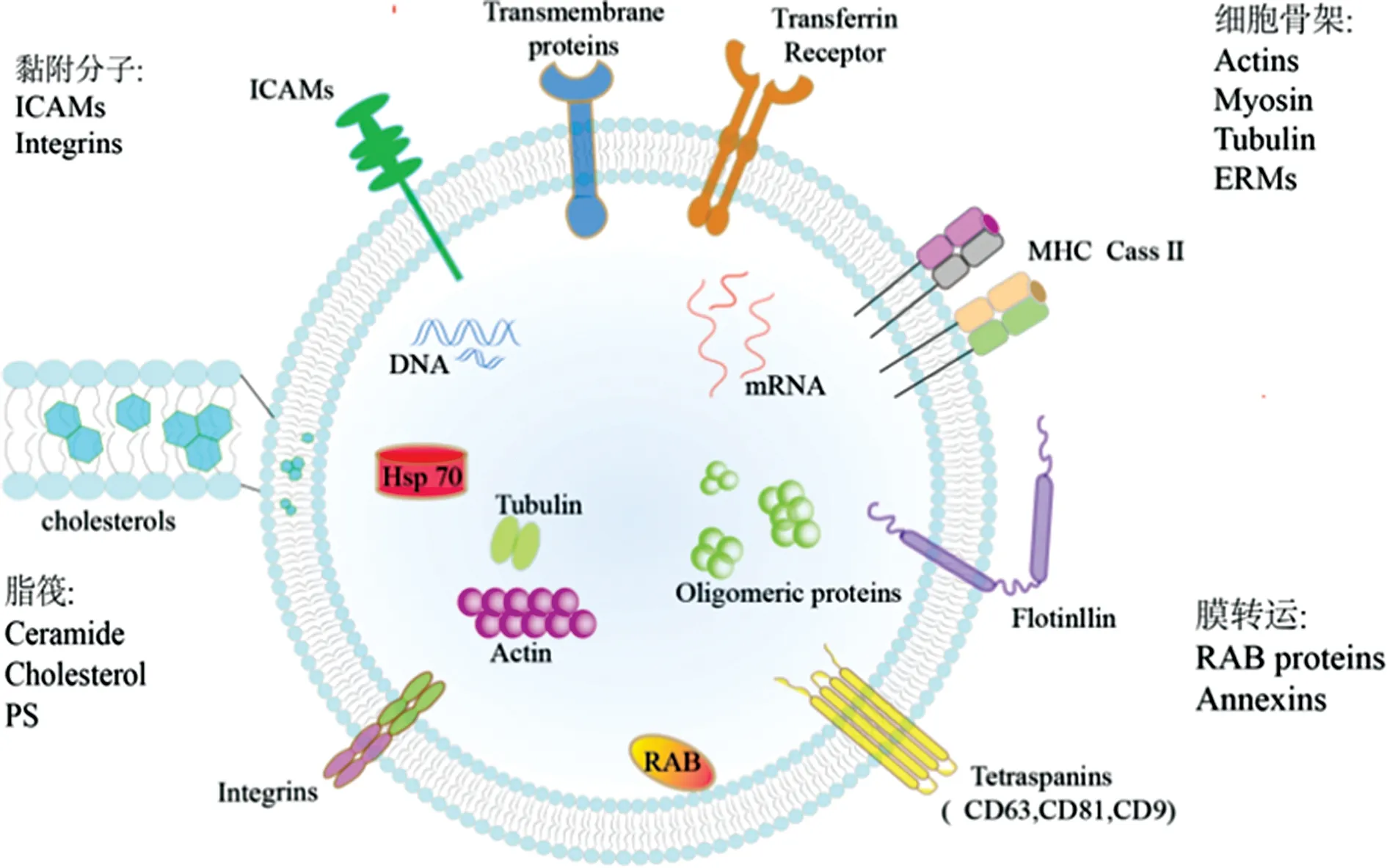
图1 外泌体组成和结构图

注:(1)为外泌体与细胞膜融合,释放外泌体内的生物信息分子;(2)外泌体通过胞吞作用进入受体细胞;(3)为外泌体膜蛋白与目的细胞受体相互识别,激活目的细胞内信号通路。
2 外泌体的分离方法
外泌体来源于细胞上清液、组织及不同类型的体液(如血液、脑脊液、胸腔积液等),各种分离方法不同程度地受免疫复合物、高密度脂蛋白的影响。因此,有效分离富集高纯度的外泌体是外泌体蛋白质组学研究至关重要的一部分。现阶段分离纯化外泌体主要从尺寸、密度、免疫表型等进行。基于尺寸的分离方法主要有体积排阻色谱法和超滤法[5],其共同点是分离获取的外泌体生物活性不受影响,无需昂贵的超速离心设备,但是体积排阻色谱法提取出的外泌体浓度较低,超滤法也存在滤膜堵塞和使用寿命较短的问题;基于密度的分离方法主要有超速离心法和蔗糖密度梯度离心法[6],其优点是分离出的外泌体纯度较高,方法学构建成熟,适合于不同的样本体积(1~480 mL),但是所需的仪器设备昂贵,耗时较长;基于免疫亲和的分离方法主要有磁珠法[7],其优点是可分离出特定细胞来源的外泌体,但是洗脱液容易影响分离纯化的外泌体的生物活性,不利于后续的功能验证及质谱检测。随着新型纳米分离技术的发展,研究者逐渐发展出多种新型的外泌体分离方法,以微流控技术为基础实现外泌体分离的方法受到广泛关注,主要包括微流体过滤[8]、声波分离[9]及免疫亲和捕获[10],其共同特点是所需样本量较少、分离速度快、纯度高等。其中基于免疫亲和捕获的微流控芯片具有实现诊断分离一体化的潜能,有利于诊断方法学的建立。
目前,超速离心法分离获取外泌体在基于质谱技术的外泌体蛋白质组学研究中最为常见。2015年,DUTTA等[11]利用超速离心法分离出胆管癌细胞株来源的外泌体,利用质谱技术对其进行了功能分析。随着外泌体的深入研究,发现通过密度梯度离心法和超速离心法联合使用可进一步提高外泌体的纯度。2016年,CLARK 等[12]采用蔗糖密度梯度离心法联合超速离心法成功分离出肺癌细胞株来源的外泌体,用于后续氨基酸同位素胞内培养(SILAC)质谱技术分析非小细胞肺癌生物标志物。有研究发现,密度梯度离心法联合超速离心法获取的外泌体已经失去了生物活性[13]。由此可见,超速离心法更适合于以功能分析为目的的外泌体蛋白质组学,而密度梯度离心法联合超速离心法更适合于以筛选生物标志物为目的的蛋白质组学。因此,外泌体分离纯化方法的选择主要取决于研究目的。2018年国际细胞外囊泡协会提出外泌体分离纯化可通过两种方法联合使用提高特异性和外泌体亚型的分离[13]。相信不久的将来会出现关于如何根据不同研究目的选择相应的外泌体分离方法的研究指南和统一标准。
3 常用于外泌体蛋白质组学研究的质谱技术
相对于蛋白芯片而言,质谱技术对蛋白质的鉴定不受抗体限制,可鉴定未知种类的蛋白质。质谱技术由于灵敏度高、特异性强、分析范围宽等特点已逐渐成为蛋白质组学的主要研究手段。随着外泌体相关研究数量日益增加,基于质谱技术的外泌体蛋白质组学研究策略也逐渐完善。目前,用于蛋白质组学研究的质谱技术分为非靶向蛋白质组学质谱技术和靶向蛋白质组学质谱技术,其中非靶向蛋白质组学质谱技术是检测样本中所有在检测限范围内的蛋白质,多用于外泌体内差异蛋白质的筛选或信号通路分析,根据用于蛋白质定量的方法,它可分为标记定量技术(包括化学标记定量技术和代谢标记定量技术)和非标记定量技术。而靶向蛋白质组学质谱技术是对数十个目标蛋白质进行检测,多用于已知蛋白质的验证,主要包括多反应监测质谱技术和平行反应监测质谱技术。不同质谱技术的优点和局限性不同,见表1,可根据样本数量、样本类型或后续研究目的进行选择。

表1 常用于蛋白质组学研究的质谱技术的优点和局限性
3.1非靶向蛋白质组学质谱技术
3.1.1标记定量技术
3.1.1.1化学标记定量技术 ROSS等[14]研究发现,通过引入不同种类的同位素对不同的样本标记后,可将待测样本混合同时上样进行质谱检测,减少样本的批间误差,进而提高数据的准确性。目前,常用于外泌体蛋白质组学研究的化学标记定量技术主要包括TMT和iTRAQ两种,均采用同位素与肽段的氨基反应,通过等重标记原理对不同样本进行标记,同时上机检测不同样本的同一肽段在质谱仪中的离子信号响应强度,实现所有蛋白质的相对定量。TMT和iTRAQ的主要差别在于标记样本的数量不同。TMT是由AB Sciex公司研发,适合于2标、6标、10标或16标;而iTRAQ是由Thermo Fisher Scientific公司研发,适合于4标或8标。2012年,DE JONG等[15]利用iTRAQ LC-MS/MS对应激状态下内皮细胞来源的外泌体进行蛋白质组学分析,发现其内蛋白质浓度发生了明显改变。
3.1.1.2代谢标记定量技术 SILAC是一种体内标记技术,首先它将轻、中、重型C/N同位素标记在L-赖氨酸和L-精氨酸两种必需氨基酸上,然后将标记了同位素的氨基酸与细胞共培养(>5代)或饲养正常的动物,通过正常细胞代谢,实现95%及以上的蛋白质标记,适合于2标或3标。在外泌体蛋白质组学的研究中,SILAC主要用于细胞株来源的外泌体。由于无需体外人工标记处理,对蛋白质标记的保真性较高。2012年,LI等[16]通过SILAC对淋巴细胞进行培养,成功分离出同位素标记的外泌体。
3.1.2非标记定量技术 非标记定量技术是通过比较不同样本中同一肽段对应的质谱峰面积或质谱峰数,直接获取该肽段所代表的蛋白的相对定量信息。有学者通过检测酶解后的肽段对应的质谱峰面积来预估蛋白质浓度,应用此方法预估的蛋白质浓度和实际蛋白质浓度相差不超过16%[16]。RAPPSILBER等[17]将质谱峰数直接转换为肽段数,通过比较某一蛋白质对应的肽段数和胰蛋白对应的肽段数(也就是蛋白丰度指数)进行相对定量。ISHIHAMA等[18]进一步研究发现,蛋白丰度指数和蛋白浓度呈线性相关(r=0.89)。上述非标记定量的质谱采集模式均为数据依赖性采集(DDA),即一级质谱仅采集每个扫描周期信号强度为前10~20的母离子进行碎裂和二级质谱分析。2012年,GILLET等[19]在一级质谱的采集方式上进行优化,即采集全部的母离子信息,提出了数据采集模式称为数据非依赖性采集(DIA),它是通过采集每个扫描周期内所有的母离子进行碎裂和二级质谱分析,实现蛋白质的鉴定和相对定量,其特点是获取蛋白质的信息更全面,但对数据处理的要求更高。相对于标记定量而言,非标记定量可用于任何类型的样本,并且无需前期复杂的标记技术,在减低蛋白质浓度损失的同时降低了实验成本。2012年,CHOI等[20]利用基于DDA模式的非标记定量技术在结直肠癌细胞株来源的外泌体中筛选出可用于辅助判断肿瘤转移的标志物。
3.2靶向蛋白质组学质谱技术
3.2.1多反应监测质谱技术(MRM) MRM的原理是在一级质谱中设定目标蛋白相应的母离子信息,在二级质谱中设定相应子离子信息,通过选择性地采集母离子-子离子对信号,从而实现目标蛋白的相对定量。2003年,GERBER等[21]研究发现,通过加入不同浓度的内参可实现目标蛋白质的绝对定量,其优点是能够有效地避免杂质信号的干扰,适合于基质背景较高的样本。2017年,MEHAFFY等[22]利用MRM成功在血液来源的外泌体中检测出低丰度蛋白(如Mtb)。MRM是通过测定肽段的数量,从而推断出蛋白质的数量,在子离子对的采集上存在一定程度的假阳性。因此,目标蛋白的高还原性和保真性有待提升。
3.2.2平行反应监测质谱技术(PRM) 2012年,PETERSON提出了利用高分辨率的质谱仪(orbitrap/TOF)取代三重四极杆中第三级的四极杆质量器采集所有子离子信息,进而对目标蛋白定量,即PRM。2015年,SCHILLING等[23]利用标准肽对PRM进行验证,发现PRM具有高重现性和选择性,并且进一步完善了PRM的工作流程。随着技术的成熟和方法学的完善,PRM用于外泌体蛋白质组学的研究逐渐增多。2017年,DOZIO等[24]利用PRM表征大脑内皮细胞来源的外泌体蛋白,进一步研究了肿瘤坏死因子对外泌体蛋白的影响。相对于MRM而言,PRM主要体现在质谱仪器的升级,无需选择离子对和优化碎裂能量,耗时短,准确性高,更有利于方法学的建立。
4 外泌体蛋白质组学在肿瘤诊断中的应用
4.1外泌体比较蛋白质组学与肿瘤诊断 肿瘤患者和非肿瘤患者来源的外泌体内携带的蛋白质存在明显差异。有研究表明,外泌体上的整合素(ITG)区域可与转移的器官选择性黏附,例如,ITGβ4促进了肿瘤细胞靶向肺转,而ITGβ5能够促进肿瘤细胞转移至肝脏[25]。由此可见,外泌体蛋白质可用于判断肿瘤转移的器官。因此,外泌体内携带的蛋白质有望成为肿瘤诊断的生物标志物。在肿瘤标志物研究中,比较蛋白质组学主要是通过比较非肿瘤生物样本和肿瘤生物样本所有蛋白质的种类与浓度,筛选出潜在肿瘤特异性生物标志物用于诊断肿瘤类型、判断转移与否及鉴别转移来源的器官。CHEN等[26]通过TMT标记的LC-MS/MS对结直肠癌患者和健康人血浆来源的外泌体进行分析,发现了58种差异表达的蛋白质,其中36种上调,22种下调,验证发现纤维粘连蛋白1(FN1)、胎球蛋白A、热休克蛋白90(HSP90AA1)是结直肠癌的潜在肿瘤标志物。ZHENG等[27]在前者采用的质谱技术的基础上进行优化,利用DIA数据采集模式分析发现了20种结直肠癌上调蛋白,并且在健康人(13例)和结直肠癌患者(12例)样本中,采用PRM验证了FN1的诊断效能,其受试者工作特征曲线下面积为1.0,明显高于血清癌胚抗原和血清糖类抗原19-9,有望成为结直肠癌的诊断标志物。WANG等[28]通过TMT LC-MS/MS研究发现,外泌体内的脂多糖结合蛋白可用于判断非小细胞肺癌是否转移。而KUANG等[29]应用Label free技术对非小细胞肺癌患者来源的外泌体进行研究发现,β纤维蛋白原和γ纤维蛋白原能够用于鉴别良性肺结节和恶性肺结节。尽管质谱技术的发展有助于在外泌体蛋白质组学的基础上发现更多的潜在肿瘤标志物,但是对潜在肿瘤标志物的验证阻碍了肿瘤标志物临床转化的进程。一些外泌体蛋白的诊断效能仍存在一些争议,一方面是由于缺少验证方法学之间的比较;另一方面是肿瘤异质性导致临床样本之间存在较大差异。MELO等[30]利用酶联免疫吸附试验研究发现,外泌体中磷脂酰肌醇聚糖-1(GPC-1)蛋白浓度在胰腺癌患者血液中明显增加,能够高特异度(100%)、高灵敏度(100%)地区分胰腺癌患者(246例)、胰腺炎患者(20例)及健康人(37例)。然而,LAI等[31]利用LC-MS/MS检测发现,外泌体中GPC-1蛋白的浓度在胰腺癌患者(3例)、胰腺炎患者(3例)和健康人(6例)中无明显差异,并且在术后患者的血液中外泌体的GPC-1蛋白略微降低,无法确认研究之间的差异是来源于不同的方法学还是肿瘤临床样本的异质性。因此,外泌体肿瘤标志物在实现临床普及之前,仍需加大样本量对其诊断效能进行验证或通过对验证方法标准化进而加强不同实验室数据之间的整合来确认差异来源。HOSHINO等[32]通过加大临床样本量(311例)并联合细胞株样本(115例)开展了基于TMT LC-MS/MS的外泌体蛋白质组学研究,鉴别了肿瘤组织来源(85例)和癌症患者血液(127例)、淋巴引流液(13例)、胆管液(20例)来源的外泌体特异性表达的蛋白,发现多功能蛋白聚糖、肌腱蛋白C、血小板凝血敏感酶蛋白2可以用于癌症(如肺癌、胰腺癌、结直肠癌、乳腺癌、肝癌、淋巴瘤等)的筛查,并且可对未知的原发肿瘤进行分类。除此之外,在其他不同类型的肿瘤中,也有应用质谱技术筛选外泌体肿瘤标志物的研究。
4.2外泌体修饰蛋白质组学与肿瘤诊断 经翻译后修饰的蛋白(如磷酸化蛋白、糖基化蛋白、甲基化蛋白等)在肿瘤细胞内异常表达,与细胞的功能状态密切相关。如游离的磷酸蛋白具有高度的特异性,但是血液中存在磷酸活性酶可将其降解,因此,血液中游离的磷酸化蛋白不适合作为肿瘤标志物。外泌体的脂质双分子层能够阻止血液中蛋白酶对其内容物的降解。因此,经翻译后修饰的蛋白质在外泌体中稳定存在,是区分肿瘤状态和健康状态的潜在标志物。外泌体中的糖基化蛋白和磷酸化蛋白浓度明显高于血液,PAN等[33]利用DIA LC-MS/MS研究发现,非小细胞肺癌患者与健康人血浆中的黏蛋白1(MUC-1)水平无明显差异,而MUC-1由于糖基化在外泌体中选择性富集,因此,非小细胞肺癌患者来源的外泌体中的糖基化MUC-1浓度较健康人约上升1.5倍。WEERAPHAN等[34]在胆管癌细胞的体外转移模型中利用Label-free LC-MS/MS发现,源自高侵袭性细胞株中43个外泌体蛋白磷酸化浓度发生明显变化,其中值得注意的是磷酸化HSP90与胆管癌细胞的恶性程度呈正相关,可成为胆管癌转移与否的潜在标志物。而CHEN等[26]采用label-free质谱技术,在乳腺癌患者血浆外泌体中检测出100多种磷酸化蛋白,这些蛋白质的浓度明显高于健康对照组。在13例乳腺癌患者和7例健康人血液来源的外泌体中,采用PRM质谱对4种[环磷酸鸟苷依耐性蛋白激酶1(PKG1)、鸟苷三磷酸酶激活蛋白亚基2(RALGAPA2)、盒结合蛋白1(NFX1)、紧密连接蛋白2]明显上调的磷酸化蛋白进行验证,其中PKG1、RALGAPA2、NFX1P的浓度均存在明显差异,有望成为乳腺癌早期诊断的标志物。
5 总结及展望
肿瘤细胞来源的外泌体通过特殊的分选机制富集生物信息分子,被大量分泌进入肿瘤外环境,通过旁分泌和内分泌方式作用于靶细胞,参与肿瘤的发生、发展及转移过程。由于质谱检测技术的更新和数据采集分析方式的不断优化,比较蛋白质组学的蛋白覆盖率和灵敏度均有所提高,可检测出更多肿瘤来源的特异性外泌体蛋白。翻译后修饰的蛋白质组学在外泌体研究中的应用,也增加了外泌体蛋白质组学在肿瘤致病机制、功能及疾病关联等方面的研究深度。尽管基于质谱技术的外泌体蛋白质组学在肿瘤诊断标志物的研究中得到广泛应用,但是验证和发展可用于临床诊断的肿瘤标志物目前仍存在许多挑战,主要包括以下3个方面:(1)多种技术和仪器带来了多种研究策略,难以保证不同研究策略结果之间的可重复性,阻碍了不同实验室数据间的比对与整合;(2)样本制备、数据采集和数据分析自动化程度较低,增加了研究成本;(3)现阶段研究临床样本数量偏少,对于肿瘤标志物的诊断效能验证不足,尚不能实现临床转化。因此,一方面可以通过加强对不同技术和仪器之间的方法学研究,寻找出不同方法学之间的差异,旨在完善外泌体蛋白质组学方法的研究指南和针对不同研究策略的选择标准,通过对研究策略的标准化,从而实现不同实验室之间数据的整合;另一方面,可以采用多中心联合的模式在增加临床研究样本数量的同时消除地域因素影响,建立具有中国特色的外泌体蛋白质表达图谱。
