山药多酚对结肠炎小鼠肠黏膜损伤预防作用研究
2021-08-26李孔会廖森泰邹宇晓穆丽霞龙晓珊
李孔会,廖森泰,李 倩,邹宇晓,穆丽霞,龙晓珊
(1.华南农业大学 食品学院,广东 广州 510642;2.广东省农业科学院 蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室,广东 广州 510610)
溃疡性结肠炎(ulcerative colitis,UC)是一种反复发作的慢性肠病,其发病机制尚未完全阐明,目前广泛认为肠黏膜损伤是引发UC的主要原因之一[1]。近年来,我国UC发病率逐年攀升,UC的治疗药物主要有盐酸小檗碱 (berberine,BER)、柳氮磺胺吡啶、5-氨基水杨酸等,但此类药物的服用常会伴随着断药复发和并发症[2-5];因此开发新型、无毒副作用、功能性显著的用于治疗UC的天然活性物质具有重要意义。山药属薯蓣科(Dioscoreaceae),为薯蓣的地下块茎,以古怀庆府(现河南焦作)出产的怀山药品质最佳,也被称为“铁棍山药”。怀山药性甘、平,《中国药典》记载其具有显著的“健肠胃”,改善“久泻不止、泄泻便溏”的功效,已被国家卫生健康委员会列入“既是食品又是药品”名录[6-8]。目前,已有山药多酚清除亚硝酸盐、抗氧化、抗神经炎症等功效方面的研究[9-11],但关于山药“健肠胃”的相关物质基础和作用机制尚缺乏科学阐释。
本课题组前期对山药皮和肉中的活性成分进行结构解析[12],采用活性追踪法,发现山药皮中的多酚菲类化合物对COX-2酶具有抑制活性,因此,推测山药多酚(Chinese yam peel polyphenol,CYPP)极有可能在改善结肠炎症程度,预防肠黏膜损伤,“健肠胃”功效中扮演着重要角色。本研究在此基础上,拟通过建立溃疡性结肠炎小鼠模型,研究CYPP对肠黏膜的保护作用,并探讨其作用机制,希望为开发山药的功能性食品提供理论基础,也为山药具有“健肠胃”的民间说法提供科学依据。
1 材料与方法
1.1 材料与试剂
怀山药来源于河南省焦作市温县,山药多酚由怀山药皮经乙酸乙酯提取获得。SPF级,BALB/c小鼠,雄性,鼠龄8周,18~22 g,编号为SCXK〈粤〉2015-0149,购于广州中医药大学实验动物中心,经过广东省农业科学院伦理委员会批准使用。
葡聚糖硫酸钠盐(dextran sulfate solium,DSS),美国MP Biomedicals公司;戊巴比妥钠,广州市齐云生物技术有限公司;BER,上海瑞永生物科技有限公司;体积分数10%的甲醛固定液,北京雷根生物科技有限公司;髓过氧化物酶(MPO)试剂盒,南京建成生物工程研究所;HE染液套装、蛋白酶K、破膜液、抗荧光淬灭封片剂、RIPA裂解液、磷酸化蛋白酶抑制剂、BCA蛋白定量检测试剂盒,ACTIN鼠抗(GB12001)、Caspase-8兔抗(GB11594),武汉赛维尔生物科技有限公司;Occludin兔抗(ab167161),艾博抗有限公司;COX-2兔抗(12282),美国Cell Signaling Technology公司;Tunel试剂盒(11684817910),罗氏有限公司。
1.2 仪器与设备
ST858B31型冷冻真空干燥机,美国Milirock公司;N-100型旋转蒸发仪,上海爱郎仪器有限公司;Rt2100c型酶标检测仪,雷杜生命科技股份有限公司;JJ-12J型脱水机、JB-P5型包埋机、JB-L5型冻台,武汉俊杰电子有限公司;RM2016型病理切片机,上海徕卡仪器有限公司;KZ-Ⅱ型匀浆仪,武汉赛维尔生物科技有限公司;Eclipse E100型正置光学显微镜、Eclipse C1型正置荧光显微镜,日本尼康株式会社;DYY-6C型电泳仪,北京六一仪器厂;EaseFC型灰度分析软件,美国Alpha Innotech公司。
1.3 实验方法
1.3.1CYPP的制备
收集新鲜山药皮,冻干、粉碎,采用乙酸乙酯溶液常温振荡提取3次,料液比为1∶5(g∶mL),每次振荡2 h,过滤,收集所有滤液,旋蒸浓缩。去离子水配制成质量浓度为36 mg/mL的母液,备用。
1.3.2小鼠饲养及结肠炎模型的构建
实验用小鼠饲养条件:温度22~25 ℃,相对湿度60%~70%,标准饲料饲养,开灯关灯12 h循环,小鼠自由摄食饮水。小鼠适应饲养环境并观察一周后,将60只小鼠随机分为6组(NC、MC、PC、L、M、H组),每组10只。除NC组,其余组以DSS诱导小鼠结肠炎,PC组以BER为阳性对照进行实验,小鼠分组及构建的模型如表1。

表1 结肠炎小鼠模型的构建Tab.1 Construction of colitis mice model
第15天,用质量分数2%的戊巴比妥钠溶液(现配现用)麻醉小鼠,解剖,取出盲肠和结肠。从盲囊后1 cm处剪下结肠,平均分成4份,在体积分数10%的甲醛固定液中常温保存一份,其他3份放入液氮中保存,后转移至-80 ℃冰箱中,用于后续测定研究。
1.3.3各组小鼠疾病活动指数评分方法
实验过程中,每天称体重,观察并记录小鼠粪便的形状变化、粪便便血的情况,并进行评分,每2 d记录食量和饮水量。参考李阳等[13]的研究进行疾病活动指数评分,并根据实验过程中的观察稍做修改。体重变化率、疾病活动指数计算方法见式(1)、式(2),评分细则如表2。

表2 小鼠疾病活动指数评分细则Tab.2 Disease activity index scoring rules for mice
体重变化率=(体重-前一天体重)/前一天体重 ;
(1)
疾病活动指数评分=(体重变化评分+大便性状评分+便血情况评分)/3 。
(2)
1.3.4各组小鼠结肠组织病理学评分方法
将保存在甲醛溶液中的结肠组织取出,进行脱水,常规石蜡包埋、切片,苏木精-伊红染色(hematoxylin-eosin staining,HE);在显微镜下观察结肠组织的病变情况并进行结肠组织病理学评分。组织病理学评分计算方法见式(3),评分细则[14]如表3。

表3 结肠炎小鼠病理组织评分细则Tab.3 Histopathological score rules of colitis mice
组织病理学评分=(炎症严重程度评分+隐窝破坏程度评分+炎症范围评分)/3 。
(3)
1.3.5紧密连接蛋白和关键酶表达量的测定
采用免疫蛋白印迹(Western blotting)法测定小鼠结肠组织中紧密连接蛋白Occludin、细胞凋亡因子Caspase-8、COX-2酶的表达量。称取小鼠结肠组织,加入质量分数10%的生理盐水(匀浆液),二者质量体积比为1∶9,采用蛋白定量测定试剂盒(BCA)测总蛋白浓度;加入5倍蛋白上样缓冲液,沸水浴15 min,使蛋白变性;SDS-PAGE电泳分离、转膜,用体积分数5%的脱脂牛奶封闭1 h;稀释一抗,4 ℃孵育过夜,二抗稀释3 000倍,室温下孵育30 min;进行化学反应,曝光、显影、定影,最后用Alpha软件处理系统分析目标条带的光密度值。
1.3.6小鼠结肠上皮细胞凋亡率的测定
采用TUNEL法测定小鼠结肠组织上皮细胞的凋亡率。将小鼠结肠组织脱水,常规石蜡包埋做成切片,根据TUNEL试剂盒说明书进行操作,于荧光显微镜下(FITC激发波长465~495 nm,发射波长515~555 nm)观察并采集图像。DAPI染色的细胞核为蓝色,TUNEL法染色的阳性凋亡细胞核为绿色,每张切片选择5个视野,用Image J软件进行细胞计数,凋亡率计算方法见式(4)。

(4)
1.3.7结肠组织中髓过氧化物酶活性的测定
取小鼠结肠组织,放入预冷后的生理盐水中冲洗干净,滤纸擦干,准确称重,加入质量分数10%的生理盐水,质量体积比为1∶9(预冷后);匀浆,10 000 r/min离心3 min,取上清液按照试剂盒说明书进行MPO活性的测定和计算。
1.4 数据处理
采用Microsoft Excel 整理原始数据;采用SPSS22软件分析数据,结果用平均值±标准差表示;采用GraphPad Prism绘图,采用Image J软件自动计数统计分析上皮细胞凋亡率。
2 结果与分析
2.1 CYPP对UC小鼠疾病活动指数的影响

#表示与正常组比较具有显著性差异(P<0.05),*表示与模型组比较具有显著性差异(P<0.05)。图1 CYPP对小鼠疾病活动指数的影响Fig.1 Effects of CYPP on disease activity index of mice
疾病活动指数是评价结肠炎病理程度的典型指标之一[15]。CYPP对UC小鼠疾病活动指数的影响,实验结果见图1。由图1(a)可知:开始造模后,NC组小鼠体重上升;给予质量分数5%的DSS溶液后,第9天,MC组小鼠出现体重下降。由图1(b)可知,与NC组相比,MC组的疾病活动指数在第8、9天开始升高,显著高于NC组(P<0.05),这是因为从第8天起,MC组小鼠出现解稀烂便、便血等情况。与MC组相比,PC、L、M、H组的疾病活动指数均小于MC组,H组与MC组具有显著性差异(P<0.05),说明这几组小鼠的症状较MC组得到缓解,CYPP可改善结肠炎病状。
2.2 CYPP对UC小鼠组织病理学评分的影响
图2为各组小鼠结肠组织的病理形态以及组织病理学评分。由图2可知:NC组小鼠的结肠组织健康,黏膜上皮组织结构整齐,隐窝完整;MC组小鼠结肠组织肠壁变厚,隐窝几乎完全消失,炎症细胞浸润严重,范围几乎达到100%,组织病理学评分显著高于NC组(P<0.05);L、M、H组肠壁厚度逐渐趋于正常,隐窝破坏程度、炎症细胞浸润范围逐渐减少,评分也逐渐降低。结果说明,CYPP能够保护和改善DSS诱导结肠炎小鼠结肠组织的损伤,减少炎症因子的浸润。
2.3 CYPP对小鼠结肠组织中紧密连接蛋白和关键酶蛋白表达量的影响

He染色切片放大倍数为200倍。不同字母表示不同样品同一指标之间差异显著(P<0.05)。图2 CYPP对小鼠结肠组织的影响Fig.2 Effects of CYPP on colon tissue of mice
图3显示的是紧密连接蛋白Occludin、凋亡因子Caspase-8、COX-2的相对表达量。Occludin蛋白是紧密连接蛋白之一,对维持肠黏膜屏障具有重要作用[16]。
图3(a)为蛋白条带图,由图3(b)可看出:MC组小鼠相对表达量显著低于其他组(P<0.05),说明MC组小鼠结肠中的紧密连接蛋白损失,肠黏膜屏障遭受破坏;PC、L、M、H组Occludin蛋白表达量依次增多,说明前期摄入BER和CYPP可预防Occludin蛋白表达量的下降,保护肠黏膜。
Caspase-8是重要的外源性启动凋亡蛋白之一,位于凋亡通路上游[17]。由图3(c)可看出:MC组小鼠结肠组织中Caspase-8蛋白表达量最高,与NC组具有显著性差异(P<0.05),说明在DSS作用下,Caspase-8表达量增加,Caspase-8与炎症因子受体结合,启动上皮细胞凋亡;L、M、H三组Caspase-8蛋白表达量随着CYPP浓度增加而降低,说明CYPP下调Caspase-8蛋白表达量,对小鼠结肠上皮细胞的凋亡具有抑制作用。

不同字母表示不同样品同一指标之间差异显著(P<0.05)。图3 CYPP对结肠组织中紧密连接蛋白及关键酶相对表达量的影响Fig.3 Effects of CYPP on relative expression of tight junction protein and key enzymes in colon tissue
COX-2在正常的细胞中活性低,基本不表达,当细胞遇到炎症刺激时,表达升高至正常细胞的数倍[18]。由图3(d)可看出:MC组小鼠结肠组织中COX-2表达量显著高于NC组(P<0.05),是NC组的5.73倍;PC组和L、M、H组COX-2的表达量均低于MC组,表明BER和CYPP均可抑制结肠组织中COX-2的表达。
2.4 CYPP对小鼠肠黏膜细胞凋亡率的影响
图4为各组小鼠结肠组织上皮细胞凋亡情况。由图4(a)的荧光图通过计数后,计算得到上皮细胞凋亡率图4(b)。细胞凋亡是一个程序化过程,TUNEL法是检测细胞凋亡最新、最快的方法[19]。从图4(a)可看出:MC组荧光标记的细胞最多,说明MC组小鼠肠上皮细胞凋亡的最多。从图4(b)可看出:MC 组凋亡率显著高于其他组(P<0.05),是NC组的3.65倍;CYPP作用下的L、M、H组凋亡率显著低于MC组,其中H组凋亡率与NC组相比无显著性差异(P>0.05),说明CYPP可抑制结肠上皮细胞的凋亡,且CYPP浓度越大,抑制效果越好。
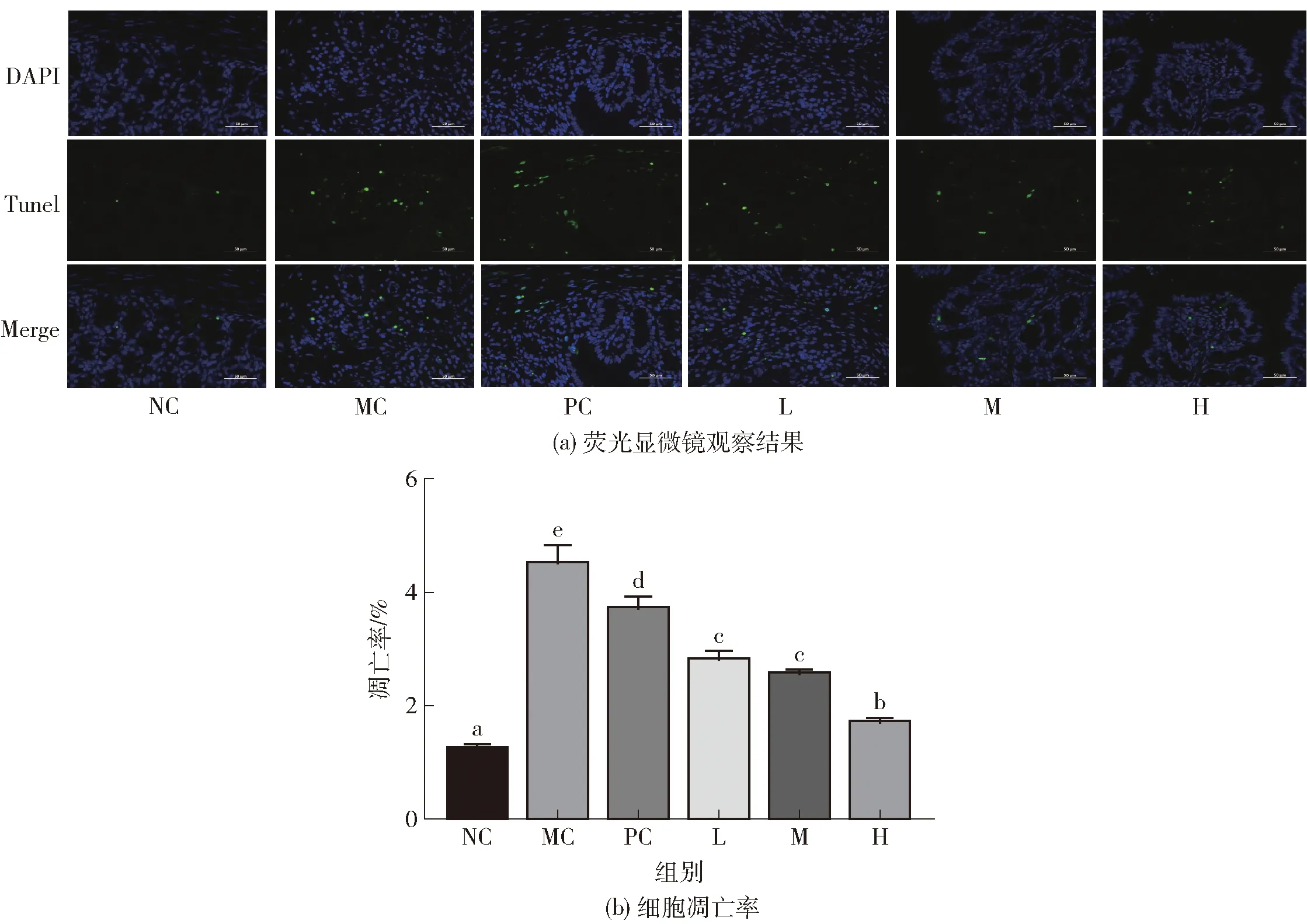
荧光显微镜放大倍数为400倍。不同字母表示不同样品同一指标之间差异显著(P<0.05)。图4 各组小鼠肠黏膜细胞凋亡率Fig.4 Apoptosis rate of intestinal mucosa cells in mice of each groups
2.5 CYPP对小鼠结肠组织中MPO活性的影响
图5显示的是CYPP对小鼠结肠组织中MPO活性的影响情况。MPO存在于中性粒细胞中,通过MPO活性推测中性粒细胞的浸润情况,以此判断炎症的严重程度[20]。由图5可看出:与NC组相比,MC组的MPO活性显著高于NC组(P<0.05);L、M、H组小鼠结肠组织中MPO活性明显低于MC组,且随着CYPP浓度的增加,MPO活性逐渐减少(P<0.05),说明CYPP可降低结肠炎小鼠MPO活性,使中性粒细胞含量降低,减轻小鼠结肠炎症。

不同字母表示不同样品同一指标之间差异显著(P<0.05)。图5 CYPP对DSS诱导小鼠MPO活性的影响Fig.5 Effect of CYPP on DSS induced MPO activity in mice
3 讨 论
近年来,我国UC的发病率逐渐升高,且发病原因错综复杂,包括肠黏膜损伤、遗传因素、肠道微生物影响和环境等[3]。在发病机制研究过程中,实验室动物模型是常用的手段之一。UC模型常用葡聚糖硫酸钠(DSS)、三硝基苯硫酸、恶唑酮和醋酸等化合物进行诱导。桑力轩等[15]以DSS、三硝基苯硫酸、恶唑酮诱导的UC模型进行比较,结果显示:3组大鼠疾病活动指数和组织学损伤评分无显著性差异;TNBS、OXZ实验组在过程中均有2只大鼠死亡,DSS组未出现死亡,安全性更高。
DAI评分是判断结肠炎严重性的重要指标之一,采用疾病活动指数对结肠炎进行评价,能客观准确地反映疾病的活动情况[21]。本实验MC组小鼠于第2天体重开始下降,第3天出现不同程度的便血和稀便,原因可能是诱导UC小鼠的DSS浓度较高,导致相关症状出现较早。实验结果显示,CYPP组的疾病活动指数和组织病理学分数明显低于模型组,说明CYPP可改善小鼠结肠炎病状,保护小鼠肠黏膜免受损伤。Wang等[22]采用2.5%的DSS诱导小鼠结肠炎,发现葡萄籽多酚明显降低了结肠炎小鼠的疾病活动指数,改善结肠组织的病理形态,本实验发现CYPP也具有相同的效果。
Occludin蛋白是紧密连接蛋白之一,本研究发现,经CYPP处理的小鼠,Occludin表达量显著高于模型组,说明CYPP可上调Occludin蛋白表达量,从而保护肠黏膜的机械屏障。Fan等[23]以不同脂化程度的果胶作用于UC小鼠,同样得到低脂化果胶可显著促进ZO-1和Occludin蛋白表达的结果。Caspase-8是细胞凋亡途径的主要诱导因子,炎症条件下与TNF-α受体结合,然后衔接蛋白形成死亡诱导复合物,进而启动Caspase-8级联反应,引起细胞凋亡[18]。张瑞鑫[24]建立绵羊单栏饲养的氧化应激模型,研究葡萄皮渣对肠上皮细胞凋亡的影响,发现葡萄皮渣可显著降低Caspase-8、Caspase-3等的表达,从而抑制肠上皮细胞凋亡。本实验同样发现,CYPP降低Caspase-8蛋白表达量,同时结合TUNEL法检测结肠上皮细胞凋亡率的结果,发现CYPP组结肠组织上皮细胞的凋亡率显著低于模型组,说明CYPP可通过下调Casspase-8的表达量,抑制细胞凋亡途径的开启,从而减少上皮细胞的凋亡,预防肠黏膜损伤。
MPO是中性粒细胞中特有的酶,可间接反映炎症严重程度,王凯[20]分别在建模后的第0、3、7、14、21、28天进行MPO活性测定,发现其与小鼠结肠炎严重程度呈正相关。本实验发现,CYPP组小鼠结肠组织中MPO活性显著低于模型组,且随着浓度的增加,MPO活性逐渐降低,说明CYPP可降低MPO活性,从而降低中性粒细胞的含量,减轻炎症,并呈现剂量依赖性。叶菊风[25]研究金针菇多糖对炎症性肠道的保护作用,发现金针菇多糖可显著降低大鼠MPO活性,减轻炎症反应,本实验得到相似的结果。
COX-2也称环氧化酶,是花生四烯酸合成的限速酶,其基因表达量在正常生理条件下较低,在病理条件下,参与炎症反应,表达量升高数倍。由于COX-2可以快速应答一系列促炎介质和细胞因子,因此被认为在炎症病理过程中扮演着重要的角色[26]。抗晶晶等[27]研究发现,绿原酸可降低体内体外COX-2表达量,并推测绿原酸对ALI小鼠的保护效应可能与其抑制COX-2的表达量有关,本实验同样发现CYPP可降低COX-2的表达量,并推测COX-2在预防肠黏膜损伤的机制中扮演了重要角色。本研究通过初步探究发现,山药多酚可以预防肠黏膜损伤,本课题组前期已完成山药皮分离纯化的相关工作[28],下一步将针对CYPP中化合物,研究其是否可以保护肠黏膜,并测定小鼠结肠组织的氧化应激水平、炎症因子表达量及NF-кB/COX-2信号通路中关键蛋白表达量,研究CYPP中化合物的抗炎活性。
4 结 论
本研究探讨了CYPP对结肠炎小鼠肠黏膜的保护作用。采用质量分数为5%的DSS构建UC小鼠模型,通过观察表观指标的变化以及测定紧密连接蛋白、关键酶的表达及细胞凋亡率,探讨CYPP预防肠黏膜损伤的作用及机制。研究结果发现:疾病活动指数和组织病理学评分显示,L、M、H组小鼠肠黏膜损伤程度明显低于MC组(P<0.05),与NC组无显著性差异(P>0.05);CYPP可上调Occludin蛋白的相对表达量,下调Caspase-8和COX-2的相对表达量,降低了肠黏膜细胞凋亡率,保护肠黏膜,从而缓解结肠炎症的病理程度。希望本研究在提高山药资源利用多元化的同时,能够为山药健肠胃的说法提供科学依据,为开发预防结肠炎保健功能食品或辅助药物提供理论基础。
