HBV-DNA实时荧光定量PCR检测试剂性能评价
2021-08-26刘红敏
刘红敏
乙型肝炎病毒简称乙肝病毒(HBV),是目前已知的感染人的最小DNA病毒之一,直径只有头发丝的1/40 000,而它也是最难治愈的病毒之一[1,2]。HHBV虽然是一个双链DNA病毒,但和身为RNA的艾滋病毒(HIV)一样,其复制存在着逆转录的过程,使得病毒基因组可以被整合到机体中,使得机体难以将病毒彻底清除,成为潜在致癌的隐患;另外HBV在进入肝细胞后可以转化成cccDNA,并长期潜伏在细胞核中,具有很强的隐蔽性,即使抗病毒治疗也难以彻底清除;而一旦患者长期使用免疫抑制剂或化疗、放疗导致机免疫力低下,cccDNA则会跳出转入活跃的复制状态,使得HBV感染长期持续性存在。因此,HBV在目前医疗水平上,是一个可以控制但不能彻底清除的病毒[3]。HBV-DNA的检测和监测在预防和乙型肝炎患者的治疗过程中非常重要。参照美国临床实验室标准化委员会颁布的EP系列文[4,5]件及《医学实验室质量和能力认可准则在基因扩增检验领域的应用说明》[6]和《核酸检测试剂盒质量评价技术规范》[7],从精密度、正确度、检测限(定量检测下限)、线性范围分析性能标准操作来评价和评估我们实验室检测乙型肝炎病毒的检测系统[8]。
1 材料与方法
1.1 实验仪器与检测试剂 扩增仪为美国ABI StepOnePlus;加样器为赛默飞医疗器械有限公司提供;高速冷冻离心机来自湖南湘仪实验室仪器开发公司;检测试剂盒为艾康生物有限公司提供。
1.2 实验样本选择 精密度实验所用定值阳性样本为故城县医院核酸实验室收集的高浓度的阳性标本的混合物,正确度所用参考物质为2020年卫生部临检中心核酸病毒学室间质评标本。稀释用血清为阴性血清(HBV-DNA,HIV,HCV,TP等感染性疾病筛查均为阴性),且该阴性血清无脂血溶血等异常情况。
1.3 检测原理 试剂盒选用乙型肝炎病毒保守基因片段设计特异引物及特异Taqman探针,该探针能与引物扩增区域中间的一段DNA模板发生特异性结合,PCR延伸反应中,Taq酶的外切酶活性将5’端荧光基团从探针上切割下来,使之游离于反应体系中,从而脱离了3’端荧光淬灭基团的屏蔽,即能接受光刺激而发出可供仪器检测的荧光,从而实现在全封闭反应体系中对乙型肝炎病毒核酸的全自动化检测。试剂盒中使用内质控体系,能够有效防止假阴性,同时也使用UNG+dUTP防污染措施,能够有效排除假阳性结果。
1.4 检测方法 取待测样本(血清),阴阳性质控品,定量标准品各200 μl,分别加入200 μl核酸提取液1’振荡混匀后12 000 r/min离心10 min;弃上清350 μl,留50 μl;加入50 μl核酸提取液2(内含固体沉淀颗粒物,为使颗粒均匀分布,每次取样时请用吸头反复吸打);加入4 μl乙型肝炎病毒内标模板,振荡混匀,100℃水浴或干浴10 min,然后12 000 r/min离心10 min,取上清20 μl加入到20 μl反应混合液(HBV反应混合液19.5 μl+0.5 μl Taq酶)中,盖紧反应管盖,转移至PCR扩增检测区。将各反应管按一定顺序放入PCR扩增仪上,按扩增程序:25℃ 10 min,95℃ 3 min,(94℃ 15 s,58℃ 30 s)45个循环进行扩增。判断标准:阴性质控CT值无数据;标准曲线相关系数应达到0.980以上;阈值线以上的荧光曲线应当是具有明显S型曲线,否则实验视为无效,应当检查仪器,试剂,扩增条件等方面的误差。
1.5 评估方法 依照《核酸检测试剂盒质量评价技术规范》等相关文件及相关操作规范中的方法作精密度,正确度,检测限,线性范围等的评估检测。
1.5.1 精密度评估:常用相对偏差(RSD=S/X×100%)表示精密度。批内精密度:将准备好的高浓度和低浓度的阳性定值样本在同批试剂中分别进行20次重复测定(正向和逆向分别10次),分别统计2种浓度样本检测值(浓度对数值)的均值和标准差,再计算批内相对偏差。批间精密度:将高浓度和低浓度的阳性定值样本分别进行4次重复测定,连续检测5 d,可得到40个数据,统计样本检测值(浓度对数值)的均值和标准差,再计算批间相对偏差。判断标准为RSD<5%。
1.5.2 准确度评估:准确度是指在一定的条件下多次测定的平均值与真值相符合的程度,用来衡量系统误差的指标。选用卫生部临检中2020第一次核酸检测(病毒学)室间质评样本作为参考品进行测定,检测结果值与给的靶值和上下限进行对比,HBV-DNA检测结果与靶值的偏差<±0.4对数值。即评价结果成绩≥80%,正确度的验证判定为通过。
1.5.3 检测限评估:检测限是指样品中分析物的最小量,可以在规定的可能性条件下予以检出[9]。将阳性定值样本稀释至200 U/ml(对数值为2.3)。重复检测20次看是否符合《核酸检测试剂盒质量评价技术规范》中检出限的要求(重复测定20次,按95%的置信限下限,测定为阳性的次数应≥17次)。
1.5.4 线性范围评估:线性范围(临床可报告范围)是指阳性定值样本经过稀释或其他预处理的方式而间接获得的分析物值的范围。将高浓度阳性定值样本进行系列梯度稀释至200 U/ml,对高浓度样本和稀释后的样本进行同批次检测,每个样本重复检测3次,计算相关系数R2,如果R2>0.98,则线性范围评估通过。
1.5.5 实验过程需要注意事项:实验过程中严格按照厂商标准操作进行检测系统的校准,每次实验均应按照室内质量控制程序进行室内质控,室内质控在控时,所做的实验数据才可以采用,如出现失控数据,则要及时找出原因并予以纠正,重新进行检测[10,11]。实验样本要稳定,其基质组成应尽可能与临床样本相似。实验样品的浓度尽可能选择与厂商申明性能相近的浓度或接近该项目医学决定水平的浓度[12]。通常选择稳定好的血清基质的质控物作为试验品[13]。注意冰冻保存实验样品内分析物的温度性[14]。严格控制冻融的时间、混匀的操作手法。在正式实验前,操作人员应熟练掌握仪器的操作程序、校准程序、保养程序以及检测程序等,熟悉评价方案。为获得准确的测量结果,由同一操作员按相同的方法、使用相同的检测设施、严格按照操作规程进行操作[15]。
1.6 统计学分析 进行数据分析时应将浓度值转化成对数值进行计算,应用SPSS 15.0统计软件。进行线性范围验证时,应将实测值和理论值进行线性回归分析。
2 结果
2.1 精密度的评价结果 批内相对偏差分别为1.27%和1.32%;批间相对偏差分别为1.6%和2.5%,均<5%。见表1。

表1 精密度评价
2.2 准确度评估 参照2020年度国家卫生健康委临床检验中心和河北省临床检验中心核酸检测(病毒学)室间质评结果。见表2、3。
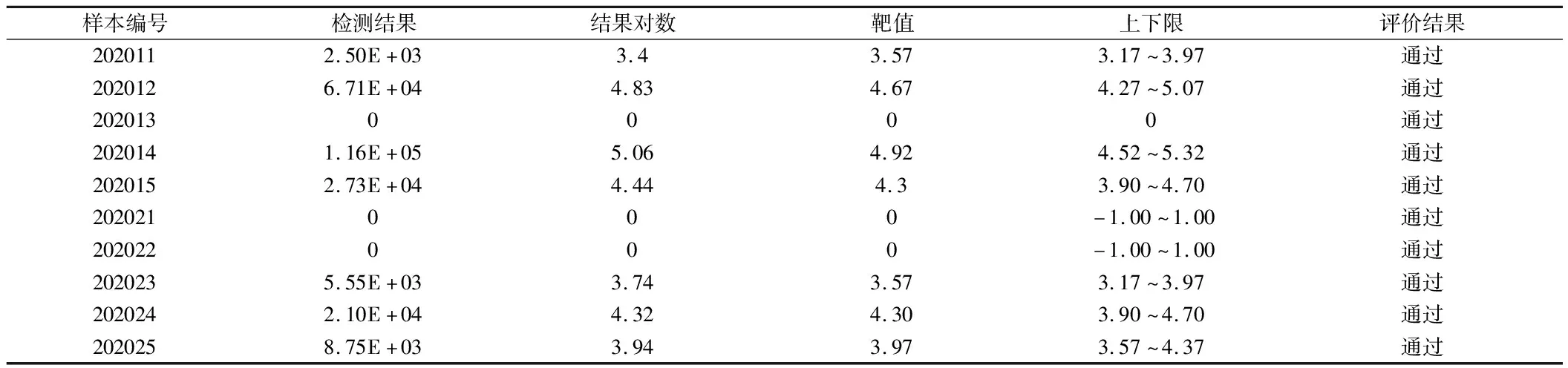
表2 2020年全国临床实验室核酸检测(病毒)室间质评结果
2.3 检测下限验评估结果 将收集的高浓度临床阳性标本稀释至200 U/ml,分别用同批次试剂重复检测20次,实验全部检测出有效数据,检测结果符合GB/T 37871-2019《核酸检测试剂盒质量评价技术规范》中检出限的要求,并且重复检测结果间的系数CV<20%。见表4。
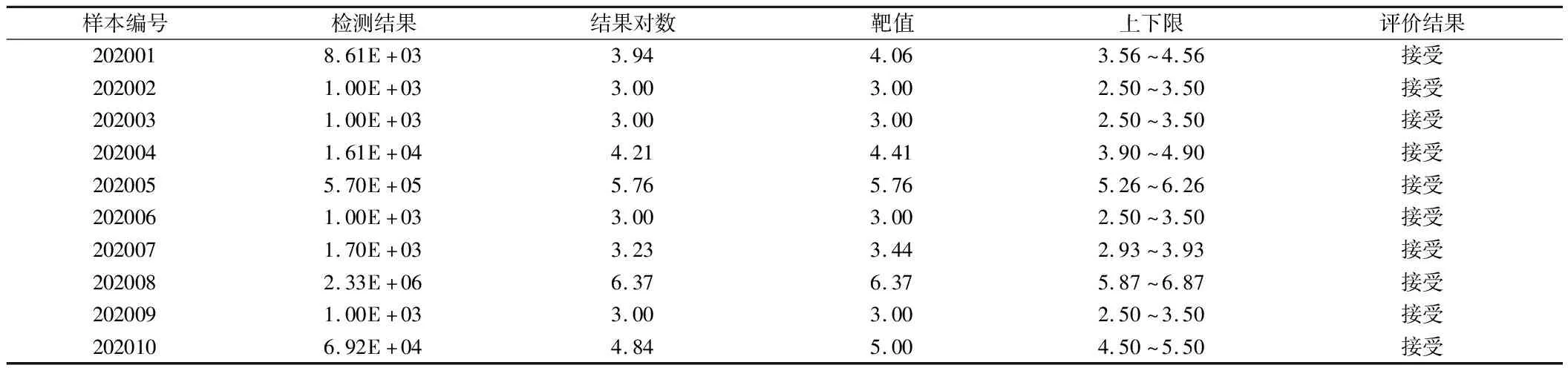
表3 2020年河北省室间质评统计结果-临床核酸检测(病毒学)
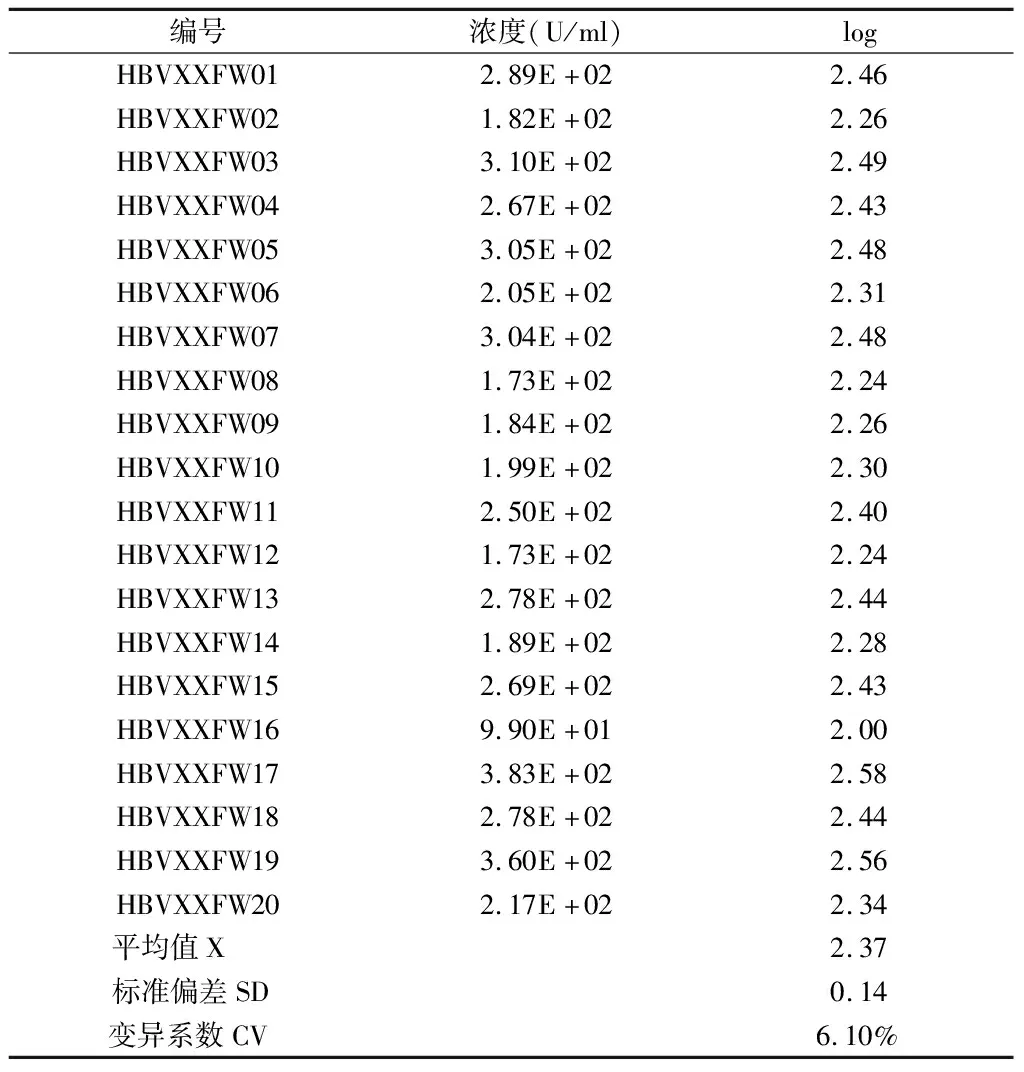
表4 检测下限结果
2.4 线性范围评估 将收集到的临床高浓度样本梯度稀释至2.00E+02 U/ml,以检测样本的浓度对数值作为横坐标,检测样本的CT值作为纵坐标,得出样本浓度对数值与CT值的相关系数R2为0.995;检测样本浓度对数值的实测值作为横坐标,预期浓度对数值作为纵坐标,得出浓度对数值的实测值与预期浓度对数值的相关系数R2为0.999。样本实测值结果与预测值结果比较差异没有统计学意义。在2.00E+02-1.00E+07分析测量范围线性关系良好(线性关系系数R2=0.99)。检测结果符合GB/T 37871-2019《核酸检测试剂盒质量评价技术规范》中线性范围的要求:相关系数R2≥0.98。见图1、2。

图1 实测值与CT值散点
3 讨论
乙型肝炎病毒具有顽强的抵抗力:对热、低温、干燥、紫外线、一般浓度的化学消毒剂都能够耐受,但是HBV怕高热,如加热到100℃,只要10 min就可使其失去传染性。乙型肝炎病毒有明显的嗜肝性:它侵入人体后就要专门进攻肝脏,钻入肝细胞,在那儿定居并繁衍后代。大量乙型肝炎病毒集中在肝细胞内,不断地繁殖、复制,成熟的乙型肝炎病毒被释放出肝细胞,又侵入别的健康的肝细胞,这样不断复制,不断侵蚀,最后诱发肝细胞的免疫损伤[18]。乙型肝炎病毒携带者的感染几乎都是在胎儿期或幼儿期感染乙型肝炎病毒的,经过了十几年乃至几十年的感染历程,乙型肝炎病毒仍然在他们体内不消失,但也不发病。乙型肝炎病毒变异的特性给临床诊断和治疗带来许多麻烦。癌变的原因可能是乙型肝炎病毒的X基因整合到肝细胞上,发生了突变,导致肝癌。早发现,早阻断是预防感染乙型肝炎病毒的重要途径,所以真实可靠的HBV-DNA检测结果不仅是预防感染乙型肝炎病毒的关键也是监测乙型肝炎患者治疗效果的关键指标。检测系统的性能验证是检验工作中保证检测质量的前提。每个检测项目都应该有它自己的性能验证方案。根据CANS-CL02-A009:2018《医学实验室质量和能力认可准则在分子诊断领域的应用说明》要求,性能验证内容至少包含精密度,正确度,检测限,线性范围等内容[19]。
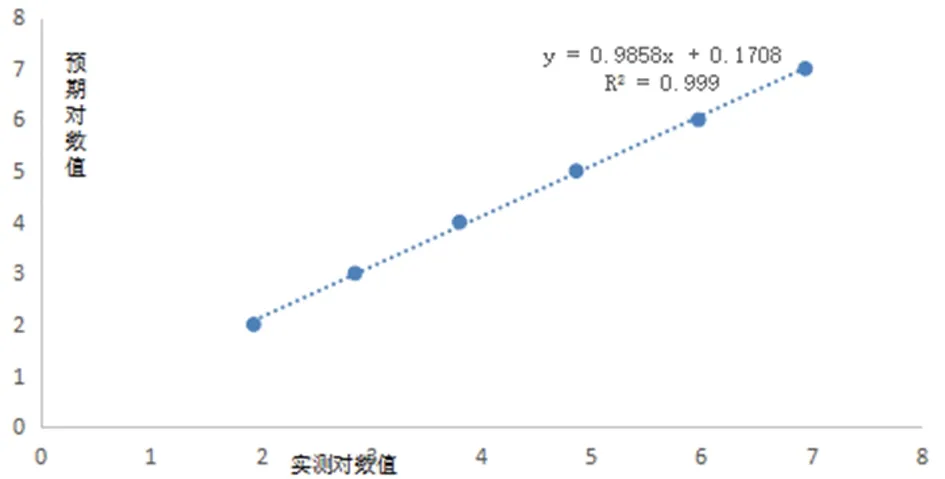
图2 实测值与预期值散点图
我们实验室依据GB/T 37871-2019《核酸检测试剂盒质量评价技术规范》及CANS-CL02-A009:2018《医学实验室质量和能力认可准则在分子诊断领域的应用说明》相关要求对我们实验室所用乙型肝炎病毒核酸检测系统的精密度,准确度,检测限及线性范围进行评估。评估结果显示:高浓度定值阳性样本E7(1.0E+07)和低浓度定值阳性样本E3(1.0E+03),同批次分别重复检测20次,计算批内精密度标准偏差分别为1.27%和1.32%;高低浓度阳性样本每天重复检测4次,连续检测5 d,计算批间精密度标准偏差分别为1.60%和2.50%。2020年度卫生部临检中心核酸检测(病毒学)和河北省临检中心临床核酸检测HBV-DNA室间质评我们实验室均满分通过。我们实验室结合慢性乙型病毒性肝炎防治指南和我们实验室所用试剂盒检测限,实验室设定HBV-DNA的检测范围为2.0*102~1.0*107,最低检测下限为200 U/ml。将实验室收集到的临床高浓度阳性样本稀释至200 U/ml,重复检测20次,结果均能被检测出有效数据。再将高浓度阳性标本倍比稀释,计算得到线性相关系数R2=0.99,>0.98,现用检测试剂测量范围线性关系良好。
为保证检测质量,更好地为临床为患者服务,任何检测系统在使用前均应进行方法学的性能验证。特别是在医学临床检验中,检测结果的准确与否直接影响到患者的健康,严重者会危害到患者生命,所以检测系统的性能验证在检测工作中非常重要。临床实验室应根据各自检测项目的特点制订一套有效可行的适合自己实验室的性能验证方案。
