维持性血液透析患者血清BMP-2和BMP-4水平与血管钙化的关系
2021-08-26陈燕文甘春蕾罗凤枚叶雅龙
陈燕文,陈 都,甘春蕾,罗凤枚,叶雅龙
慢性肾脏病是由多种原因引起的慢性肾功能障碍,在我国患病率为10.8%,已成为重要的公共卫生问题[1]。终末期肾脏病是慢性肾脏病进展的不可逆阶段,此阶段主要的治疗方式是维持性血液透析(maintenance hemodialysis, MHD)。对于慢性肾脏病患者,MHD是一个漫长的治疗过程,在此期间也会出现诸多不良反应,如透析性骨病、血管钙化、贫血、感染、睡眠障碍、认知功能障碍、心功能下降等,其中血管钙化是MHD患者发生心血管病变的主要原因[2-4]。骨形态发生蛋白(BMP)是转化生长因子超家族的成员,能够刺激成骨细胞形成并促进血管钙化,其中BMP-2和BMP-4通过与丝(苏)氨酸激酶受体结合向细胞内传递信号,继而诱导血管平滑肌细胞向成骨样细胞分化,或是诱导血管平滑肌细胞发生凋亡导致血管钙化的发生[5-6]。本研究旨在探讨MHD患者血清BMP-2和BMP-4水平及与血管钙化相关指标的相关性,并分析血管钙化的影响因素,了解BMP-2和BMP-4与MHD患者血管钙化的关系,为临床上该病的预防和治疗提供参考。
1 资料与方法
1.1一般资料 选取2017年8月—2019年7月于我院肾内科进行MHD的158例慢性肾衰竭为研究对象,纳入MHD组。①纳入标准:患者均诊断为慢性肾衰竭[7];透析龄>6个月,透析频率为每周2~3次;患者精神状态正常,能够配合透析治疗;患者知晓本研究并签署知情同意书。②排除标准:有严重心血管疾病、感染、其他器官重大疾病或恶性肿瘤者;近3个月使用抗生素、糖皮质激素或免疫抑制剂等;患有甲状旁腺疾病或骨代谢异常等可能影响钙磷代谢的疾病;近期服用钙剂、骨化三醇、降脂药物等影响钙磷代谢、血脂水平的药物;妊娠期女性;临床资料不完整者。另选取同期于我院进行体检的158名健康志愿者作为对照组。本研究经医院医学伦理委员会审核并通过。
1.2方法
1.2.1一般资料采集:对两组进行规范病史采集,收集一般资料,包括性别、年龄、体质量指数(BMI)等,并收集MHD组的透析龄及原发疾病(高血压肾病、糖尿病肾病、慢性肾小球肾炎等)情况。
1.2.2血清学检测:采集两组清晨空腹肘静脉血5 ml,低速离心机3800 r/min离心15 min,分离血清置于-80℃冰箱中待测。使用全自动生化仪检测血清白蛋白(ALB)、血钙、血镁、血磷及全段甲状旁腺激素(iPTH)。使用酶联免疫吸附试验试剂盒(武汉伊莱瑞特生物科技股份有限公司)检测血清BMP-2和BMP-4水平,严格按照试剂盒说明书进行操作。
1.2.3血管钙化评分:根据改善全球肾脏病预后组织发布的指南建议,使用腹部侧位X线检查作为检测透析患者是否存在血管钙化的基础检查[8]。由放射科医师对两组进行腹部侧位X线检查,评价受试者腹主动脉钙化积分(AACs)。AACs评分方法:采用半定量积分系统分别评价第1~4腰椎每个节段腹主动脉前、后壁钙化的严重程度,根据该节段钙化累及的范围给予评分(0分为未见钙化,1分为钙化累及范围<1/3,2分为钙化累及范围1/3~2/3,3分为钙化累及范围>2/3),各节段累及范围得分之和为该受试者的AACs(0~24分)。为保证AACs的可靠性,由两位有经验的放射科医生采用盲法评估腹主动脉钙化情况,并取平均值;若二者评分相差>5分,则请第3位放射科医生对其评分,取3个评分的平均值作为该受试者的最终AACs。AACs=0分为无钙化,AACs>0分且≤4分为轻度钙化,AACs>4分且≤15分为中度钙化,AACs>16分为重度钙化[7]。
2 结果
2.1MHD组与对照组的临床资料比较 MHD组与对照组性别、年龄、血钙及BMI比较差异无统计学意义(P>0.05)。MHD组iPTH、血磷、钙磷乘积、BMP-2、BMP-4、腹主动脉钙化率、AACs均高于对照组,ALB、血镁低于对照组(P<0.01)。见表1。
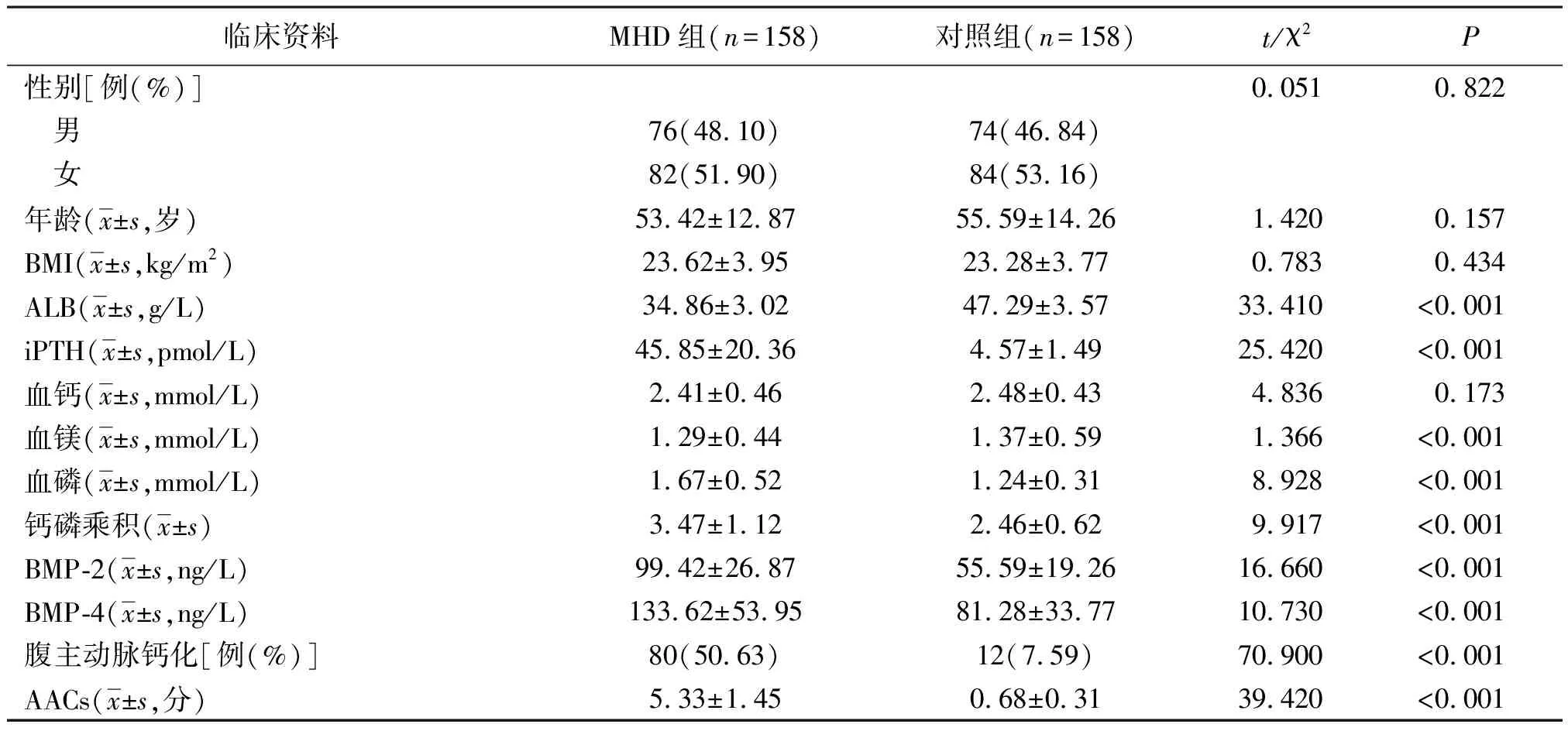
表1 维持性血液透析患者和健康志愿者两组的临床资料比较
2.2MHD患者血管钙化情况 对158例MHD进行血管钙化评分,其中无钙化32例,轻度钙化63例,中度钙化44例,重度钙化19例。按照钙化程度分为无、轻度钙化组95例,中、重度钙化组63例。
2.3不同血管钙化程度MHD患者的临床资料比较 中、重度钙化组与无、轻度钙化组性别、原发疾病、BMI、ALB、血钙水平比较差异无统计学意义(P>0.05)。中、重度钙化组的年龄、透析龄、iPTH、血镁、血磷、钙磷乘积、BMP-2、BMP-4均显著高于无、轻度钙化组(P<0.01)。见表2。

表2 不同血管钙化程度维持性血液透析患者两组的临床资料比较
2.4影响MHD患者血管钙化的多因素Logistic回归分析 以是否发生血管钙化为因变量,以年龄、透析龄、iPTH、血镁、血磷、钙磷乘积、BMP-2、BMP-4为自变量,建立多因素Logistic回归模型进行分析。结果显示,年龄、透析龄、BMP-2、BMP-4、钙磷乘积、iPTH均为影响MHD患者血管钙化的独立危险因素(P<0.05,P<0.01)。见表3。
2.5MHD患者血清BMP-2、BMP-4与临床指标的相关性分析 Pearson相关分析结果显示,BMP-2、BMP-4与性别、BMI、ALB、血钙无相关性(P>0.05),与年龄、透析龄、血镁、血磷、钙磷乘积、iPTH、AACs呈正相关(P<0.05,P<0.01)。见表4。MHD患者血清BMP-2与BMP-4也呈正相关(r=0.507,P=0.032)。
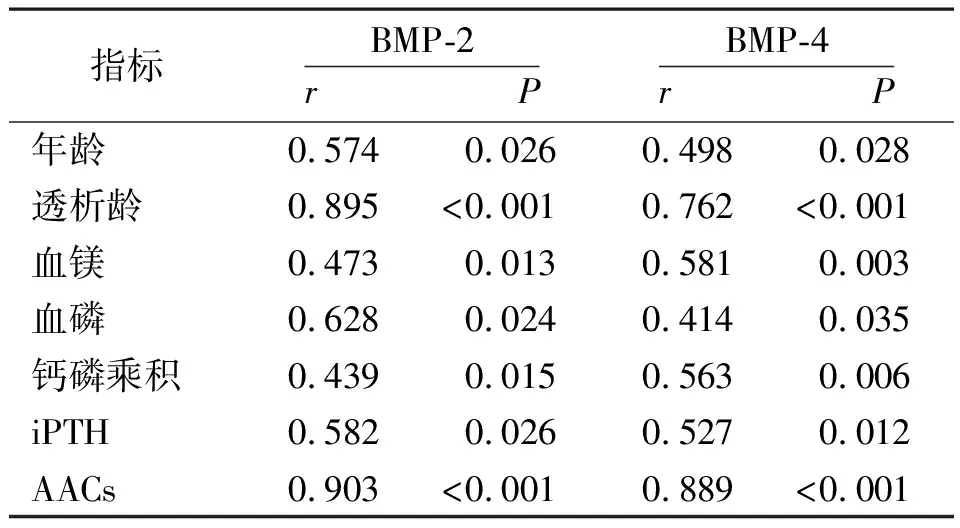
表4 维持性血液透析患者血清BMP-2、BMP-4与各临床指标的相关性分析
3 讨论
心血管事件是造成MHD患者死亡的主要原因,占总病死率的50%,比非MHD患者高20倍左右,而MHD患者合并血管钙化与心血管病死率升高有关[9-10]。本研究结果显示,与对照组比较,MHD组腹主动脉钙化率显著升高,证实MHD患者血管钙化的发生率较高,与已公开发表文献中数据相一致[11-12]。血管钙化的发生机制复杂,是内皮细胞和平滑肌细胞主动调节的病理过程,其中有诸多促进钙化的因素与钙化抑制因子发挥作用[13-14]。既往研究证实,BMP-2和BMP-4通过诱导氧化应激、内皮功能障碍及提高血糖浓度发挥促炎、促动脉粥样硬化的作用,并且通过诱导血管平滑肌细胞的成骨表型来促进血管钙化[15]。本研究结果发现,MHD患者血磷、钙磷乘积、iPTH、腹主动脉钙化率和AACs高于对照组,而ALB、血镁水平低于对照组,并且血清BMP-2和BMP-4水平较对照组均显著升高;证实MHD患者容易发生血管钙化。另外,MHD患者常发生高磷血症,导致钙磷沉积,异常的血钙和血磷水平诱发继发性甲状旁腺功能亢进,以上多种因素极易导致血管钙化的发生,与既往对血管钙化发生的病理生理机制研究结果一致[16]。
本研究进一步将MHD患者按血管钙化程度分为无、轻度钙化组与中、重度钙化组,比较两组临床资料发现,中、重度钙化组的年龄、透析龄、iPTH、血镁、血磷、钙磷乘积与无、轻度钙化组比较差异有统计学意义,与临床中血管钙化危险因素的共识相一致。此外本研究发现,中、重度钙化组血清BMP-2和BMP-4水平均较无、轻度钙化组显著升高,进一步提示血清BMP-2和BMP-4可能参与MHD患者血管钙化的发生。Wei等[17]通过建立慢性肾脏病血管钙化大鼠模型,观察到模型诱导后第4周的慢性肾脏病大鼠主动脉中BMP-2及BMP-4 mRNA表达水平显著升高,认为BMP信号通路的激活参与了慢性肾脏病大鼠血管钙化的早期发展,本研究结果与上述动物实验相一致。BMP-2和BMP-4参与血管钙化发生可能的病理生理机制为,MHD患者体内存在微炎症状态、氧化应激反应,且出现钙磷代谢紊乱,以上因素均可通过相关信号通路促进钙化因子表达,进而导致该生理过程失衡,诱发血管钙化,但具体的分子机制还需进一步研究探讨。
本研究通过多因素Logistic回归分析发现,年龄、透析龄、BMP-2、BMP-4、钙磷乘积、iPTH均为影响MHD患者血管钙化的独立危险因素。该结果提示,血清BMP-2和BMP-4水平较高的MHD患者,临床应警惕发生血管钙化,及时提供预防措施,纠正钙磷代谢紊乱,延缓血管钙化的发生。此外,对于难以使用标准AACs法的MHD患者,可考虑检测血清BMP-2和BMP-4水平评估发生血管钙化的可能。Pearson相关分析结果显示,MHD患者血清BMP-2、BMP-4与年龄、透析龄、血镁、血磷、钙磷乘积、iPTH、AACs呈正相关,且血清BMP-2与BMP-4呈正相关,与Kercheva等[18]的报道相一致。本研究结果提示血清BMP-2和BMP-4可能通过影响血镁、血磷及钙磷代谢参与血管钙化的发生,为探讨BMP-2和BMP-4在MHD患者血管钙化过程中的病理生理机制奠定了基础。
综上所述,MHD患者血清BMP-2、BMP-4水平显著升高,且二者与患者血管钙化程度及钙磷代谢有关。此外,血清BMP-2、BMP-4作为MHD患者血管钙化的独立危险因素应受到临床重视,并加强对二者的监测。本研究为单中心小样本研究,还有待进一步扩大样本量并增加基础实验,探究BMP-2、BMP-4参与MHD血管钙化过程的具体机制。
