无机盐对κ-卡拉胶凝胶行为影响的机理
2021-08-25苏一帆钱志强
苏一帆,钱志强,刘 忠
(1.中国科学院 青海盐湖研究所,中国科学院 盐湖资源综合高效利用重点实验室,青海省盐湖资源化学重点实验室,青海 西宁 810008;2.华侨大学 化工学院,福建 厦门 361021)
无机盐的制备和应用与有机物质有一定关联,一方面,在有些无机盐的制备过程中要用到浮选剂、萃取剂、粒度与形貌调节剂等有机物质;另一方面,无机盐的加入可改变有些有机物质的物理化学性质,从而实现这些有机物质的特殊用途。在有些无机盐的制备过程中,有机物质作为分离试剂、功能或形貌等添加调节剂的工艺过程和作用机理,已经有较多的研究和比较深入的认识[1-2],然而,无机盐作为主要反应成分或辅助添加成分,对有些有机物质,尤其是高分子有机物质影响的过程和机理不够清楚。高分子有机物质中无机盐的使用是无机盐在有机精细化工中的重要应用方向[3]。文章以κ-卡拉胶为例,深入分析和研究了无机盐对κ-卡拉胶凝胶行为影响的机理,为κ-卡拉胶的应用提供理论依据,进而为无机盐在精细有机化工中的应用提供参考。
1 κ-卡拉胶及其主要物理化学性质
卡拉胶(Carrageenan,CAS 9000-07-1)是从红藻科的角叉菜属、麒麟菜属、杉藻属及沙菜属等海藻中提取出的天然硫酸盐线性多糖,是由β-D-半乳糖与3,6-内醚-α-D-半乳糖交替连接形成的线形高分子聚合物[4-12],其分子量通常在400 kDa~700 kDa之间[7]。根据D-半乳糖是否成醚、硫酸基的含量和结合位置,卡拉胶被分为不同类型[4,8,11-12]。尽管不同文献给出的类型存在差别,但一般认为目前生产和使用的主要是κ-型、ι-型和λ-型3种卡拉胶。以红藻为原料,难于分离提取出高纯度的单一类型卡拉胶。由于制备原料、制备方法等的差异,所得到卡拉胶的分子量与物理化学性质存在一定差异。
卡拉胶是三大海藻胶(褐藻胶、卡拉胶和琼胶)之一,其产量仅次于褐藻胶,位居第2位[4-5]。卡拉胶不具有营养价值,但具有生物相容性、可生物降解性、高保水性、流变特性、凝胶特性,卡拉胶与其它食品胶有良好的配伍性和协同增效作用,与蛋白质有良好的交互作用和乳化稳定作用,因而被广泛用作食品、化妆品、药品等的凝胶剂、稳定剂、增稠剂、乳化剂、分散剂、封装材料、医学工程材料等[4-5]。
在所有类型的卡拉胶中,κ-卡拉胶具有较好的亲和性、分散性、持水性等,容易形成螺旋结构[3],因而更受关注。图1给出了κ-卡拉胶理想的重复单元结构[9]。
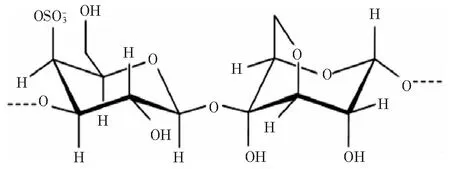
图1 κ-卡拉胶理想的重复单元结构[9]Fig.1 Ideal repetitive unit structure of κ-carrageenan
1.1 κ-卡拉胶的溶解性
卡拉胶具有带负电荷的硫酸基和不带电荷的醚基与羟基,这些基团都亲水。带负电荷的硫酸基与极性水分子产生静电吸引作用,水分子中的氢原子朝向硫酸基。除了静电吸引作用外,硫酸基也可以与水分子之间产生离子型氢键。电中性的醚基与羟基都能与水分子之间产生氢键作用。由于上述的静电吸引作用和氢键作用,卡拉胶都能溶解于热水。钠盐可能是卡拉胶的最易溶解形式,κ-、λ-和ι-卡拉胶的钠盐都能溶于冷水,但κ-卡拉胶的钾盐和钙盐在冷水中只能吸水膨胀,而不能溶解[12]。卡拉胶的溶解度随分子量的减小而增大[7]。卡拉胶在浓盐溶液中都不溶[6]。
在热牛奶中,κ-、λ-和ι-卡拉胶都溶解,而κ-和ι-卡拉胶在冷牛奶中难溶或不溶[12]。卡拉胶难溶于甲醇、乙醇、丙醇、异丙醇、乙腈、丙酮等大多数有机溶剂,常用这些有机溶剂作为沉淀剂,使卡拉胶从水溶液中沉淀出来[5,7,12]。
1.2 κ-卡拉胶的化学稳定性
卡拉胶在中性和碱性介质中很稳定,即使加热也不易水解。但在酸性介质中,尤其在pH值4以下的酸性介质中,容易发生酸水解,大分子降解为小分子,体系粘度下降,卡拉胶失去凝固性。加热会促进水解[6-7,12]。酸水解主要发生在1,3-糖苷上,降解速率受羟基取代方式、3,6-半乳糖的存在以及多糖构象的影响[7]。室温下,凝胶状态的卡拉胶抵抗酸水解的能力强于溶解态的,因为在凝胶状态下,卡拉胶形成比较紧密的三维网状结构,对糖苷键起到一定的保护作用,降低了它被酸水解的程度[6-7,12]。
1.3 κ-卡拉胶的胶凝性
一般认为κ-卡拉胶的凝胶化涉及两个过程:(1)线团到螺旋(coil-to-helix),κ-卡拉胶大分子链的无规线团形成螺旋;(2)聚集到凝胶(aggregation-to-gelation),形成的螺旋聚集成三维网状凝胶(图2)[6,8,12]。对线团到螺旋的过程,形成单螺旋还是双螺旋,存在争议[10,12]。
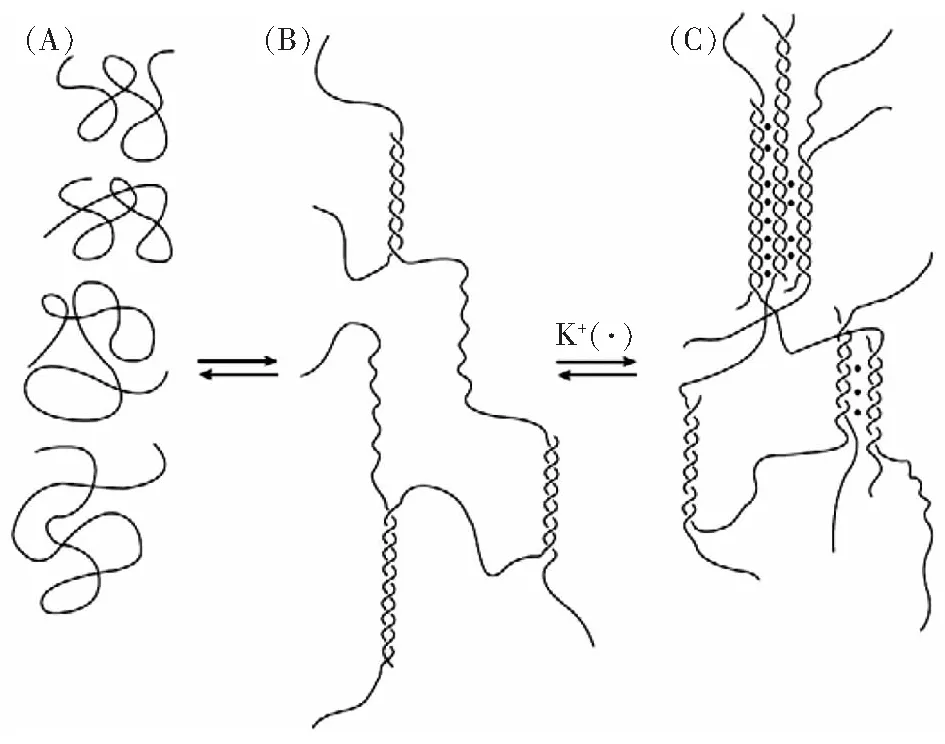
图2 κ-卡拉胶的胶凝过程示意图[6]Fig.2 Gelation process of κ-carrageenan(A)热溶液中κ-卡拉胶呈无归线团状态 (B)冷却时线团向螺旋转化(C)钾离子促进凝胶化
κ-卡拉胶具有热可逆凝胶化性能。在高温下,κ-卡拉胶在溶液或溶胶中以随机线团存在,冷却至某一温度时,随机线团转变为螺旋结构,发生溶胶—凝胶转变而形成凝胶;升温发生可逆过程,加热后凝胶解体,κ-卡拉胶的螺旋结构又返回到无规线团的状态。κ-卡拉胶形成的凝胶为物理凝胶,溶胶—凝胶转变具有临界现象,发生转变的温度称为凝胶化温度,也叫凝胶化点。在凝胶化温度下体系突然失去流动性,呈果冻状,之后随凝胶化程度的加深,凝胶强度逐渐提高,成为固体[12-13]。
κ-卡拉胶的凝胶化是复杂的过程,受半乳糖硫酸化模式、多糖浓度、温度、共溶质和共存离子的影响[7-8],另外,硫酸基、羟基、内醚与凝胶化的关系也比较紧密[12]。体系中阳离子的存在对κ-卡拉胶的凝胶化影响较大。阳离子能屏蔽硫酸基的负电荷而稳定螺旋结构,并对螺旋结构聚集成三维网状结构有促进作用,使得线团向螺旋的转变温度提高,凝胶化温度提高[3,7](图2)。例如,在钾离子存在下,将4%的κ-卡拉胶溶液冷却至45 ℃~60 ℃,就会形成一种硬而脆的凝胶,有泌水性[6,11]。钙离子的凝胶作用比钾离子差[6]。若无阳离子的存在,则溶胶冷却后只形成溶解态聚集体,不能形成凝胶[12]。阴离子对κ-卡拉胶胶凝化的影响不如阳离子明显。SCN-和I-离子对κ-卡拉胶的凝胶化有抑制作用[7]。
κ-卡拉胶具有蛋白质反应性。蛋白质是两性聚电解质,介质pH值低于其等电点时,蛋白质带正电荷,能与带负电荷的κ-卡拉胶产生作用,促进胶凝化过程,提高凝胶强度;介质pH值高于蛋白质的等电点时,蛋白质带负电荷,加入同样带负电荷的κ-卡拉胶,可避免某些金属离子对蛋白质产生的凝析作用[5]。
2 无机盐影响κ-卡拉胶凝胶行为的主要机理
κ-卡拉胶水溶液或水溶胶的胶凝行为和两种作用相关:(1)κ-卡拉胶离子链与水分子之间的作用;(2)κ-卡拉胶离子链之间的相互作用。如果前一种作用强于后一种作用,则κ-卡拉胶倾向于以溶液或溶胶的形式存在;如果后一种作用强于前一种作用,则κ-卡拉胶倾向于以凝胶形式存在。κ-卡拉胶离子链与水分子之间的作用包括带负电荷的硫酸基与极性水分子之间产生的静电吸引作用和离子型氢键作用、电中性的醚基和羟基与水分子之间产生的氢键作用,这些作用都有利于κ-卡拉胶以溶液或溶胶形式存在。κ-卡拉胶离子链之间的作用包括疏水碳链或基团之间的疏水作用、羟基与羟基之间的氢键作用、羟基与醚基之间的氢键作用、带负电荷的硫酸基之间的静电排斥作用,前三种作用有利于凝胶的形成,而后一种作用不利于凝胶的形成。无机盐的加入改变了上述作用力的相对强弱,使作用力的总体情况有利于κ-卡拉胶离子链之间的相互吸引作用,从而促进了凝胶的形成。
2.1 促进κ-卡拉胶离子链之间的疏水作用
在κ-卡拉胶的水溶液或水溶胶中,κ-卡拉胶离子链上的硫酸基、羟基和醚基都会发生水合作用[14-15],比如,在室温下,没有形成分子内氢键的羟基的水合数约为5,醚基的水合数约为4[15]。水合作用有利于κ-卡拉胶以溶液或溶胶的形式稳定存在。向κ-卡拉胶的水溶液或水溶胶中加入无机盐后,无机盐离子和κ-卡拉胶离子链会发生水合作用竞争,无机盐的加入削弱了κ-卡拉胶离子链的水合作用。
在无机盐的水溶液中,由于离子和极性水分子之间的较强静电作用,水分子在离子外面定向,这些水分子会被束缚在离子周围,产生水合作用,减少了作为溶剂的自由水分子数[16-20]。离子水合作用有这样的基本趋势:(1)在所带电荷绝对值相同的情况下,由于阳离子的半径一般远小于阴离子的半径,因而阳离子的水合作用一般远强于阴离子;(2)所带电荷相同时,半径小的离子水合作用更强;(3)离子半径相近时,离子所带电荷越多,水合作用越强[21]。例如,对于碱金属离子,裸离子半径的顺序为Cs+>Rb+>K+>Na+>Li+,而水合离子半径的顺序则相反,Li+>Na+>K+>Rb+>Cs+。
向κ-卡拉胶的水溶液或水溶胶中加入无机盐后,无机盐离子,尤其是阳离子,会产生较强的水合作用[16],体系中自由水分子的数量减少,一部分原来和κ-卡拉胶离子链产生水合作用的水分子会发生转移。宏观上,κ-卡拉胶离子链的亲水性变差,水合程度降低,κ-卡拉胶离子链之间的疏水吸引作用增强,有利于离子链聚集和凝胶化。其它研究成果也证明,随着无机盐的加入,有机分子的水合程度降低,例如,LiCl、NaCl和KCl对Triton X-100(聚氧乙烯辛基苯基醚,C14H22O(C2H4O)n)水合作用影响的研究结果表明,随着电解质浓度的增加,水的有效浓度降低,Triton X-100的每个-C2H4O-基团拥有的水分子数减少,Triton X-100的水合程度降低[22]。另有研究结果表明,疏水作用在和与κ-卡拉胶离子链聚集有一定关联的吸附过程中发挥重要作用[23-26],无机盐浓度增大后,吸附质和吸附剂之间的疏水作用增强[16,27-28]。
2.2 促进κ-卡拉胶离子链之间的氢键作用
κ-卡拉胶离子链上的硫酸基、羟基和醚基都能和水分子之间产生氢键,κ-卡拉胶离子链之间也可以通过这些基团产生离子链之间的氢键。由于水分子产生氢键作用的能力很强[21],在有足够自由水分子的κ-卡拉胶溶液中,κ-卡拉胶离子链上的硫酸基、羟基和醚基易于与水分子之间形成氢键,这有利于κ-卡拉胶离子链在溶液中的分散和溶液的稳定。
向κ-卡拉胶的溶液中加入无机盐之后,由于无机阳离子与水分子之间的作用比κ-卡拉胶离子链上的硫酸基、羟基和醚基与水分子之间的作用都强,因而水分子优先与无机阳离子结合。同时,无机阴离子也会结合一定数量的水分子而水合,溶液中自由水分子的数量减少了,这有利于κ-卡拉胶离子链之间氢键的形成,有利于κ-卡拉胶离子链的聚集,有利于凝胶的形成。
2.3 削弱κ-卡拉胶离子链之间的静电排斥作用
在盐溶液中,存在离子和离子之间、离子和偶极子之间(水分子即为偶极子)以及偶极子和偶极子之间的相互作用。以r表示两个粒子之间的距离,离子和离子之间、离子和偶极子之间以及偶极子和偶极子之间的相互作用与r之间的关系分别为r-1、r-2和r-3的关系[17]。因而,一般来说,在盐溶液中,带电荷的离子之间的静电作用最强,其次是离子(尤其是阳离子)和极性水分子之间的水合作用(本质也是静电作用),最后是氢键作用。
在κ-卡拉胶的水溶液或水溶胶中,κ-卡拉胶离子链之间带负电荷的硫酸根之间的静电排斥作用,对于防止κ-卡拉胶离子链之间的结合,抑制凝胶化起了关键作用。在κ-卡拉胶的水溶液或水溶胶中加入盐,阳离子就会部分中和与屏蔽κ-卡拉胶离子链上硫酸根的负电荷,削弱静电排斥作用[3,10,29-30],使得κ-卡拉胶离子链在疏水和氢键的双重下作用,发生聚集。阳离子还有可能起到离子链内(图3[12])和离子链间(图4[7])离子桥的作用,进一步促进κ-卡拉胶离子链聚集,促进凝胶化。

图3 κ-卡拉胶离子链内K+离子桥示意图[12]Fig.3 Schematic diagram of K+ ion bridge in κ-carrageenan ion chain
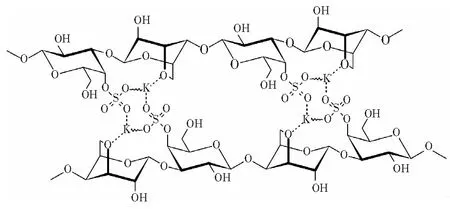
图4 κ-卡拉胶离子链间K+离子桥示意图[7]Fig.4 Schematic diagram of K+ ion bridge between κ-carrageenan ion chains
碱金属阳离子的促凝胶化能力顺序为Rb+>Cs+>K+>Na+>Li+[12],该顺序的总趋势与这些阳离子的水合作用相反,碱金属水合离子半径由大到小的顺序为Li+>Na+>K+>Rb+>Cs+。碱金属离子平衡κ-卡拉胶离子链上硫酸根的负电荷时,很可能是以水合离子的形式平衡负电荷的,形成离子桥时,也可能是带着部分或全部水合水。在这样的情况下,水合能力差的Rb+和Cs+,由于水合离子半径小,更容易接近硫酸根,中和或屏蔽负电荷的能力更强,促进凝胶化的作用更大。另一种可能是,Rb+和Cs+的水合作用弱,水合能低,其水合层中的水分子容易被硫酸根和醚基置换,因而更容易接近硫酸根,更容易形成离子桥。
3 结束语
作为三大海藻胶之一,具有良好的生物相容性、可生物降解性、高保水性、凝胶特性等,卡拉胶被广泛用作食品、化妆品、药品等的凝胶剂、稳定剂、增稠剂、乳化剂、分散剂等。在所有类型的卡拉胶中,κ-卡拉胶具有较好的亲和性、分散性、持水性等,容易形成螺旋结构,因而更受关注。
因具有亲水性的硫酸基、醚基与羟基,κ-卡拉胶能溶于热水中,其钠盐也能溶于冷水中。κ-卡拉胶在中性和碱性介质中很稳定,即使加热也不易水解。但在酸性介质中,尤其在pH值4以下的酸性介质中,容易发生酸水解。
一般认为κ-卡拉胶的凝胶化涉及两个过程:线团到螺旋;聚集到凝胶。无机阳离子的存在对凝胶形成有明显的促进作用。向κ-卡拉胶溶液中加入无机盐后,无机阳离子会产生较强的水合作用,降低了自由水分子的数量,削弱了κ-卡拉胶离子链与水分子之间的静电作用和氢键作用,促进了κ-卡拉胶离子链之间的疏水作用和氢键作用。更重要的是,有些阳离子可以在κ-卡拉胶离子链内或离子链间形成离子桥,平衡和屏蔽了κ-卡拉胶离子链上硫酸根的负电荷,削弱了κ-卡拉胶离子链之间的静电排斥作用,促进了κ-卡拉胶离子链之间的结合与凝胶的形成。
由于难于分离提取出纯的κ-卡拉胶,这给其性质和凝胶化机理研究造成了一定的困难。不同金属离子对κ-卡拉胶凝胶化的促进作用存在差别,对这些差别,尤其是细微差别还缺乏深入的了解,对相关过程机理的认识也还不够充分。随着κ-卡拉胶应用领域的不断拓展和应用的精细化,对其分离提纯会提出更高的要求,对其凝胶化过程机理的认识也会不断深入。
