动态对比增强磁共振成像纹理分析评估胶质瘤IDH1突变与瘤细胞增殖
2021-08-25汪洁包善磊贾中正陈悦胡月沈丹丹
汪洁,包善磊,贾中正,陈悦,胡月,沈丹丹
南通大学附属医院医学影像科,江苏 南通 226001;*通信作者 贾中正 jzz2397@163.com
胶质瘤是颅内最常见的原发恶性肿瘤,2016年WHO中枢神经系统肿瘤分类首次引入异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)作为胶质瘤分类标准之一[1]。与IDH野生型胶质瘤相比,IDH突变型胶质瘤患者生存时间较长,对放化疗敏感性更高[2]。Ki-67增殖指数与胶质瘤的分化程度、分子状态、患者生存率均关系密切[3]。胶质瘤IDH突变及Ki-67增殖指数的明确诊断均需提取组织标本进行病理检测。因此,术前无创评估胶质瘤的IDH基因分型及Ki-67增殖指数,对患者预后评估和制定治疗方案均具有重要价值。MRI是术前诊断胶质瘤最常用的方法,但常规MRI提供的价值有限,动态对比增强MRI(DCE-MRI)可以定量评估胶质瘤的微血管通透性、微血管密度与肿瘤细胞增殖[4-6]。纹理分析作为一种非侵入性影像组学技术,可以量化图像的像素强度及分布,显示肉眼无法识别的特征[7]。目前,已有研究发现DCE-MRI纹理分析可用于胶质瘤分级与预测IDH基因分型[8-9],但提取分析的纹理特征较少。本研究拟应用DCE-MRI纹理分析提取更多纹理特征,分析其评估胶质瘤IDH1突变与Ki-67增殖指数的价值。
1 资料与方法
1.1 研究对象 收集2017年1月—2020年3月南通大学附属医院收治的经病理证实的胶质瘤52例,根据2016版WHO胶质瘤分类标准,其中IDH1突变型17例,男8例,女9例,年龄28~74岁,平均(49±13)岁;IDH1野生型35例,男20例,女15例,年龄22~75岁,平均(59±13)岁。52例患者中,Ⅱ级13例、Ⅲ级3例、Ⅳ级36例。所有患者DCE-MRI检查前与手术前均未接受任何治疗。DCE-MRI检查与手术间隔时间不超过1周。本研究经南通大学附属医院医学伦理委员会批准(批准号2020-L069),所有患者均签署知情同意书。
1.2 MRI检查 每例患者术前行常规MRI和DCE-MRI检查,采用GE Signal 750W 3.0T MRI扫描仪,使用16通道相控阵头颅线圈。常规MRI扫描包括横断面T2WI(TR 3 900 ms,TE 118 ms)、T1WI(TR 1 780 ms,TE 24 ms)、T2-FLAIR(TR 8 002 ms,TE 171 ms),视野240 mm×240 mm,矩阵256×256。DCE-MRI检查:横断面扫描5组T1-fast field echo(T1-FFE;RF-spoiled gradient echo)多翻转角序列,5组翻转角分别为3°、6°、9°、12°、15°,扫描参数:TR 6.9 ms,TE 1.4 ms,层厚2.8 mm,层间距1.4 mm,矩阵256×210;视野250 mm×175 mm。在5组翻转角信号采集结束后进行DCE序列扫描,扫描翻转角为12°,其余参数同多翻转角扫描序列,在第5次信号采集结束后采用高压注射器经肘静脉注射对比剂钆双胺,速度4 ml/s,剂量0.1 mmol/kg,然后以4 ml/s注入生理盐水10 ml冲洗,单次扫描时间7 s,扫描总时间7 min。
1.3 数据分析 将所有患者的DCE-MRI原始数据导入3D Slicer(4.10.2版本)软件,在上矢状窦设置感兴趣区(ROI),用PkModeling模块生成容积转运常数(Ktrans)、血管外细胞外间隙容积分数(Ve)参数图。由2名经验丰富的神经影像医师采用盲法共同阅片,讨论达成一致意见后对肿瘤进行分割。应用Segment Editor模块半自动勾画全肿瘤体积,包括肿瘤囊变、坏死、出血等所有瘤体内部信息,但不包括瘤周水肿(图1)。应用软件的Radiomics模块自动对Ktrans、Ve参数图各提取107个纹理特征,包括18个一阶特征、14个形状特征、14个灰度依赖矩阵(gray level dependence matrix,GLDM)特征、24 个灰度共生矩阵(gray level cooccurence matrix,GLCM)特征、16个灰度游程矩阵(gray level run length matrix,GLRLM)特征、16个灰度区域大小矩阵(gray level size zone matrix,GLSZM)特征及5个邻域灰度差矩阵(neighbouring gray tone difference matrix,NGTDM)特征。
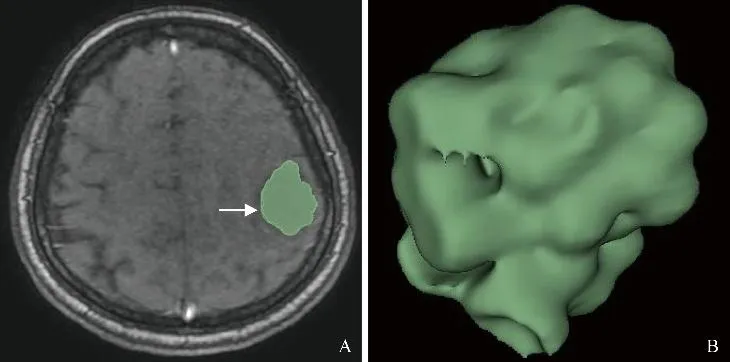
图1 胶质瘤范围选取方法。参照T1WI增强及T2-FLAIR图像,对DCE-MRI原始图像沿肿瘤边缘(箭,A)进行单层ROI勾画,Ktrans、Ve图自动生成相同ROI,软件根据勾画范围识别临近层面肿瘤范围,仔细逐层修改、确定肿瘤边界,最终生成全瘤ROI(B)
1.4 免疫组化检测
1.4.1 IDH1检测 肿瘤标本用4%中性甲醛溶液固定,石蜡包埋,4 μm厚切片,进行脱蜡、抗原修复后,采用IDH1R132H单克隆抗体(1∶50;福州迈新生物技术开发有限公司)对标本进行染色,选取染色热区判断染色结果。如果视野中≥10%的肿瘤细胞核被染成棕褐色,认为IDH1R132H 阳性;反之,认为IDH1R132H阴性[10]。在热区选取3次进行测量,计算平均值作为最终测量结果。
1.4.2 Ki-67增殖指数测算方法 采用Ki-67抗体(1∶100,Abcam公司),应用EnVision方法(Dako公司)进行免疫组化染色。选取染色热区,以细胞核中出现棕黄色颗粒为阳性细胞,不包括坏死和血管内皮细胞,计算阳性着色面积占图像总面积的百分比。Ki-67增殖指数指胶质瘤细胞中染色密度最高的区域中每500~1 000个细胞中的阳性细胞核的百分比,在热区选取3次进行测量,计算平均值作为最终测量结果。
1.5 统计学方法 采用SPSS 26.0软件,定量资料符合正态分布时,采用独立样本t检验;不符合正态分布的定量资料采用Mann-WhitneyU检验。对存在统计学差异的纹理特征绘制受试者工作特征(ROC)曲线,并按曲线下面积(AUC)对其排序,AUC≥0.85的特征参数获得鉴别诊断的切峰值及敏感度、特异度。应用Spearman相关系数评估胶质瘤纹理特征参数与Ki-67增殖指数的相关性。P<0.05为差异有统计学意义。
2 结果
2.1IDH1突变型与IDH1野生型胶质瘤DCE-MRI参数图纹理特征比较与ROC曲线分析 在所有差异有统计学意义(P<0.05)且AUC≥0.85的纹理特征中,IDH1突变型胶质瘤特征值均小于野生型(表1)。Ktrans的纹理特征均具有较好的诊断效能,AUC 为0.852~0.896,其中Ktrans的GLCM-聚类趋势AUC最高,为0.896,敏感度为82.9%,特异度为88.2%。Ve的GLCM-联合均值及GLCM-平方和的AUC最高,均为0.852,敏感度均为88.6%,特异度均为76.5%,见表1、图2。
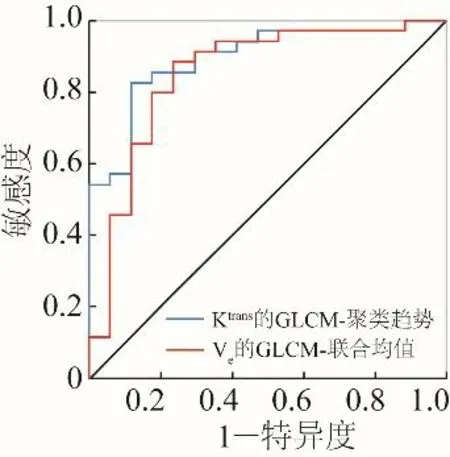
图2 DCE-MRI纹理特征鉴别IDH1突变型与IDH1野生型胶质瘤的ROC曲线
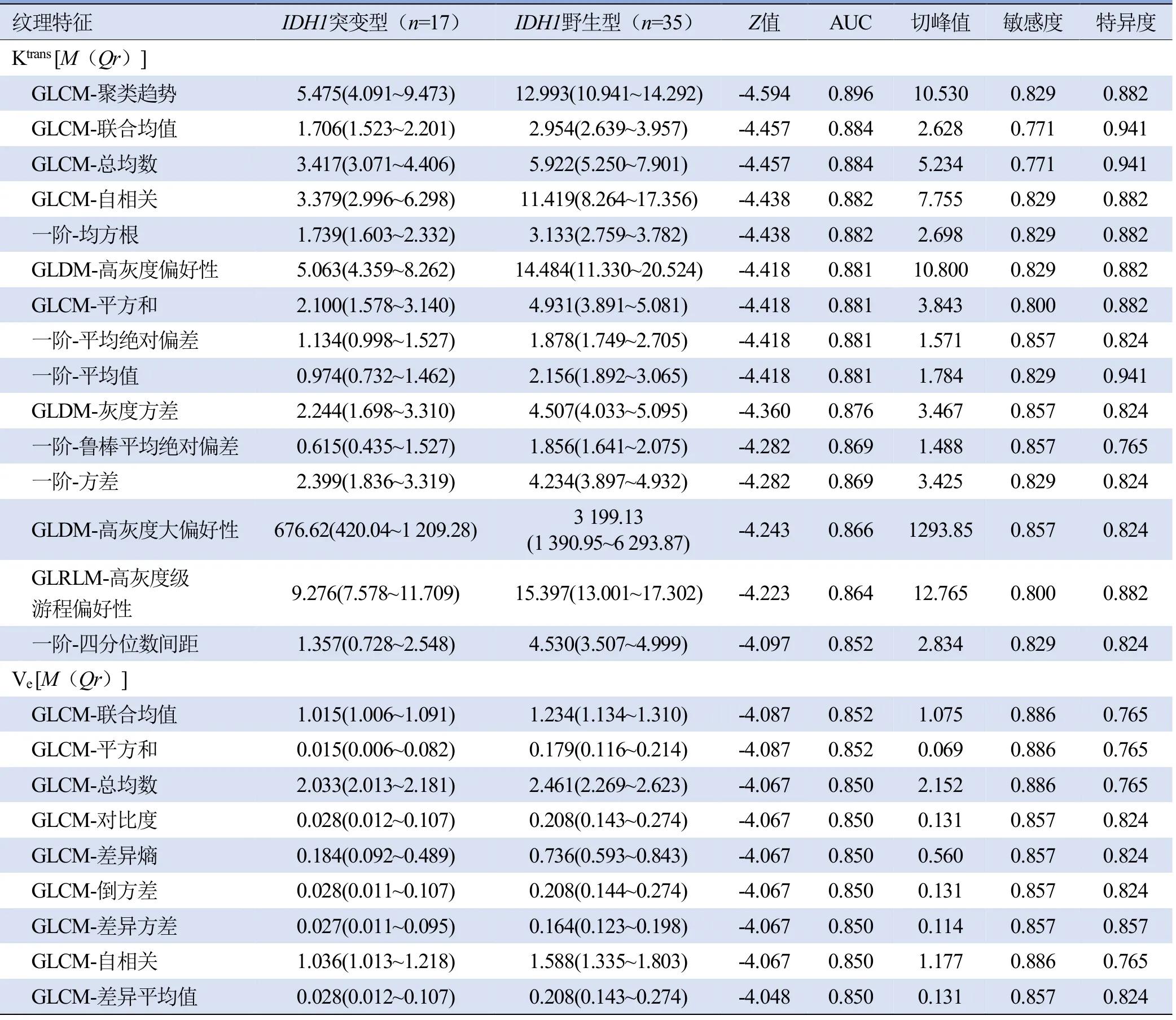
表1 IDH1突变型与野生型胶质瘤DCE-MRI纹理特征比较及ROC曲线分析
2.2 胶质瘤DCE-MRI参数图纹理特征与Ki-67增殖指数的相关性IDH1突变型胶质瘤的Ki-67增殖指数低于野生型(图3、4),差异有统计学意义(Z=-2.962,P=0.003)。所有AUC≥0.85的纹理特征均与Ki-67增殖指数呈正相关(r=0.307~0.535,P<0.05)。其中,Ktrans的GLDM-高灰度大偏好性的相关性最高(r=0.535,P<0.001),其次为Ve的GLCM-自相关(r=0.508,P<0.001)。
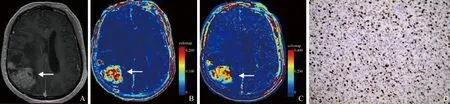
图3 女,41岁,IDH1突变型胶质瘤。T1WI增强示肿瘤呈不均匀明显强化(箭),内见大片囊变坏死(A);Ktrans、Ve图示肿瘤实质信号明显增高(箭,B、C);免疫组化染色示Ki-67增殖指数约40%(×200,D)
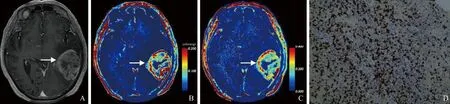
图4 男,75岁,IDH1野生型胶质瘤。T1WI增强示肿瘤呈不均匀明显强化(箭,A);Ktrans、Ve图示肿瘤信号明显增高(箭,B、C);免疫组化染色示Ki-67增殖指数约70%(×200,D)
3 讨论
3.1 DCE-MRI纹理特征评估胶质瘤IDH1突变的价值既往研究发现,肿瘤的异质性越高,其侵袭性、耐药性越强[11],因此术前评估肿瘤的异质性非常重要。MRI纹理分析是一种定量评估宏观组织异质性的非侵入性方法[12],可以更好地预测肿瘤生物学行为。目前常规MRI纹理分析已用于脑胶质瘤分级、鉴别诊断、基因表型和总生存率预测[13-15]。但MRI常规序列提供的信息较少。本研究通过提取DCE-MRI定量参数的特征反映胶质瘤微血管的异质性特征,进而分析IDH1不同基因分型的差异。前期研究主要采用“热点法”手动放置ROI于肿瘤强化显著的区域,不能真正反映肿瘤的异质性。本研究采取对肿瘤进行三维勾画的方法提取肿瘤的多重纹理特征,ROI覆盖整个肿瘤体积,可以更深入地分析肿瘤的异质性,并且具有更好的可重复性。本研究的DCE-MRI纹理特征中,Ktrans的GLCM-聚类趋势对胶质瘤IDH1基因分型的鉴别效能最高。聚类趋势是用于量化共生矩阵聚类程度的指标,它倾向于强调没有任何规律模式的区域[16],本研究提示野生型胶质瘤结构复杂程度高、异质性强。目前,DCE-MRI聚类趋势在胶质瘤中的应用鲜有报道。Yue等[17]研究发现,胰腺癌患者放射治疗在很大程度上抑制了原发肿瘤的代谢活动,并降低了肿瘤潜在的组织异质性,聚类趋势直方图左移,与本研究结论类似。熵是一个最常用的纹理特征,反映图像灰度分布复杂程度,值越大,表示纹理规律性越差、异质性越强[8]。本研究中IDH1野生组Ve的GLCM-差异熵明显大于突变组,提示IDH1野生型胶质瘤图像灰度分布的异质性明显高于突变型。然而Ktrans的GLCM-聚类趋势鉴别IDH1突变型胶质瘤与野生型胶质瘤AUC更大,敏感度和特异度更高。但聚类趋势没有像熵那样被广泛采用,其原因可能是以往研究的纹理特征较少,局限于GLCM的少数特征,而本研究纳入的特征范围较广。既往研究发现形态学特征、一阶特征可以显示肿瘤的整体信息[18-19],二阶特征预测肿瘤基因型的准确率较高[7],有助于评价肿瘤的异质性[20],但仅GLCM部分特征所反映的肿瘤异质性信息有限;因此,本研究认为对于评价胶质瘤异质性,DCE-MRI参数图多阶纹理分析价值更大。本研究表明Ktrans纹理特征对于预测胶质瘤IDH1基因突变具有更大的价值,与Su等[21]的研究结果一致。
3.2 DCE-MRI纹理特征评估胶质瘤细胞增殖的价值本研究显示,IDH1突变型胶质瘤的Ki-67增殖指数低于野生型,表明IDH1突变型胶质瘤细胞增殖相对较少,提示IDH1突变型胶质瘤侵袭性较低、预后较好,与既往研究结果一致[22]。Su等[15]研究发现:胶质瘤MRI常规序列的部分纹理特征与Ki-67增殖指数相关。Jiang等[4]研究发现:胶质瘤DCE-MRI定量参数中Ktrans、Ve值与Ki-67增殖指数呈正相关。本研究中,Ktrans的GLDM-高灰度大偏好性及Ve的GLCM-自相关与Ki-67增殖指数均明显相关,Ktrans与Ve主要反映胶质瘤微血管壁的成熟程度及通透性,因此本研究提示胶质瘤微血管壁通透性程度与肿瘤细胞增殖程度关系密切,IDH1突变型胶质瘤的肿瘤微血管及肿瘤细胞异质性均低于IDH1野生型。
3.3 本研究的局限性 本研究样本量较小,尤其是IDH1突变型胶质瘤较少,在后期的研究中需要扩大样本量进一步验证本研究结果;由于缺乏基因测序技术,本研究未进行IDH2检测。尽管胶质瘤中IDH2突变的频率很低,用于检测IDH1突变的免疫组化技术代表了胶质瘤中IDH突变的绝大部分,但在以后的研究中会采用基因测序技术进行更准确的验证。
总之,DCE-MRI纹理分析可以评估胶质瘤微血管的异质性特征,在评估胶质瘤IDH1突变与肿瘤细胞增殖方面具有重要的参考价值。
