基于DWI的影像组学对急性缺血性卒中患者功能结局的预测
2021-08-25孙祎王浩朱杰张远宋彬
孙祎,王浩,朱杰,张远,宋彬
复旦大学附属闵行医院 上海市闵行区中心医院放射科,上海 201100;*通信作者 宋彬 sb72778@189.cn
卒中是全球人群死亡和残疾的主要原因之一[1],是目前中国居民的第一大死亡原因[2]。急性缺血性卒中(acute ischemic stroke,AIS)约占卒中的80%[3],AIS患者的康复是一个长期的过程,也是我国沉重的健康负担。预测AIS患者的功能结局,有利于判断患者的恢复潜能,可帮助优化患者管理并制定个体化的治疗及康复策略。
MRI已广泛用于卒中诊断,扩散加权成像(DWI)的表观扩散系数(ADC)可描述组织的扩散特征,AIS病灶区域的ADC值与临床功能结局显著相关[4]。然而,ADC值仅代表感兴趣区的平均值,并不能代表整个梗死病灶的特征。影像组学是影像学领域的一种新兴方法,该技术将影像学和人工智能相结合,可从图像上高通量提取定量特征,目前已经应用于预测肿瘤预后及评估治疗效果等[5-7]。一项基于DWI及灌注加权成像(perfusion weighted imaging,PWI)测定缺血半暗带的研究报道,缺血半暗带的影像组学特征是评估AIS患者临床结局的独立预测因子[8]。然而目前PWI序列的临床普及程度远不如DWI。本研究拟建立基于DWI影像组学特征的AIS预后的预测模型,并评估其预测价值,为AIS治疗决策提供依据。
1 资料与方法
1.1 研究对象 回顾性分析2018年1月—2019年12月在我院诊断为AIS的患者的临床及影像学资料,纳入标准:①首发AIS;②入院后48 h内完成MRI检查;③年龄≥18岁;④签署知情同意书。排除标准:①脑出血;②创伤性脑损伤;③既往神经或精神疾病;④药物滥用史;⑤脑萎缩;⑥MR图像存在明显伪影。采用分层抽样法,将患者按7∶3随机分配至训练组及验证组。本研究经上海市闵行区中心医院伦理委员会批准(批准号2020-017-01K),所有患者均签署知情同意书。
1.2 临床资料收集 记录患者人口学特征、临床和影像学数据,包括年龄、性别、血压、血糖、梗死后出血、入院时基线美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)评分(NIHSS基线)、入院后24 h NIHSS评分(NIHSS24h)[9]和90 d改良Rankin量表(modified Rankin scale,mRS)
评分[10]。采用mRS评分作为预后判断指标,预后良好定义为mRS评分0、1、2分,预后不良定义为mRS评分3、4、5分[10]。
1.3 MRI采集 采用GE EXCITE HD 1.5T MR扫描仪,标准16通道头颈部线圈,进行头颅MR扫描。扫描参数,①T1WI:TR 2 259 ms,TE 25.4 ms,层厚5 mm,间距1.5 mm,视野(FOV)240 mm×240 mm,矩阵256×192;②T2WI:TR 5 582 ms,TE 111 ms,层厚5 mm,间距1.5 mm,FOV 240 mm×240 mm,矩阵256×192;③T2-液体衰减反转恢复序列:TR 8 589 ms,TE 88.8 ms,层厚5 mm,间距1.5 mm,FOV 240 mm×240 mm,矩阵256×192;④DWI:TR 3 203 ms,TE 83.9 ms,层厚5 mm,间距1.5 mm,FOV 240 mm×240 mm,b值取0和1 000 s/mm2,矩阵96×96。
1.4 梗死病灶分割 由2名分别具有6年和12年神经MR诊断经验的影像科医师采用盲法分别独立完成图像分析。使用ITK-SNAP软件(http://www.itk-snap.org),在DWI图像上手动逐层勾画急性缺血性病灶的感兴趣区(ROI)。并随机选取30例经图像分割后提取影像学特征,计算观察者组间和组内相关系数(ICC)。ICC>0.75表示信度良好,并由该名医师完成其余入组图像分割。
1.5 特征提取 使用Artificial Intelligent Kit,A.K.应用平台,提取402个特征,包括42个直方图特征、11个灰度区域大小矩阵(grey-level size zone matrix,GLSZM)特征、15个形态学特征(包括梗死体积)、154个灰度共生矩阵(gray-level co-occurrence matrix,GLCM)特征和180个灰度游程矩阵(gray-level run length matrix,RLM)特征。
1.6 少数群体过度抽样 采用合成少数类过采样技术(synthetic minority over-sampling technique,SMOTE)对不平衡数据进行预处理,通过增加人工合成的少数样本降低随机过采样的过拟合可能性[11]。
1.7 特征选择、影像组学评分、临床模型和列线图的验证 使用R 3.5.1(http://www.r-project.org)进行特征选择及生成列线图。采用最大相关最小冗余(maximal relevanceand minimal redundancy,mRMR)算法进行特征选择;然后采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法进一步选择最优特征子集,并采用十折交叉验证法进行验证,构建影像组学评分。
使用单因素Logistic回归分析筛选预后相关的临床因素(P<0.05),建立相应的临床模型。然后结合临床因素和影像组学评分,通过多因素Logistic回归分析建立复合模型,并绘制临床-影像组学列线图。通过受试者工作特征(ROC)曲线下面积(AUC)评价列线图的预测效能。最后,使用决策曲线分析(decision curve analysis,DCA)计算训练组和验证组中阈值概率范围的净受益,以评估列线图的临床应用价值。
1.8 统计学方法 计数资料比较采用χ2检验,计量资料比较采用独立样本t检验。采用mRMRe包中的mRMR算法过滤具有高相关性和无冗余的辐射特征。采用Glmnet软件包中的LASSO Logistic回归选择最佳特征子集,构建影像组学模型。采用pROC包绘制ROC曲线。采用dca.R包绘制DCA曲线。采用ModeGood包绘制校准曲线,采用Hosmer-Lemeshow检验分析拟合优度。采用Delong检验评价模型间AUC的差异。P<0.05为差异有统计学意义。
2 结果
2.1 人口统计学和临床特征 共纳入409例形成研究队列,其中328例(80.2%)预后良好,81例(19.8%)预后不良。训练组和验证组中,良好和不良功能结局患者梗死后出血差异均有统计学意义,训练组中两种结局患者的年龄差异有统计学意义(P<0.05),见表1。
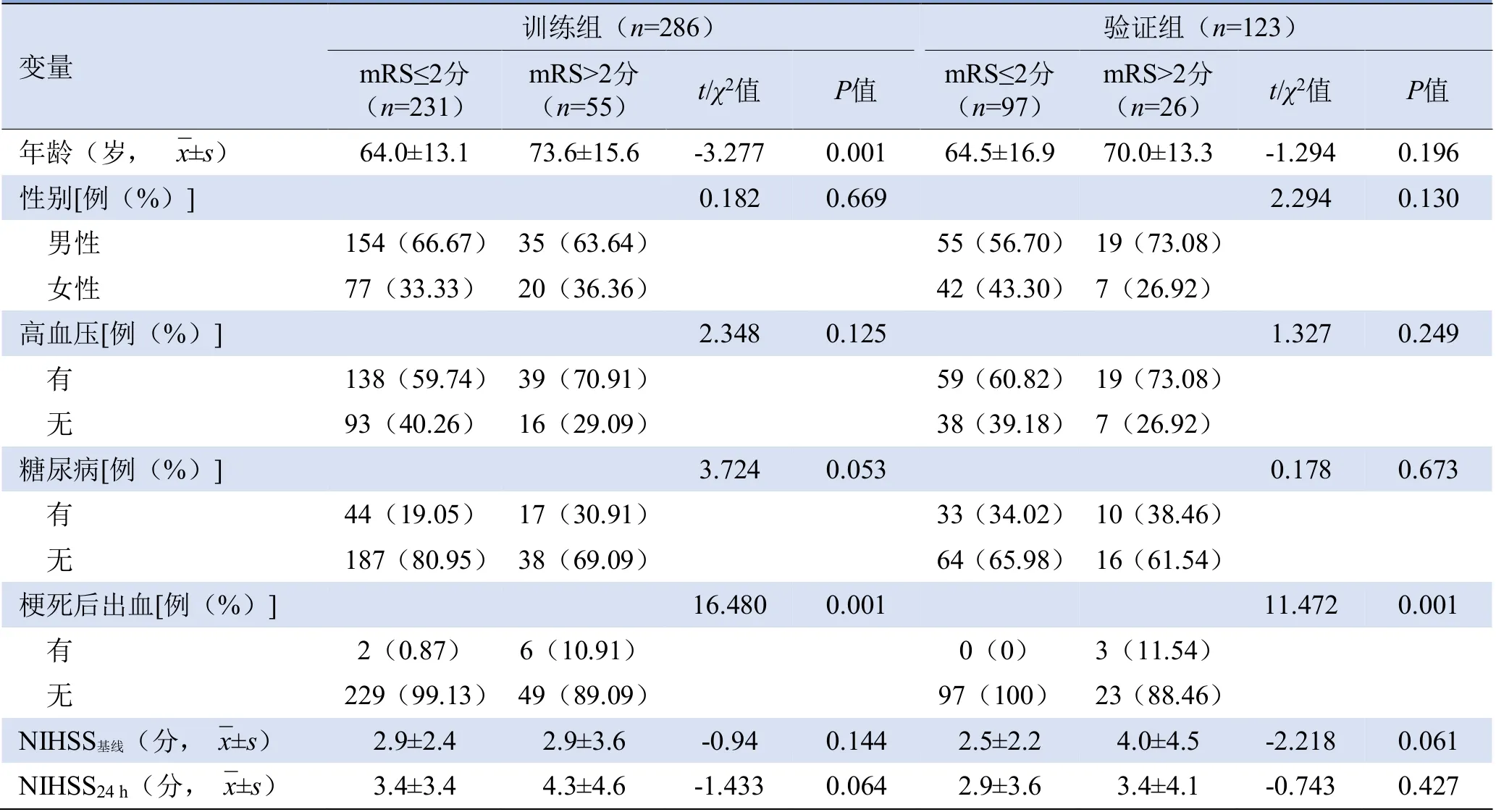
表1 训练组和验证组的临床资料
2.2 单因素Logistic回归分析结果 纳入分析的临床因素包括性别、年龄、高血压、糖尿病、梗死后出血、NIHSS基线、NIHSS24h,经单因素Logistic回归分析显示,年龄(OR=1.057,P=0.002)及梗死后出血(OR=0.07,P=0.024)在预后良好及预后不良患者间差异有统计学意义。
2.3 影像组学特征预测AIS临床功能结局的效能最终于训练组中选择16个具有非零系数的影像组学特征(图1A~C)。结局较差患者的影像组学评分高于结局良好患者,差异有统计学意义(P<0.005),见图1D。绘制ROC曲线评价影像组学评分预测良好和较差临床功能结局的准确性,在训练组和验证组中的AUC分别为0.79(95%CI0.70~0.87,P<0.01)和0.84(95%CI0.71~0.98,P<0.01),见图2。

图1 使用LASSO算法选择影像组学特征和影像组学特征的预测准确性。A.LASSO模型中的调节参数(λ)的选择;B.非零系数与¬调节参数(λ);C.最终保留的非零系数特征;D.训练组和验证组中的影像组学评分分布

图2 使用ROC曲线评价影像组学模型预测AIS临床功能结局的准确性。A为训练组的ROC曲线;B为验证组的ROC曲线
2.4 临床预测模型建立 构建包含影像组学评分和临床特征(包括年龄、梗死后出血)预测因子的临床-影像组学列线图(图3A)。训练组和验证组中列线图的校准曲线见图3B、C。非显著性Hosmer-Lemeshow检验显示训练组和验证组的拟合优度检验差异无统计学意义(P>0.05),表明未偏离拟合。ROC曲线显示,训练组和验证组列线图的AUC均高于影像组学模型及临床模型(图4)。
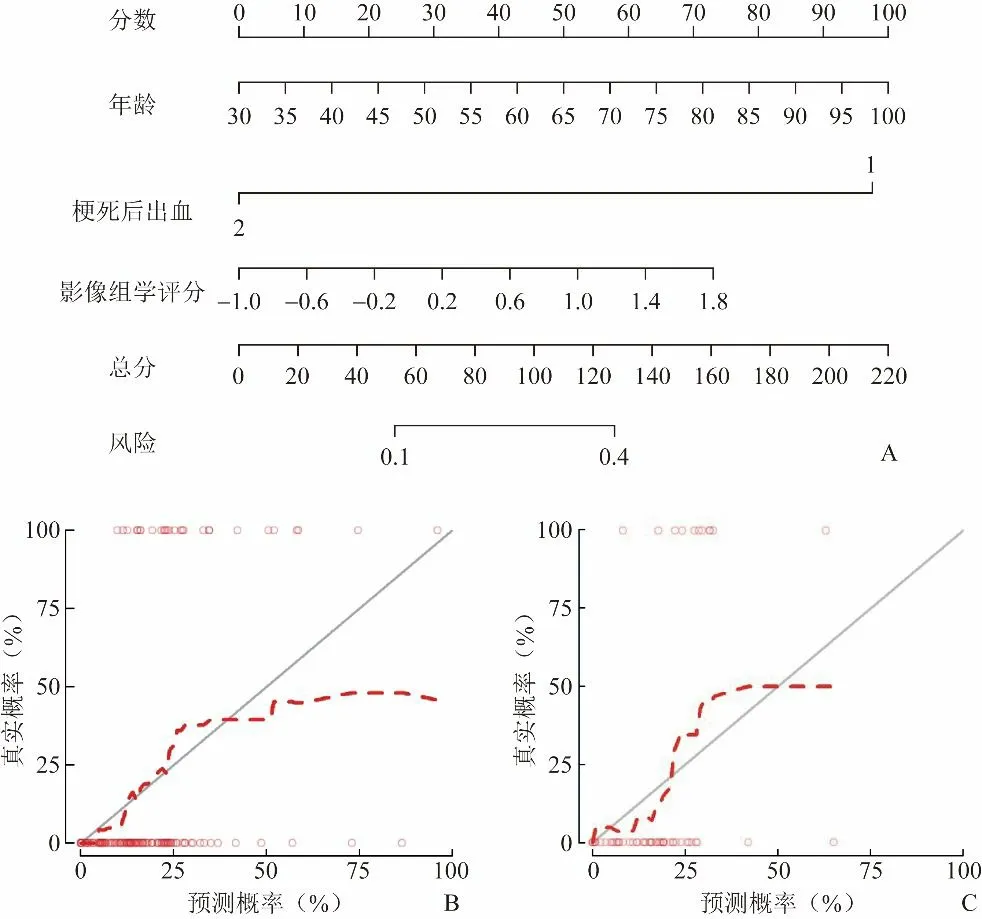
图3 用于预测AIS临床功能结局的临床-影像组学列线图(A),及其在训练组(B)和验证组(C)的校准曲线
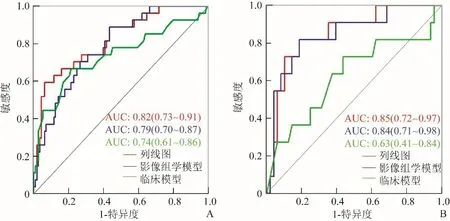
图4 ROC曲线评价3种模型预测AIS临床功能结局的准确性。A为训练组的ROC曲线;B为验证组的ROC曲线
影像组学模型、临床模型和列线图的准确度、敏感度、特异度、阳性预测值和阴性预测值显示,列线图的预测性能优于影像组学模型和临床模型(表2)。
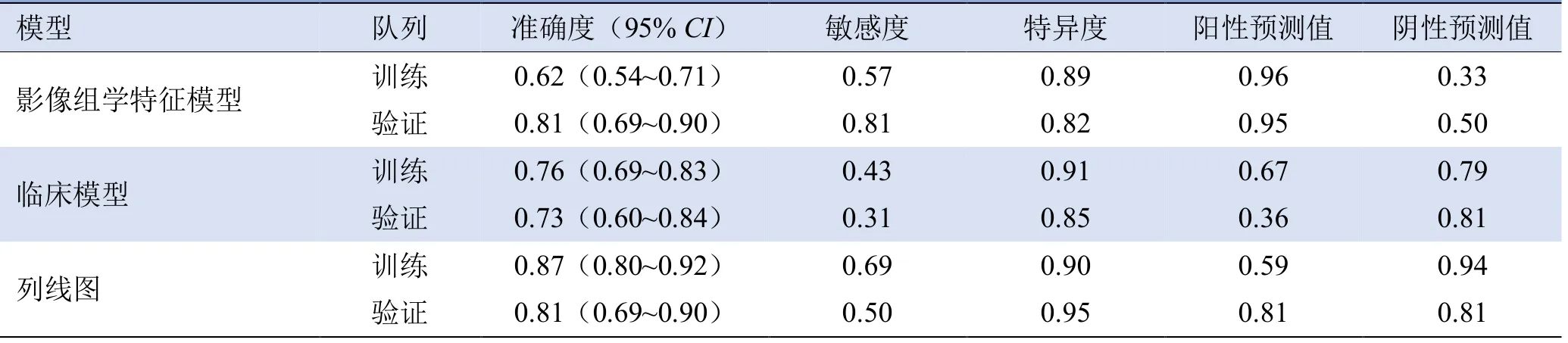
表2 3种模型预测AIS临床功能结局的效能
列线图的DCA见图5,表明当高风险阈值概率约在0.05~0.55时,列线图的净受益率高于其他模型。

图5 基于影像组学评分和列线图的决策曲线分析
3 讨论
本研究基于DWI序列提取影像组学特征,并与临床特征(年龄、梗死后出血)相结合,构建影像组学列线图,结果表明列线图预测AIS患者的临床功能结局方面具有良好的性能。
影像组学能够将医学图像转化为定量数据,并高通量提取影像组学定量特征,可全面挖掘病灶的内部特征,提供肉眼不可见的微观信息。但鲜有报道使用影像组学研究AIS的功能结局,本研究是少数关注基于影像组学预测AIS患者临床功能结局的研究之一。AIS患者发生神经系统和躯体症状并发症的概率较高,这些并发症会增加临床不良结局的风险。及时有效的诊断不仅有助于确定治疗方案,而且有助于预后评估。本研究结果有望成为一种评价AIS患者个体化预后的新方法。
DWI反映了组织内水分子的随机布朗运动,脑缺血时水分子从细胞外向细胞内移动,细胞外水量减少,水分子扩散下降使DWI信号增高[12]。DWI的ADC变化与AIS的出血转化与功能结局相关[13-14]。一项研究表明,基底动脉闭塞患者ADC与mRS评分呈负相关[15]。因此本研究选取DWI图像提取影像组学特征建立模型,在训练组和验证组中的AUC分别为0.79和0.84,提示对AIS的功能结局有良好的预测效能。
同时,本研究发现仅通过病灶的影像组学特征预测功能结局不够,因为除病灶本身的影像学特征外,还有多种临床因素可能与功能结局相关。既往研究指出,年龄、既往卒中史、早期神经功能障碍和病变部位等与卒中功能结局显著相关[16]。此外,也有研究表明,梗死后出血是AIS患者3个月内死亡的独立危险因素[17]。本研究显示梗死后出血、年龄在预后良好及不良组间有显著差异,与既往研究相符。此外,本研究将临床因素及影像组学特征结合建立列线图预测模型,该模型的预测性能优于影像组学模型和临床模型,并在验证组得到验证。
本研究存在一定的局限性。首先,本研究为单中心回顾性研究,存在选择偏倚,且采用内部验证,有待进行多中心、大样本量研究进一步验证模型的预测效能。其次,本研究未对梗死的病因及部位进行区分。再次,3种模型具有高特异度,但敏感度不高,可能与大多数患者(80.2%)具有良好的功能结局有关。
总之,本研究为预测AIS的预后提供了新的线索,基于DWI的影像组学可以准确预测AIS的临床功能结局。
