术前MRI语义特征预测颅内Ⅱ~Ⅲ级孤立性纤维瘤/血管外皮细胞瘤术后肿瘤进展的价值
2021-08-25张斌李昇霖张鹏王艺格韩涛林晓强景梦园邓靓娜周俊林
张斌,李昇霖,张鹏,王艺格,韩涛,林晓强,景梦园,邓靓娜,周俊林*
1.兰州大学第二医院放射科,兰州大学第二临床医学院,甘肃省医学影像重点实验室,甘肃 兰州 730030;2.兰州大学第二医院病理科,甘肃 兰州 730030;3.兰州大学公共卫生学院,甘肃 兰州 730000;*通信作者 周俊林 E-mail:lzuzjl601.163.com
颅内血管外皮细胞瘤(hemangiopericytoma,HPC)起源于脑膜间质毛细血管Zimmerman细胞,约占颅内肿瘤的1%[1]。根据2016版WHO中枢神经系统肿瘤分类,孤立性纤维瘤/血管外皮细胞瘤(solitary fibrous tumor/hemangiopericytoma,SFT/HPC)划分为3个等级,本研究仅包括Ⅱ~Ⅲ级SFT/HPC,即过去诊断的HPC和间变型血管周细胞瘤(anaplastic hemangiopericytoma,AHPC)(下文统称HPC,使用Ⅱ级或Ⅲ级进行区分)[2]。临床通常采取外科手术全切治疗,因其具有明显的侵袭性,术后可能发生原位复发或颅外转移,会大大降低患者的总生存率[3]。因此,早期预测HPC术后复发、转移的相关危险因素尤为重要。既往研究发现:HPC术后肿瘤的病理级别、手术方式、术后放疗[4]与术后肿瘤进展存在密切关系,但目前相关的肿瘤术后进展预测因素仅能在术后获得,通过术前MRI语义特征,即影像医师对图像主观解释的特征,可能对HPC临床制定治疗方案具有重要的实践意义[5-6]。本研究拟利用HPC患者术前MRI构建预测肿瘤术后进展的Cox多因素模型,以确定HPC患者术前MRI与肿瘤复发、转移的最相关特征。
1 资料与方法
1.1 研究对象 回顾性分析2010年10月—2017年10月兰州大学第二医院手术病理证实的42例颅内血管外皮细胞瘤的术前MRI及临床资料,并以影像学方法和电话方式连续随访,患者术后复发、转移或死亡定义为随访的终点事件;无进展生存期(progress free survival,PFS)定义为自肿瘤完全切除至肿瘤出现原位复发和(或)远处转移的时间;HPC术后的复发、转移定义为肿瘤进展,反之则为肿瘤无进展。
纳入标准:①具有完整的术前MRI图像;②初次手术达到肿瘤完全或次全切除(术后72 h内头颅MRI增强未见病灶区异常强化,或临床手术记录肿瘤切除程度达到Simpson I~Ⅲ级[7-8]);③随访资料完整;④颅外转移需有充足的影像资料或病理报告。
排除标准:①术前接受放疗;②颅内HPC由穿刺病理确诊;③缺乏随访资料;④术前MRI图像不完整。最终纳入37例Ⅱ~Ⅲ级HPC,其中WHO分级HPC Ⅱ级15例,Ⅲ级22例;肿瘤进展组16例,包括11例复发不合并颅外转移、1例仅颅外转移、4例颅内复发合并颅外转移,肿瘤无进展组21例。本研究经兰州大学第二医院医学伦理委员会批准(批准号:2020A-070),免除受试者知情同意。
1.2 仪器与方法 采用Siemens Verio 3.0T超导型MR扫描仪,平扫序列包括轴位/矢状位SE-T1WI(ITR 550 ms、TE 12 ms)、轴位FSE-T2WI(TR 2 200 ms、TE 90 ms),轴位液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)T2WI(TR 9 000 ms、TE 110 ms、TI 2 371 ms),视野(FOV)320 mm×320 mm,矩阵256×256,轴位层厚5 mm,层间距1.5 mm,矢状位层厚8 mm,层间距2 mm。扩散加权成像(DWI)采用SE-EPI序列加频率选择脂肪抑制技术,TR 4 000 ms,TE 100 ms,层厚9 mm,层间距1 mm,FOV 260 mm×260 mm,矩阵256×192。在x、y、z轴3个方向上施加扩散梯度(b值=0、1 000 s/mm2)。对比剂为Gd-DTPA 0.1 mmol/kg,流速3 ml/s,获得轴位、矢状位和冠状位增强T1WI。所有患者在治疗前行T1WI、T2WI、T2-FLAIR、DWI及MRI增强扫描。
1.3 图像分析与测量 由2名具有10年临床诊断经验的放射科医师采用双盲法在PACS系统上阅片,并独立观察和测量病灶数据。观察特征包括肿瘤部位、形态、瘤卒中、坏死/囊变、脑水肿程度(FLAIR图像上肿瘤边缘脑水肿延伸<1 cm为轻度,1~3 cm为中度,>3 cm为重度)、强化方式、瘤-脑界面(肿瘤与脑组织之间存在明显的脑脊液信号,且连续2个层面为瘤-脑界面清晰;反之则称为瘤-脑界面模糊)、静脉窦侵犯、颅骨侵犯[9-10]。测量肿瘤的大小、体积、最大表观扩散系数(maximum apparent diffusion coefficient,ADCmax)、平均ADC值(average ADC,ADCmean)、最小ADC值(minimum ADC,ADCmin)、相对ADC值(relative ADC,rADC)。当2名医师对颅内血管周细胞瘤MR语义特征判断结果不一致时,讨论后达成一致;定量参数取2名观察者测量的平均值作为最终结果。
1.4 随访 采用定期磁共振或电话方式进行随访。术后2年内每6个月随访1次,2年后每12个月随访1次。随访内容包括病史采集,头颅MRI、胸部CT、腹部B超或全身PET/CT。每次头颅MRI检查期间,若临床症状可疑肿瘤复发或转移可提前进行适当部位的影像学检查。随访时间截至2020年10月,研究的终点事件定为肿瘤复发、转移或死亡。复发定义为MRI图像上原术区位置肿瘤再现,或再次手术病理确认HPC复发。转移定义为在任何颅外部位存在影像和病理证实的≥2个病灶的HPC。随访时间8~120个月,平均(57±31)个月。
1.5 统计学方法 采用SPSS 25.0软件。正态分布的计量资料以±s表示,组间比较采用独立样本t检验;偏态分布的计量资料以M(Qr)表示,组间比较采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验或Fisher确切概率法。采用Kappa检验对比2位观察者之间的一致性。采用Kaplan-Meier法绘制生存曲线,并计算生存率,采用Log-rank检验进行生存情况分析。多因素Cox比例风险回归模型计算各因素的风险比(hazard ratios,HR),P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 纳入37例Ⅱ~Ⅲ级HPC,其中男17例,女20例,平均年龄(51±12)岁;WHO分级:HPC Ⅱ级15例(40.54%),Ⅲ级22例(59.46%);肿瘤进展组16例(43.24%),包括11例复发不合并颅外转移、1例仅颅外转移、4例颅内复发合并颅外转移,无进展组21例(56.76%);术后放射治疗15例(40.54%),见表1。随访过程中,3例(8.11%)死亡。
肿瘤术后是否进展的患者HPC病理分级和术后放疗比较,差异有统计学意义(P<0.05),见表1。

表1 HPC术后无进展生存期患者术前一般资料比较
2.2 影像特征分析 2位观察者对于颅内血管周细胞瘤影像特征(肿瘤基底、形态、瘤卒中)判断具有较高的一致性(Kappa=0.887、1.000、0.995,P均<0.01)。颅内HPC呈均匀或不均匀T1WI等低信号,T2WI稍高信号,DWI呈高信号,ADC呈低信号,增强呈均质或异质性明显强化。与术后肿瘤无进展组比较,肿瘤进展组中术前MRI表现为“宽基底”附着硬脑膜(P=0.002)、瘤-脑界面模糊(P=0.022)、颅骨侵犯(P=0.003)语义特征的比例高于非进展组(图1、2,表2)。
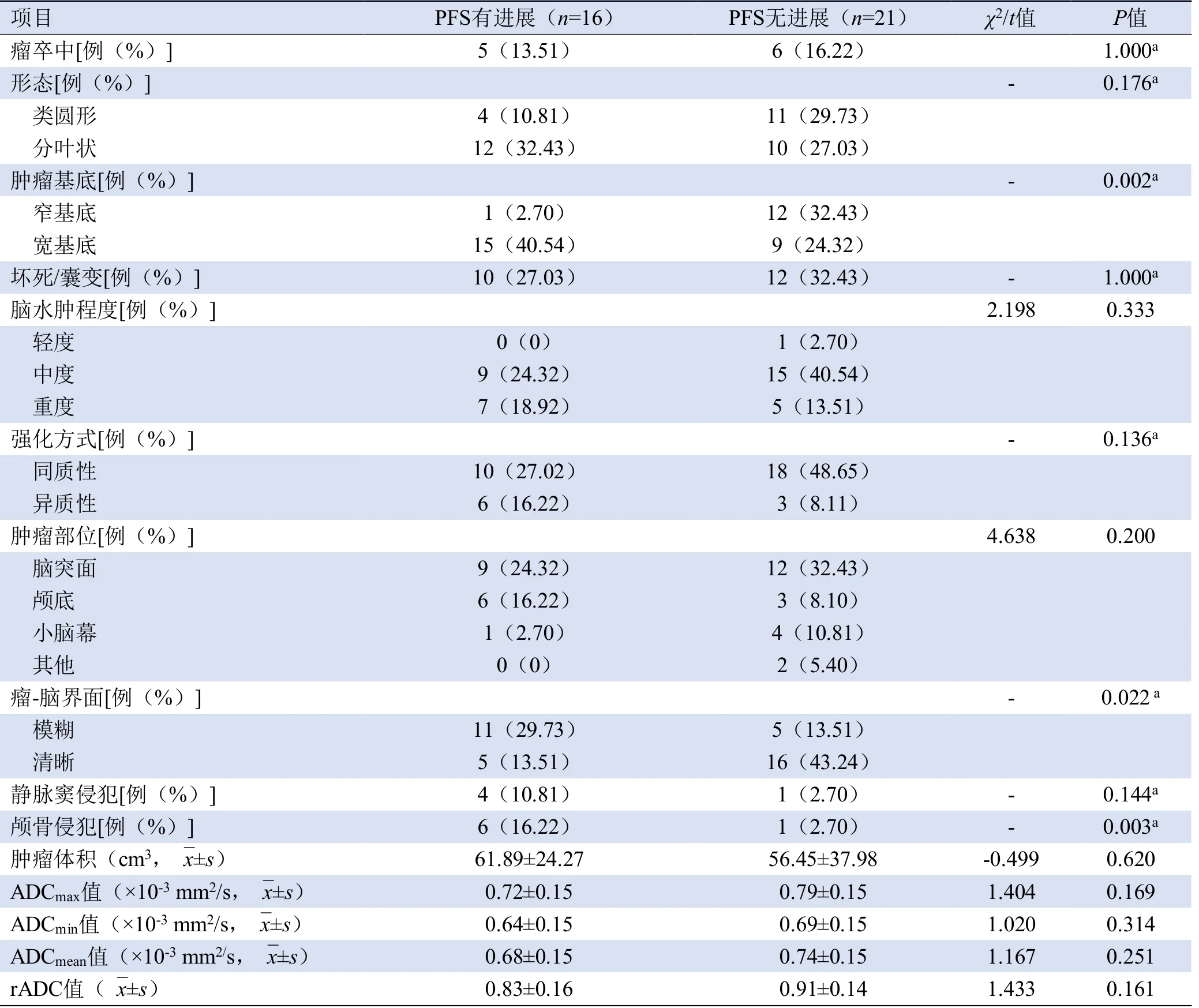
表2 HPC术后无进展生存期的术前MRI征象及ADC值比较

图1 女,38岁,额部Ⅲ级HPC。术前MRI示T1WI、T2WI肿瘤信号较为均匀,额骨骨松质信号异常(A、B);DWI与ADC图像显示肿瘤明显扩散受限(C、D);增强扫描呈明显不均匀强化,肿瘤侵犯颅骨并穿透骨板(箭,E);术后8个月复查头部MRI发现右侧额部类圆形占位,增强扫描呈不均匀强化(F);术后12个月,胸部CT平扫可见双肺多发小结节(箭),综合考虑肿瘤原位复发并双肺转移(G);病理镜下见大量异型细胞(HE,×100,H)

图2 女,48 岁,右侧顶部分叶状III 级HPC。MRI 示肿瘤T1WI、T2WI 信号较均匀(A、B);FLAIR 示瘤-脑界面显示不清,瘤周大片脑组织水肿形成(C);增强扫描示肿瘤均匀明显强化,并呈宽基底附着于硬脑膜(箭,D);术后72 h 增强MRI 示矢状窦旁结节状强化病灶(箭,E);术后12 个月腹部增强CT 示肝内多发占位,动脉起明显不均匀强化(箭,F);肝脏穿刺病理结果证实颅内HPC 肝脏多发转移(HE,×200,G)
与HPC Ⅲ级比较,HPC Ⅱ级窄基底附着硬脑膜比例较高,ADC值较高(P均<0.05),而其他常规MR语义特征差异无统计学意义(P>0.05),见表3。

表3 HPC不同分级MRI征象及ADC值比较
2.3 Cox模型多因素分析 单因素生存分析发现肿瘤分级(P=0.024)、肿瘤宽基底(P=0.009)、瘤-脑界面模糊(P=0.008)、颅骨侵犯(P=0.002)、术后无放疗(P=0.006)为HPC术后肿瘤进展的相关因素(表4,图3)。
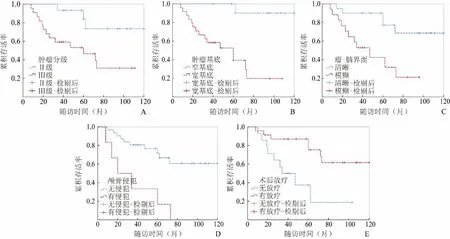
图3 肿瘤分级(A)、肿瘤基底附着(B)、瘤-脑界面(C)、颅骨侵犯(D)和术后放疗(E)的Kaplan-Meier生存分析曲线

表4 Kaplan-Meier单因素生存分析HPC术后肿瘤进展的相关因素
将上述因素纳入Cox多因素回归分析发现:肿瘤分级、颅骨侵犯、术后无放疗是HPC术后肿瘤进展的独立危险因子,见表5。
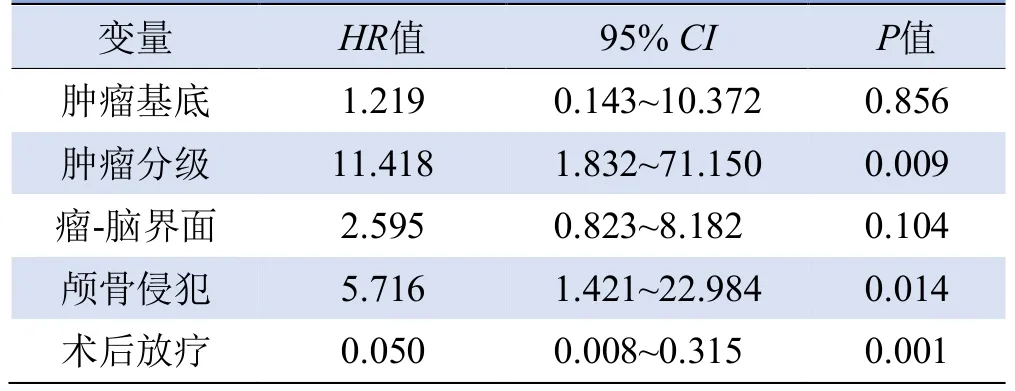
表5 COX多因素生存分析HPC术后肿瘤进展的独立危险因素
3 讨论
HPC具有一些独特的影像表现和临床特征,如血供丰富、坏死/囊变、侵袭性生长、术后肿瘤复发和颅外转移[11],其中以HPC术后肿瘤进展广受临床关注,因为这会大大降低患者的总生存期[12],因此术前预测颅内HPC术后肿瘤进展的相关危险因素,可以为患者制定个性化术前治疗方案提供重要的理论依据。本研究基于HPC术前MRI获得的肿瘤影像学和临床特征所构建的多因素回归模型发现:HPC病理分级、术后无放疗和肿瘤颅骨侵犯是HPC术后进展的独立危险因素。除上述因素外,单因素分析发现肿瘤宽基底、瘤-脑界面模糊也是HPC术后肿瘤进展的影响因素。
3.1 术前MRI语义特征与HPC术后进展的联系 本研究中,颅内HPC与硬脑膜宽基底附着是术后肿瘤进展的相关因素,可能与肿瘤沿硬脑膜浸润性生长,粘连广泛的硬脑膜,甚至包绕静脉窦,从而阻碍手术彻底切除肿瘤浸润的组织结构有关[13],HPC影像表现为广泛的硬脑膜附着,AHPC少见脑膜尾征,这种影像学的差异本质可能与肿瘤浸润性生长有关[14]。因此,本研究推测宽基底附着于硬脑膜可能是HPC恶性潜能的一种影像学特征,而将肿瘤分级纳入多因素回归分析时,肿瘤宽基底附着硬脑膜对于PFS的影响消失,间接提示肿瘤分级与宽基底的影像学特征存在共线性。此外,通过回顾HPC的术中记录和病理报告,发现HPC出现脑组织侵犯的MRI表现为瘤-脑界面模糊,肿瘤包膜不连续等影像学特征,单因素分析瘤-脑界面模糊对于PFS亦存在一定的影响,在恶性脑膜瘤中瘤-脑界面模糊提示可能存在肿瘤的脑侵犯[15-16],对于临床术者至关重要,因为这将增加手术切除肿瘤的难度,甚至为了保护功能区的脑组织而采取次全切肿瘤的手术方式,因此,术前MRI提示HPC出现瘤-脑界面模糊时,临床术者应考虑优化手术方案,且术后可局部放疗并密切随访,以预防肿瘤术后进展。
与既往研究结果不同[17],本研究未发现HPC大小、体积和部位对于PFS存在显著影响,推测可能与纳入样本量较少和手术切除的难度相关,本研究中颅底HPC 9例,其中6例术后进展,可见单论颅底HPC术后肿瘤进展比率依然很高,与颅底肿瘤手术难度较大相关。由于HPC属于颅内脑实质外的肿瘤,肿瘤的大小并不能代表HPC的分级,同时肿瘤未浸润周围组织结构,亦不影响手术切除的难度。此外,本研究还探讨肿瘤的形态、脑水肿的程度、强化方式以及ADC值等MRI定量特征,但这些特征均无显著差异,推测现有的MRI定量参数(如ADC值)未体现出预测价值的原因可能是Ⅱ、Ⅲ级HPC均可能在术后复发、转移也可以无进展存活,即使在进展与无进展肿瘤分级上存在一定的差异,但这种微弱的分级差异无法在生存分析时体现出来,因此,该领域仍需要进一步探索更有价值的定量MRI指标,以预测HPC术后肿瘤进展。
3.2 多因素回归分析HPC术后进展 运用术前MRI特征和临床信息整合形成的多因素回归分析发现:HPC颅骨侵犯、肿瘤高分级和术后无放疗是术后肿瘤进展的独立危险因子。颅骨侵犯定义为HPC所致颅骨骨质增生、破坏及骨髓腔内软组织肿块形成[7],其原因与肿瘤浸润性生长有关,本研究中6例(85.71%)颅骨侵犯出现术后肿瘤进展,如先前脑膜瘤的相关研究,颅骨侵犯亦是脑膜瘤术后肿瘤进展的重要预测因子[8],无论恶性脑膜瘤还是HPC,颅骨侵犯提示肿瘤增殖旺盛,则肿瘤周围结构的术中清理尤为重要,然而肿瘤细胞浸润在术中无法用肉眼评估,因此术前MRI提示HPC存在颅骨侵犯时,应特别注意术中颅骨和硬脑膜的处理,从而预防术后肿瘤进展。其次,术后放疗是HPC术后PFS的保护因素,与既往研究一致,无论肿瘤采取何种手术方式亦或是肿瘤级别高低,术后放疗均有益于延长患者PFS的时间[18],HPC的浸润生长与脑膜瘤不同,HPC血供丰富,其脉管内、瘤周硬脑膜、脑组织或颅骨髓腔内浸润的肿瘤细胞是导致术后复发的关键因素[19-20],通过放疗可辅助手术更好地预防肿瘤术后进展。但术后放疗对于总生存期的影响尚存在争议[21],本研究认为放疗确实可降低术后肿瘤的原位复发比率,当然,还需要更大样本研究进行探讨。最后,肿瘤分级也是HPC术后肿瘤进展的独立预测因子,本研究中Ⅲ级HPC共13例术后肿瘤进展,由于Ⅲ级HPC增殖指数≥10%,瘤周组织结构的浸润增大了术中处理的难度,因此,对于Ⅲ级HPC需要临床综合处理,如尽可能的术中肿瘤全切和早期局部辅助放疗的治疗方案[22],基于术前MRI肿瘤特征的预测因素可以更好地辅助临床优化手术方案、制定术后放疗计划以及规范随访流程,从而延长患者PFS时间。
本研究的局限性:本研究是单中心小样本量研究,术前MRI肿瘤特征的提取可能存在局限,缺乏MRI定量参数的预测,尝试已有的MRI定量参数(如肿瘤体积、ADC值)发现并不影响HPC患者PFS时间。
总之,本研究使用HPC患者术前MRI构建的预测模型中,肿瘤脑组织侵犯、颅骨侵犯、宽基底附着硬脑膜、肿瘤级别和术后放疗是影响HPC术后PFS的预测因子,对于临床术前治疗方案的制定、术中切除范围的确定以及术后随访计划的实施均具有重要意义。
