1例胰腺纤维钙化性糖尿病的诊断及治疗
2021-08-25冯姗姗王肃
冯姗姗,王肃
天津市第五中心医院内分泌科,天津300450
胰腺纤维钙化性糖尿病(FCPD)是一种罕见的继发性糖尿病,典型的临床表现为反复发作的腹痛、脂肪泻和糖尿病,影像学检查提示有胰腺钙化或者散在的胰腺结石,实验室检查可见胰腺内分泌及外分泌功能受损。FCPD 多发生于热带地区的发展中国家,印度南部是已知的FCPD 流行率最高的地区,非热带地区的病例报告数量较少。虽然FCPD 患者的临床表现、实验室及影像学检查与2 型糖尿病患者存在差异,但其极易被误诊为2 型糖尿病。研究[1-5]显示,与2 型糖尿病相比,FCPD 患者的发病年龄更小,体型偏瘦,血糖控制更差,高血糖持续时间更长,糖尿病微血管并发症及神经病变的发生率较高,心脑血管疾病等糖尿病大血管病变的发生率较低。FCPD 的确切病因尚不清楚,有推测认为遗传、营养和炎症因素在其发病中起一定作用。Wolfram syndrome 1(WFSl)基因突变最初是在Wolfram 综合征中发现的,后研究[6-8]发现,WFS1 基因突变也可发生于非Wolfram 综合征性糖尿病中,但目前未见FCPD 患者WFS1 基因突变的文献报道。2020年5月,我们收治了1 例FCPD 患者,现就其临床资料进行分析,以探讨FCPD的有效诊断及治疗方法。
1 资料分析
患者,女,29 岁,汉族,因“恶心、呕吐、乏力3 d,血糖升高、尿酮体阳性1 d”于2020年5月24日入院。入院前3 d无明显诱因出现恶心、呕吐,呕吐物为非咖啡色胃内容物,一日十余次,伴乏力、纳差、剑突下疼痛、腹泻,无发热,平素喜甜食,无口干、多饮、多尿、体质量下降、嗜睡、烦躁、呼吸深大等情况,烂苹果味不明显,于急诊查血糖22.7 mmol/L、尿葡萄糖++++、酮体+++,予小剂量胰岛素静脉输注、补液纠酮、止吐等对症支持治疗后患者仍存在恶心、呕吐。
患者自幼有腹痛发作史,一直按胃病治疗,缓解不明显,未能明确病因。患者长期腹泻,无吸烟饮酒史,无进食木薯史。患者姥姥、舅舅、姨妈均患糖尿病,父母均无糖尿病。患者体格检查结果显示,体型偏瘦,神清语利,粗试听力正常,心肺查体阴性,腹软,剑突下轻压痛,无反跳痛,肝脾肋下未触及,双下肢不肿,足背动脉搏动良好。实验室检查结果显示,总蛋白57.5 g/L、白蛋白34.3 g/L,尿酸碱度5.5、尿比重1.038、尿葡萄糖+++ +、尿酮体+++、尿蛋白质++,胃液潜血+,血PH7.35,二氧化碳结合力17mmol/L,阴离子间隙12.8,果糖胺580 µmol/L,糖化血红蛋白13.5%,糖尿病抗体阴性,尿白蛋白310.8 mg/D、尿总蛋白定量0.89 g/D、尿白蛋白/尿肌酐比值3.81 mg/(mmol•L),皮质醇9.07 µg/dL,促肾上腺皮质激素23.02 pg/mL,促卵泡成熟激素3.79 IU/L,促黄体生成素8.79 IU/L,便脂肪球(-)。肾脏病理检查结果提示糖尿病肾病。眼底检查结果显示,左眼可见少量出血及渗出,右眼未见明显异常,考虑为糖尿病视网膜病变。甲状腺功能检查结果显示,血清游离三碘甲腺原氨酸(FT3)2.16 pmol/L,血清游离甲状腺素(FT4)14.61 pmol/L,血清促甲状腺激素(TSH)1.880 µIU/mL,甲状腺过氧化物酶抗体及甲状腺球蛋白抗体阴性,提示非甲状腺疾病综合征。胃镜检查结果显示慢性胃炎伴糜烂、胆汁反流、胃息肉。全腹CT平扫及增强检查结果显示,胰腺萎缩伴多发小钙化灶,部分小肠内积液,盆腔少量积液,盆壁及下背部皮下软组织水肿(见图1)。患者免疫球蛋白G4阴性,风湿免疫全项、抗核抗体、抗中性粒细胞抗体阴性,免疫球蛋白E 111 IU/mL,补体C3 0.630 g/L,排除自身免疫性胰腺炎。患者乙肝、丙肝、艾滋病、梅毒病毒检测均阴性,癌胚抗原10.85 ng/mL,血淀粉酶<30 U/L,血脂肪酶<10 U/L,尿淀粉酶45 U/L,提示胰岛外分泌功能不足。患者糖耐量试验+胰岛素释放试验+C肽释放试验结果见表1,提示胰腺内分泌功能不足。
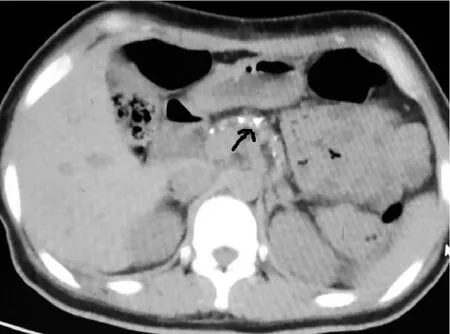
图1 患者入院时腹部CT检查图像
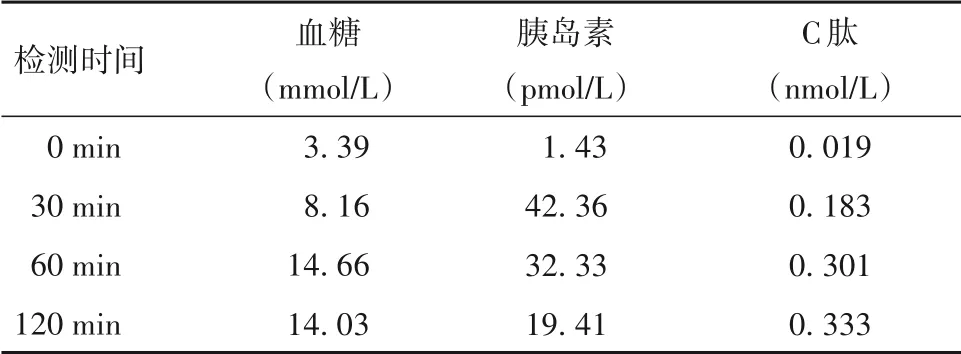
表1 患者糖耐量试验+胰岛素释放试验+C肽释放试验结果
因患者发病年龄较年轻,糖尿病抗体阴性,糖耐量试验+胰岛素释放试验+C肽释放试验提示空腹胰岛素分泌不足、服糖后胰岛素释放曲线低平,且患者存在胰腺萎缩伴钙化,临床不能明确糖尿病分型,补查遗传性糖尿病相关基因测序以除外单基因糖尿病。取患者外周静脉血2 mL 送天津金域医学检验实验室采用过柱法提取DNA,应用Illumina 测序平台NovaSeq 6000测序仪进行遗传性糖尿病相关基因测序。结果显示,位于染色体4q16.1 的WFS1 基因2号外显子发生c.139C>T杂合突变,为致病变异。
结合患者病史、症状、实验室检查结果及腹部CT 检查结果,最终明确诊断:FCPD,糖尿病酮症酸中毒,糖尿病性肾病,糖尿病性视网膜病变,慢性胃炎伴糜烂、胆汁反流,胃息肉,低蛋白血症,非甲状腺疾病综合征。患者入院后予小剂量胰岛素输注、补液、补充电解质等治疗纠正糖尿病酮症酸中毒。酮症酸中毒纠正后予门冬胰岛素皮下注射和地特胰岛素皮下注射控制血糖,雷贝拉唑肠溶片抑酸、护胃,阿嗪米特肠溶片补充胰酶,双歧杆菌乳杆菌三联活菌片调节肠道菌群,肾炎康复片减少尿蛋白等治疗措施,治疗后患者无腹痛、恶心、呕吐等症状,血糖稳定后出院。
2 讨论
FCPD 是一种罕见的继发性糖尿病,发病率低,在全世界所有糖尿病病例中占比不到1%。1959年,ZUIDEMA 在印度尼西亚首次发现在热带地区存在一种非酒精性的慢性胰腺炎,其病因不清。随后,在亚洲和非洲的热带地区也出现了这种病例,但主要来自印度,尤其是喀拉拉邦和泰米尔纳德邦地区。印度南部金奈地区的一项回顾性研究[9]发现,FCPD 的患病率在下降,其在所有糖尿病患者中的占比从1991—1995年的1.6%下降至2006—2010年的0.2%。2019年,有一项针对印度北部年轻人的研究[10]表明,FCPD占到糖尿病病例的15%。在孟加拉国的一个三级保健中心也提示了FCPD 患者的高患病率。在非热带地区也有病例报道,在我国FCPD 较集中于四川、云南、贵州、广西、广东、海南、浙江、湖南、内蒙古[11-12]。FCPD 发病的确切病因仍然不清楚,目前认为可能的影响因素有遗传因素、营养不良、木薯/氰的毒性作用、氧化应激损伤、微量元素缺乏、胰岛素抵抗等。
腹痛、脂肪泻和糖尿病是FCPD 的典型临床表现,但这三种症状不是同时发生的,每一种症状在疾病发展的不同阶段占主导地位。FCPD 的第一阶段常见于儿童或青少年,表现为腹痛反复发作。在此阶段,慢性胰腺炎相关试验或者糖耐量试验均为阴性,没有胰腺结石,也没有糖尿病,血尿淀粉酶及血清脂肪酶水平也是正常的。此阶段,很难确定疼痛是由慢性胰腺炎引起的。因此,FCPD 的病程隐匿,并且没有典型的症状。几年后,胰腺结石开始出现,在胰腺超声或CT 扫描可以显示扩张的胰管和胰腺结石,仍然没有糖尿病。在下一阶段,糖尿病开始出现,且确定是继发于慢性胰腺炎。
FCPD 的并发症可分为糖尿病并发症和非糖尿病并发症。糖尿病并发症方面,FCPD 患者与血糖控制水平相当的2 型糖尿病患者相比,更易发生糖尿病微血管病变[1-4](视网膜病变和肾脏病变),因为糖尿病微血管并发症主要与高血糖及其持续时间有关,FCPD 患者的血糖波动较大,且糖尿病发病年龄较早。有研究[4-5]报道,FCPD 患者发生神经病变的患病率高,包括心脏自主神经病变,但FCPD 患者发生糖尿病大血管病变(心血管疾病)的风险要低很多。这可能与这些患者体型比较瘦弱、不存在血脂异常和高血压等心血管疾病的危险因素有关[13]。非糖尿病并发症方面,FCPD 患者容易发生因脂肪吸收不良导致的营养不良,如脂溶性维生素A、D、E、K和必需脂肪酸缺乏,有可能会出现夜盲症、凝血障碍、骨质疏松等疾病,同时胰腺癌的发生风险也明显增加。长期随访研究[14]表明,FCPD 患者的胰腺癌风险比对照组高100 倍。FCPD 患者的胰腺癌在疾病早期很难诊断,但在血糖及胰酶补充满意的情况下仍有体质量持续减轻的情况就应该怀疑,多数患者都是在疾病晚期才被诊断为胰腺癌。本研究患者的癌胚抗原高于正常值一倍,嘱患者定期复查肿瘤标志物及腹部CT 等检查,并注意体重变化情况,警惕胰腺恶性肿瘤的发生。
FCPD 诊断标准[15]:①病例来自热带地区;②符合WHO 的糖尿病诊断标准;③存在慢性胰腺炎的证据,腹部影像学检查显示胰腺结石或存在以下至少三项:腹部超声或CT 扫描显示胰腺形态异常,自幼腹痛反复发作史,脂肪泻,胰腺功能异常;④排外其他引起的慢性胰腺炎的因素(如酒精中毒等[16])。本例患者虽然患者不是来自热带地区,但结合患者病史、症状、实验室检查结果及腹部CT检查结果,仍考虑诊断为FCPD。诊断依据包括:①患者糖尿病诊断明确,糖耐量试验+胰岛素释放试验+C 肽释放试验提示胰岛内分泌功能差,果糖胺及糖化血红蛋白明显高于正常,糖尿病抗体阴性,使用基础-餐时胰岛素治疗方案,血糖控制相对稳定。②存在慢性胰腺炎证据。患者自幼有腹痛发作史,一直按胃病治疗,腹痛缓解不明显,未能明确病因。患者常年腹泻,进食高脂肪食物或者高蛋白食物后有腹部不适、恶心,但经补充胰酶后患者腹泻症状明显好转,且食欲较前明显增强,进食高脂肪或者高蛋白食物后无恶心、腹部不适出现,结合患者血脂肪酶和血淀粉酶均处于正常值的下限,提示患者存在胰腺外分泌功能缺乏。糖耐量试验+胰岛素释放试验+C肽释放试验提示胰岛内分泌功能差,因此患者存在胰腺功能异常。腹部CT 检查结果显示胰腺萎缩伴多发小钙化灶,支持此诊断。该患者便常规脂肪球(-),提示无脂肪泻,可能与患者体型偏瘦、皮下脂肪含量少有关。③患者既往无饮酒史、无进食木薯史、无肝胆疾病、无甲状旁腺功能亢进症等其他可以引起慢性胰腺炎的疾病,相关免疫指标检查结果排除自身免疫性胰腺炎。
FCPD 患者的治疗方法主要有:①控制血糖,减少糖尿病并发症。对于FCPD 患者来说,胰岛素治疗是应用最广泛的方法,也有少数患者仅仅靠口服降糖药或者改善生活方式就可以控制好血糖。若使用口服降糖药物,要避免使用可能导致胰腺炎和引起体质量减轻的药物。使用胰岛素治疗的患者在控制高血糖的同时要避免低血糖。因FCPD 患者的血糖波动较大,所以佩戴动态血糖监测系统很有必要。②营养支持。外源性补充胰酶可以减少腹痛,亦可以改善脂肪泻和营养状况。建议患者高蛋白饮食,同时戒烟戒酒。③腹痛治疗。FCPD 患者发展为糖尿病时,胰腺疼痛的发作通常已经消退,或者疼痛不如胰腺炎时剧烈。在多数情况下,补充胰酶可以治疗疼痛,对于偶发的腹痛,也可以使用非阿片类药物来治疗。少数情况下,若疼痛严重并且耐药,需要使用手术治疗,如内镜下胰管结石切除、胰管空肠侧吻合等引流手术。
WFS1 基因位于人类染色体4p 上,编码一种名为wolframin 的蛋白质。最初研究[17]发现,WFS1 基因突变是Wolfram 综合征的病因。Wolfram 综合征是一种常染色体隐性遗传病,以糖尿病、尿崩症、视神经萎缩和耳聋为主要特征,可伴有膀胱、肠道和体温调节功能障碍,部分患者还伴有内分泌、精神和神经系统异常。WOLFRAM[18]和WAGNER[19]在1938年首次描述了这种疾病。目前已经确定Wolfram 综合征有2 个致病基因:WFS1 和WFS2。本例患者虽然存在WFS1 基因突变,但该患者临床特征不支持Wolfram 综合征,原因如下:①该患者糖尿病诊断明确,为胰岛素依赖型糖尿病,糖尿病抗体阴性,但患者自幼有腹痛反复发作,长期腹泻,且腹部CT 提示有胰腺萎缩伴钙化,考虑患者糖尿病是继发于慢性胰腺炎;②患者存在糖尿病视网膜病变,但无视力减退、视神经萎缩等眼部症状;③患者听力正常,无听力减退,甚至耳聋;④患者饮水量正常,尿比重正常,无烦渴、喜冷饮、多饮多尿等尿崩症症状。有研究[6]报道,5%的糖尿病自身抗体阴性的中国1 型糖尿病患者是由于WFS1 基因突变的非综合征性糖尿病。WFS1 在非综合征性糖尿病的高发病率,远比Wol⁃fram 综合征常见,与黎巴嫩[7]和德系犹太人[8]中报告的发病率相当。
FCPD 不是遗传性疾病,但会呈现家族聚集性。SPINK1 基因和PRSS1 基因等与胰腺外分泌功能相关的某些基因变异与发病之间存在联系。SPINK1基因编码一种名为胰腺分泌性胰蛋白酶抑制剂的蛋白质,通过将过早激活的胰蛋白酶原裂解成非活性代谢物来防止胰腺受损,此种蛋白质缺乏或者功能缺陷可导致胰腺炎复发。在印度南部一家医院56名FCPD 患者的研究[20]中,发现62.5%的患者发生了SPINK1 基因的变异,48.2%的存在功能显著异常。PRSS1基因主要是防止过早激活的胰蛋白酶原失活发挥调解作用,突变的PRSS1基因,在调解过程中存在缺陷,有可能在FCPD 的发生过程中起一定作用。目前关于FCPD 与WFS1 基因突变的关系未见有文献报道。
综上所述,本例FCPD 患者的病程隐匿,且临床症状不典型,主要临床表现为反复发作的腹痛、糖尿病。腹部CT 和遗传性糖尿病相关基因测序有助于明确诊断。临床诊疗中FCPD 应与2 型糖尿病、Wolfman 综合征等进行鉴别诊断。FCPD 的主要治疗方法为控制血糖、营养支持、补充胰酶等。在临床诊疗过程中,对体型偏瘦、血糖波动较大、胰岛功能异常、伴腹痛、脂肪泻的患者应警惕FCPD可能。
