慈菇消脂丸含药血清对HepG2细胞脂性凋亡的影响
2021-08-23毛舒婷尹硕霍瑞琦马燕花
毛舒婷尹 硕霍瑞琦马燕花
(甘肃中医药大学临床医学院,甘肃 兰州730000)
流行病学调查显示,近20年来,伴随肥胖流行及生活方式改变,世界范围内非酒精性脂肪性肝病(Non⁃Alcoholic Fatty Liver Disease,NAFLD)的平均患病率已为24%。亚洲地区NAFLD 总患病率也呈明显上升趋势,高达27.4%[1]。NAFLD 发生及发展是多因素共同作用的结果,其中脂毒性引起的肝细胞损伤对非酒精性脂肪性肝炎(Non⁃Alcoholic Steatohepatitis,NASH)进展发挥重要作用,这种凋亡类型也称为脂性凋亡[2⁃3]。脂肪酸可上调细胞死亡受体,NASH 患者死亡受体Fas 的表达较单纯性脂肪变性患者更明显。Fas 表达上调可激活外源性肝细胞凋亡通路[4]。过多脂肪酸堆积也可导致线粒体功能障碍和内质网应激,激活c⁃Jun 氨基末端激酶(c⁃Jun N⁃terminal Kinase,JNK)信号通路,启动内源性凋亡途径[5],脂性凋亡与相关因素共同作用引起肝细胞坏死。当细胞发生损伤时,肝细胞内丰富的酶蛋白释放,如丙氨酸氨基转移酶(Alanine Aminotransferase,ALT)、谷草转氨 酶(Aspartate Transaminase,AST)。也有学者提出ALT 和AST 升高是细胞内脂肪酸氧化产物丙二醛(Malondialdehyde,MDA)的作用[6],因此超氧 化物歧化 酶(Superoxide Dismutase,SOD)抗氧化作用也至关重要[7]。单纯性脂肪变性在肝细胞损伤与免疫因素交互作用下发展为NASH[8],最终进展为临床终末期肝病如肝硬化及肝癌。
2016年第28 届脾胃病学术年会中,中华中医药学会就NAFLD 中医诊疗达成专家共识意见,提出NAFLD 辨证分型为湿浊内停,肝郁脾虚等证型,主要病机为肝体用失调,湿浊痰瘀内生[9]。课题组自拟处方慈菇消脂丸以山慈菇为君药,用以清热解毒、消痈散结,配伍法半夏化痰祛湿,茯苓、薏苡仁健脾渗湿,柴胡疏肝解郁,丹参活血化瘀,土鳖虫散结消癥,加用黄芩清热解毒,泽泻利水渗湿,佐以枸杞、生首乌、决明子补益肝肾以固本,生山楂健脾兼消瘀,合用炙甘草调和诸药,同时顾护中焦脾胃。诸药合用,共奏解毒化痰、消降浊脂之功效。本实验用慈菇消脂丸含药学清干预HepG2细胞脂肪变性模型,通过免疫荧光技术检测凋亡相关蛋白caspase⁃8、Fas⁃L、p⁃JNK 表达,ELISA 技术检测SOD、MDA、ALT、AST 水平,并结合电镜观察细胞微观形态学变化,以期为慈菇消脂丸改善脂性凋亡提供细胞形态学和分子生物学证据。
1 材料
1.1 细胞 HepG2(货号HYC3112)购自上海和元生物技术股份有限公司。
1.2 动物 8 周龄SPF 级雄性健康SD 大鼠50 只,体质量180~220 g,由甘肃中医药大学动物实验中心提供,实验动物生产许可证号SCXK(甘)2015⁃0002。饲养室温度控制在20~22 ℃,相对湿度50%~60%,12 h/12 h 明暗交替照明。本实验遵循甘肃中医药大学实验动物中心实验动物使用管理规定,并通过甘肃中医药大学动物伦理委员会批准(编号2015⁃036)。
1.3 药物 慈菇消脂丸组方由山慈菇、法半夏、茯苓、柴胡、丹参、土鳖虫、薏苡仁、黄芩、泽泻、枸杞、生山楂、生首乌、决明子、炙甘草各味中药材组成,药材均购自甘肃中医药大学附属医院制剂中心,委托甘肃中医药大学附属医院制剂中心王晓莉主任药师鉴定为正品。油酸(OA,货号O1008)、棕桐酸(PA,货号P0500)、JNK 抑制剂(SP600125,货号S5567)、二甲基亚砜(DMSO,货号D2650)、4′,6⁃二脒基⁃2⁃苯基吲哚(DAPI,货号DUO82040)均购自美国Sigma 公司;人天门冬氨酸氨基转移酶(AST,货号C010⁃2)、谷丙转氨 酶(ALT,货号C009⁃2)、超氧化物歧化酶(SOD,货号A001⁃3)、丙二醛(MDA,货号A003⁃1)检测试剂盒均购自南京建成生物工程研究所;p⁃JNK 抗体(批号ab47337)、caspase⁃8 抗体(批号ab25901)、Fas⁃L 抗体(批号ab15285)均购自英国Abcam 公司;FITC 标记山羊抗兔IgG(批号A0562)购自上海碧云天生物技术有限公司;油红O 工作液(货号G1262)购自北京索莱宝科技有限公司。
1.4 仪器 荧光显微镜(德国Carl Zeiss 公司);微孔板分光光度计(美国Bio⁃Rad 公司);透射电镜(HS500,日本日立公司)。
2 方法
2.1 含药血清制备 煎锅中混匀各味中药材,加8 倍量自来水浸泡5 h,电磁炉加热煮沸,开始用强火,沸腾后文火保持微沸40 min,纱布滤出药液,药渣继续加药物干重6倍量自来水煮沸重复上述操作。合并2 次所得到滤液放置过夜,弃去沉淀,电磁炉上中火根据比例浓缩至适量,浓缩后的药液装在灭菌容器中,最终制备的慈菇消脂丸药液浓度为0.225 g/mL,于⁃4 ℃冰箱中保存备用。SD 大鼠随机分为慈菇消脂丸含药血清组(20 只)和空白组(10只)。给药剂量=临床常用量×动物等效面积系数×5。慈菇消脂丸含药血清组给予慈菇消脂丸药液(2 mL/100 g)灌胃,空白组给予等剂量生理盐水,2 次/d,早晚各1 次,持续1 周,末次给药1 h 后心脏取全血。全血于4 ℃静置2 h,低温离心机3 500 r/min 离心15 min,分离血清。分离的血清同组混合,经56 ℃水浴灭活30 min,超净台上用0.22 μm 微孔滤膜过滤,配制慈菇消脂丸含药血清低剂量(2%含药血清)和慈菇消脂丸含药血清高剂量(6%含药血清)培养液各10 mL,-20 ℃保存备用。
2.2 HepG2细胞培养 用含10% 胎牛血清的DMEM 完全培养液,于37 ℃、5% CO2的培养箱中培养HepG2细胞。细胞生长至80 %时制备细胞悬液,用细胞计数板在细胞计数仪下计数,调整细胞浓度为1×105/ mL,接种至24 孔培养板,继续置于培养箱中培养。
2.3 分组细胞于24 孔培养板贴壁生长至80%左右,随机分为空白对照组;模型组,添加油酸⁃棕榈酸(2∶1)配制的浓度为500 μmol/L 游离脂肪酸(Free Fatty Acid,FFA)培养液;慈菇消脂丸含药血清组,添加500 μmol/L FFA 和不同浓度的慈菇消脂丸含药血清;JNK 抑制剂组,以20 μmol/L SP600125(JNK 抑制剂)预先干预1 h,再加500 μmol/L FFA 培养液。24 h 后收集细胞培养液检测SOD、MDA、ALT、AST,并做细胞免疫荧光化学染色和电镜观察。
2.4 电镜观察细胞内脂滴 待24 孔板细胞生长至80%左右,分组诱导干预24 h,细胞刮刮下细胞,收集于离心管中,1 000 r/min,离心5 min,弃上清,弹指法混匀细胞。沿管壁加入2.5%电镜用冷戊二醛500 μL 固定,切勿吹悬,置于室温1 h,4 ℃冰箱3 h 后,去除戊二醛加满PBS 送检。
2.5 检测各组细胞培养液中SOD、MDA、ALT、AST 水平 用收集到的细胞培养上清液,按照试剂盒说明书,ELISA 法检测ALT、AST,黄嘌呤氧化酶法测定SOD,硫代巴比妥酸法测定MDA。
2.6 免疫荧光 染色检测caspase⁃8、Fas⁃L、p⁃JNK 的 表达 将分组干预后生长状态良好的HepG2细胞接种于细胞爬片上,37 ℃、5% CO2培养箱中培养24 h 后,将爬片置于4%多聚甲醛中固定30 min,0.5% PBST 缓冲液室温孵育20 min,0.05% PBST 洗3 次,5 min/次,滴加5% BSA 封闭液置于室温下20 min,甩去多余液体,滴加一抗50 μL(1∶200),37 ℃孵育1 h,4 ℃过夜。次日,0.05% PBST洗3 次,5 min/次,滴加Alexa Flour 488 标记的山羊抗兔二抗40~50 μL(1∶400),37 ℃孵育1 h,用0.05% PBST 洗3 次,5 min/次,滴入1 滴DAPI 染液(蓝色)染色15 min使细胞核着色,PBS 清洗3 次,荧光显微镜下观察拍照。
2.7 统计学分析 应用SPSS 22 统计软件,数据以()表示,W 检验和矩法检验判断正态分布性,Levene 检验判断方差齐性,组间采用 单因素方差分析(one⁃way ANOVA),多重比较采用最小二乘法(LSD 检验),以P<0.05 表示差异具有统计学意义。
3 结果
3.1 电镜下细胞微观结构 空白对照组HepG2细胞大小均一,核型如常,核浆比例正常,核仁清晰,胞浆内未见到脂滴。FFA 刺激后细胞胞浆内可见大量的大小不一的卵圆形或圆形脂滴沉积,并可见细胞核受挤压而变形,内质网、线粒体等细胞器受损,并且清晰可见许多含有内容物的自噬小体,偶见凋亡体。慈菇消脂丸含药血清组细胞内脂滴、自噬小体均减少,其中高剂量药物血清组脂滴、自噬小体减少更明显。JNK 抑制剂组细胞内脂滴亦减少,自噬小体明显减少。见图1。

图1 各组电镜下细胞微观结构(×10 000)
3.2 细胞培养液中SOD、MDA、ALT、AST 水平 与空白对照组比较,模型组SOD 水平降低,MDA、ALT、AST 水平增高(P<0.05);与模型组比较,慈菇消脂丸含药血清各剂量组及JNK 抑制剂组SOD 水平升高,MDA、ALT、AST 水平降低(P<0.05);与JNK 抑制剂组比较,慈菇消脂丸含药血清组SOD 水平升高(P<0.05)。见表1。
表1 各组细胞培养液酶学指标(, n=10)

表1 各组细胞培养液酶学指标(, n=10)
注:与空白对照组比较,※P<0.05,※※P<0.01;与模型组比较,#P<0.05,##P<0.01;与JNK 抑制剂组比较,▲▲P<0.01。
3.3 细胞膜及胞浆内caspase⁃8、Fas⁃L、p⁃JNK 表 达caspase⁃8分布在细胞的胞质和细胞核中。与空白对照组比较,模型组caspase⁃8 表达增高(P<0.01),慈菇消脂丸含药血清组caspase⁃8 表达较模型组降低(P<0.01),但没有恢复到正常组水平,见图2。Fas⁃L 蛋白主要分布于细胞膜、胞浆和细胞核。与空白对照组比较,单纯经游离脂肪酸处理后Fas⁃L 表达增加(P<0.01),慈菇消脂丸含药血清组Fas⁃L 表达较模型组下降(P<0.01),且较JNK 抑制剂组降低更明显(P<0.01),见图3。p⁃JNK 主要分布在胞浆,也分布于细胞。p⁃JNK 在正常对照组中表达很低,在模型组表达量增高(P<0.01),JNK 抑制剂组较模型组明显降低(P<0.01),中药各剂量组较模型组没有明显变化,见图4。各组蛋白的表达量如表2 所示。

图3 Fas⁃L 荧光染色(×200, 绿色荧光为Fas⁃L 蛋白,蓝色荧光为细胞核)

图4 p⁃JNK 荧光染色(×200, 绿色荧光为p⁃JNK 蛋白,蓝色荧光为细胞核)
表2 各组细胞中caspase⁃8, FasL, p⁃JNK 表达(, n=10)
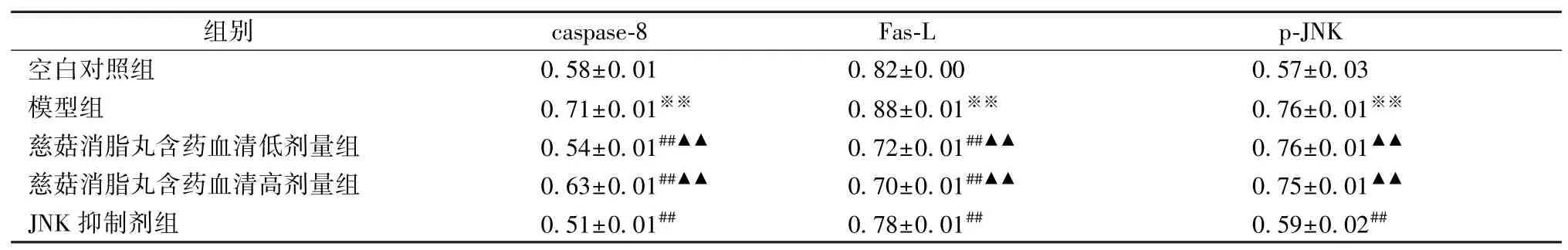
表2 各组细胞中caspase⁃8, FasL, p⁃JNK 表达(, n=10)
注:与空白对照组相比,※※P<0.01;与模型组比较,##P<0.01;与JNK 抑制剂组比较,▲▲P<0.01。
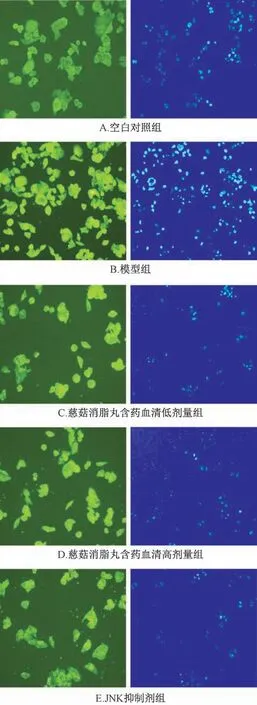
图2 caspase⁃8 荧光染色(×200, 绿色荧光为caspase⁃8 蛋白, 蓝色荧光为细胞核)
4 讨论
尽管大多数NAFLD 患者仅表现为单纯性脂肪变性,但近1/3 患者会进展为NASH,这种坏死性炎症性疾病增加了患者患肝纤维化、肝硬化、肝癌的危险因素[10]。虽然NAFLD 发病重在预防,对于已经患有单纯性脂肪变性的患者来说,为防治其进展为NASH,研究游离脂肪酸堆积引起的肝细胞损伤至关重要。
当大量脂肪酸涌入肝细胞,超过细胞自身降解脂肪酸能力,会堆积引起脂毒性,进而导致反应氧簇(Reactive Oxygen Species,ROS)产生,内质网应激和肝细胞功能障碍[11]。ROS 中的超氧自由基(O2-)在SOD 作用下才能正常降解[12]。所以SOD 是细胞内重要的抗氧化物。但当ROS 产生超过细胞正常抗氧化机制时,会导致氧化应激。氧化应激在NASH 始动阶段发挥重要作用。堆积的脂质进一步发生β⁃氧化和ω⁃氧化,多不饱和脂肪酸过氧化产生的毒性物质包括MDA 和羟基壬烯酸(Hydroxynonenal,HNE),也可促进细胞凋亡[13]。所以MDA 增多是肝细胞发生脂质过氧化的标志。脂肪酸还可上调位于肝细胞膜上的死亡受体Fas、肿瘤坏死因 子(Tumor Necrosis Factor,TNF)和TNF 相关凋亡诱导配体(TNF Related Apoptosis Inducing Ligand,TRAIL)。Fas 可与Fas⁃L 结合,通过肝细胞内反应蛋白Fas 相关死亡域蛋白(Fas⁃Associated Protein with Death Domain,FADD)[14]激活caspase⁃8[15],caspase⁃8执行细胞凋亡命令,这一过程称为外源性细胞凋亡通路。所以在肝细胞发生损伤时,Fas 和caspase⁃8 表达都会上调。脂肪酸堆积也可导致线粒体障碍和内质网应激,感受态JNK 被激活,磷酸化c⁃Jun 调控内源性相关凋亡基因表达,如c⁃Jun 会上调Bax 和Bak 表达[16],导致线粒体通透性增加,细胞色素⁃c 释放入细胞质,与凋亡酶激活因子(Apoptotic Protease Activating Factor⁃1,APAF⁃1)和caspase⁃9 形成凋亡体。因此,p⁃JNK 表达上调是内源性细胞凋亡通路激活的重要标志。凋亡作为一种程序性细胞死亡形式,产生的凋亡小体在没有吞噬细胞存在时,内容物会释放入细胞外液,所以本实验中代表肝细胞膜损伤的酶蛋白AST和ALT 水平也会上升。然而,AST 也大量存在于脑、胰腺、心脏、骨骼肌等组织中,这些组织损伤后也会导致血液中AST 水平上升,因此在实际临床应用中AST 并不能作为肝组织损伤的特征性标志。相反,ALT 主要存在于肝脏中,其水平在血液中的升高是肝组织损伤的直接证据。
本细胞水平的实验研究将血清药理学研究方法和细胞生物学实验技术相结合,旨在证明内外源性凋亡通路在NAFLD细胞模型中的作用,阐明慈菇消脂丸治疗NAFLD机制。本实验中,模型组中凋亡相关蛋白质caspase⁃8,Fas⁃L,p⁃JNK 表达显著上调及肝细胞酶学指标ALT、AST分泌增加为肝细胞损伤提供了佐证;脂质过氧化产物MDA增加及抗氧化产物SOD 降低为细胞内脂质过氧化提供了佐证。不同浓度中药剂量组中上述相关指标均有不同程度减轻,证实慈菇消脂丸可以抑制脂毒性引起的肝细胞凋亡。之前的实验证明慈菇消脂丸可通过调控JNK⁃Jun 内源性凋亡通路抑制肝细胞凋亡,通过本实验,可发现其对外源性凋亡通路FasL⁃Fas 也会产生影响。因两条凋亡通路最终发生交联,对于慈菇消脂丸是通过调节内源性凋亡通路进一步调节外源性凋亡通路,还是直接影响外源性凋亡通路有待进一步研究。自噬小体是细胞在极端环境下的一种保护性机制,通过电镜观察到模型组细胞中自噬小体含量明显较药物干预组多,说明药物在抑制细胞凋亡同时也抑制了细胞自噬。JNK 可以感知细胞内外环境的变化,肝细胞中
主要有JNK1 和JNK2 两种亚型,查阅文献发现JNK1 主要通过影响Beclin1 表达促进自噬[15]。进一步说明游离脂肪酸可通过JNK2 促进肝细胞凋亡,而游离脂肪酸是否通过JNK1 通路诱导肝细胞自噬则需更充分的实验研究证实。
