阿奇霉素合用穿心莲内酯对感染性肺炎协同影响
2021-08-23袁晓燕徐文豪母育成谌立巍陈彦清
袁晓燕徐文豪 金 典 母育成 谌立巍 陈彦清*
(1.攀枝花市中心医院,四川 攀枝花617067; 2.成都中医药大学药学院,四川 成都611137)
感染源性肺炎是临床常见病,多发病[1]。抗感染治疗是临床最为主要的治疗思路[2]。由于我国独特的中医药资源,国内临床实践中也常合用以清热解毒为代表的各类中药制剂。多年的临床实践也证实中西药合用可显著改善患者的一些体感症状,缩短损伤性反应持续时间,最终有助于提高治愈率和治愈速度[3]。
药物合用具有极其复杂的表征,其合理性除从临床观察性资料汇总以评价外,近年来使用定量药理学手段结合实验药理学方法,量化得出的相关结论也可精确区分合用对疗效的改善类型,并能指出其相关联的作用机制。合用后,理论认为药动学和药效学均可影响疗效。本研究对临床治疗感染性肺炎的常见中西药合用阿奇霉素联合穿心莲内酯[4⁃5]采用微分量效方程的方法,从药效学的角度阐述其合用的临床机制。
1 材料
1.1 受试药物 穿心莲内酯对照品(成都埃法生物科技有限公司,批号AF8072353,纯度>99%);阿奇霉素对照品(北京索莱宝科技有限公司,批号810A031,纯度>99%)。
1.2 仪器 全自动细菌分析仪(Vitek 2compact,法国生物梅里埃公司);液相芯片仪(MAGPX12157001,美国Luminex 公司);生物安全柜(1300,美国Thermo Fisher Scientific 公司);导尿管(14,扬州市桂龙医疗器械有限公司);麦氏比浊仪(DEN⁃1,英国Grant Instruments 公司);细胞因子多指标液相芯片(RECYTMAG⁃65 K⁃07,美国Merck Millipore 公司);非线性混合效应群体药效药动计算软件Monolix(version 2019R2,法国Lixoft 公司)。
1.3 菌株 2018年12 月于攀枝花中心医院住院患者呼吸道送检痰液中分离,经全自动细菌分析仪鉴定为肺炎克雷伯菌Klebsiella Pneumoniae,纸片保存法保存于-80 ℃。试验前2 天,将含菌纸片紧密贴于无菌LB 琼脂培养基平板,37 ℃电热恒温培养箱中孵育18 h 以上。用无菌接种环圈选择单一并长势良好的菌团,均匀涂抹于新鲜LB 培养基平板,相同条件继续孵育18 h,得到足量、纯化的受试菌,备用。
1.4 动物 SD 大鼠,雄性,SPF 级,180~200 g,购于重庆恩斯维尔生物科技有限公司,动物生产许可证号SCXK(川)2018⁃0003,饲养于成都中医药大学药学院IVC 动物饲养实验室,恒温恒湿[(25±1)℃,80%]。
1.5 试剂 水解酪蛋白肉汤培养基(Mueller⁃Hinton,MH培养基,批号20171026)、普通肉汤培养基(Luria⁃Bertani Broth,LB 培养基,批号20190129)、胰蛋白胨大豆肉汤培养基(Tryptone Soy Broth,TSB 培养基,批号20190726)均购自青岛海博生物技术有限公司;乌来糖(批号20190726,成都市科龙化工试剂厂)。
2 方法
2.1 细菌感染性肺炎模型的构建 模型构建参考文献[6⁃7]。受试大鼠,随机分为空白组、模型组、穿心莲内酯组、阿奇霉素组、穿心莲内酯联合阿奇霉素低、中、高剂量组,共7组。将纯化后增毒肺炎克雷伯菌溶于2 mL 生理盐水中,振荡至完全分散,配置成终浓度为0.5 麦氏浓度(1×108CFU/mL)的悬液,并经麦氏比浊仪比浊确定。除空白组,其余动物20%乌来糖水溶液腹腔注射麻醉后,经气管导管注入配置好的细菌液400 μL(1×108CFU/mL),轻轻晃动大鼠身体确保菌液均匀分散至两侧肺部。同时观察呼吸以及心脏跳动情况,待大鼠苏醒并能活动后,装箱,将大鼠放回至IVC 独立换气笼中饲养。造模当天计为0 d,连续观察3 d,以大鼠出现寒颤、抓耳挠鼻、毛发浸湿,部分出现鼻腔、眼角出血为指征,提示造模成功。全程检测大鼠体质量和饮水饮食情况。最终,各造模组选取6 只感染性肺炎大鼠进入下一阶段实验。以上所有实验过程均严格按照国家《实验动物管理条例》 及《关于善待实验动物的指导性意见》 进行,并尽一切努力将动物的不适和痛苦降至最低。
2.2 给药 除空白组与模型组外,其余各组大鼠第3 天开始连续3 d 每日灌胃给药一次。剂量分组为穿心莲内酯组(40.5 mg/kg)、阿奇霉素组(4.5 mg/kg)、40.5 mg/kg 穿心莲内酯+4.5 mg/kg 阿奇霉素(联用高剂量组)、20.25 mg/kg穿心莲内酯+4.5 mg/kg 阿奇霉素(联用中剂量组)、10.125 mg/kg 穿心莲内酯+4.5 mg/kg 阿奇霉素(联用低剂量组)。
2.3 样本采集及检测 给药当天开始,每天中午10 时各组大鼠尾静脉采血,分离血清;于第6 天处死大鼠,取肺组织,用福尔马林固定,HE 染色后,行镜下病理检测。所有血清样本采用液相芯片检测IL⁃1β、IL⁃4、IL⁃6、TNF⁃α、IFNγ、IL⁃10、IL⁃17A 水平。
2.4 量效微分方程模型建立 近年来定量药理学对经典量效方程中疗效作用的评价从单时间点发展为治疗阶段的全过程检测,从而引入动力学处理的研究思路,可定量评价剂量⁃全疗程疗效的复杂情况[8]。同时,这一方法对联用药物合用结果的判定也具有较高的分辨能力[9]。参考以上方法,对不同剂量穿心莲内酯与固定剂量的阿奇霉素给药后建立了如下的量效关系微分动力学系统。
采用零级动力学描述细菌感染后大鼠血清中细胞因子生成,采用一级动力学描述细胞因子的消除,则细胞因子的经时变化,=k- ke×R 式中R 代表细胞因子水平,dR/dT 代表造模后细胞因子的变化率;k 为零级生成率,ke细胞因子的一级消除速度;单独使用阿奇霉素对细胞因子变化的抑制效应(Azm),采用经典抑制描述,=k×(1⁃Azm)⁃ke × R;单独使用穿心莲内酯对细胞因子变化的抑制效应(Andr)微分方程,=k×(1-Andr)⁃ke×R;穿心莲内酯与阿奇霉素合用后对细胞因子变化的抑制效应(Azm),如具有级联作用微分方程,=k×(1-Azm)×(1⁃Andr)⁃ke×R;如符合加和作用即采用的微分方程,=k×(1⁃Azm⁃Andr)⁃ke×R;以上加和作用具有交互作用即采用的微分方程,=k×(1⁃Azm⁃Andr⁃Azm×Andr)⁃ke×R。基于药物效应动力学理论,Andr 和Azm 可采用线性、对数线性、Emax以及Sigmod Emax不同的PD 模型拟合。
由于本实验用液相芯片法同时测定了7种细胞因子的水平,如所有细胞因子数据全部用于全模型比较和参数拟合,计算压力和时长均较大,也容易出现过拟合现象。因此,我们对全部个体所有时间点测定的细胞因子首先进行相关性分析,采用R3.11 中基础包的scatterplot 函数进行进入最终量效微分动力学参数拟合药效数据的筛选。确定药效指标后,所有个体的剂量⁃时间⁃细胞因子含量模型参数拟合按以上微分方程以非线性混合效应算法求解,模型中个体参数均假定服从对数正态分布,误差模型均采用线性比例模型。低于定量限的浓度点在拟合时标注为LLQ,于拟合时采用半定量已知加以处理。以⁃2 对数似然值(⁃2LL)、最小化信息量(AIC)、贝叶斯信息准则(BIC)、模型间Fisher 检验为主要拟合优度参数的标准,选择拟合优度最高的模型报道相关参数。所有组别,含空白(剂量数据设定为0)、模型(剂量数据设定为0)、阿奇霉素、穿心莲内酯、阿奇霉素联合穿心莲内酯各剂量组,所有个体数据采用一步法方法计算。
2.5 统计分析 实验数据采用SPSS 21.0 for windows 软件进行处理,计量资料以()表示,组间比较采用t检验。P<0.05 为差异统计学意义。
3 结果
3.1 一般药理学指标 造模及给药后,各组大鼠观测期间的体质量及饮水、饮食变化如图1 所示。结果表明感染后的各组大鼠均出现体质量、饮食和饮水量下降;模型组体质量在造模后呈连续下降趋势,其余5组大鼠在造模后第3 天即开始给药后体质量和饮水、饮食量呈上升趋势。联合用药的3组大鼠在给药后与空白组基本生理状态较为接近。

图1 各组大鼠实验时程中体质量、饮食和饮水量变化(n=6)
3.2 肺组织的病理检测 典型病理照片如下图2 所示,空白组动物肺组织各级支气管及肺泡组织结构均正常,未见明显组织病理学损伤。模型组动物肺组织结构消失,大量中性粒细胞浸润并填充整个肺泡腔及各级支气管,坏死崩解的中性粒细胞形成脓汁蓄积整个肺脏组织,呈典型的化脓性肺炎状态。各给药组相对模型组病理损伤均有显著改善,但给药组之间的统计无统计学差异。
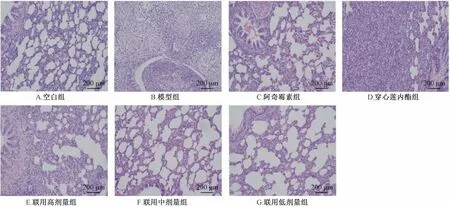
图2 各组大鼠给药3 d 后的肺部病理HE 染色图(HE×40)
3.3 血清中炎症因子水平 从图3 可见,造模后检测的7种细胞因子均升高,但随着模型动物的自我恢复,其数值出现明显的回复,因此从任一时间点评价药物的疗效强度均有不妥,这一现象采用含时间变量的动力学方程加以描述是系统性评价的良好手段。从图4 可见,IL⁃4、IL⁃6 和TNF⁃α 呈明显线性同步趋势,IL⁃1β 和IL⁃10 也呈现出较明显的线性趋势。提示以下步骤的动力学建模可以精简相关指标后进行。结合图3~4,考虑指标变化明显、剂量⁃效应梯度显著,最终选择IL⁃4 和IL⁃17 A 作为最终量效微分方程的药效学指标。
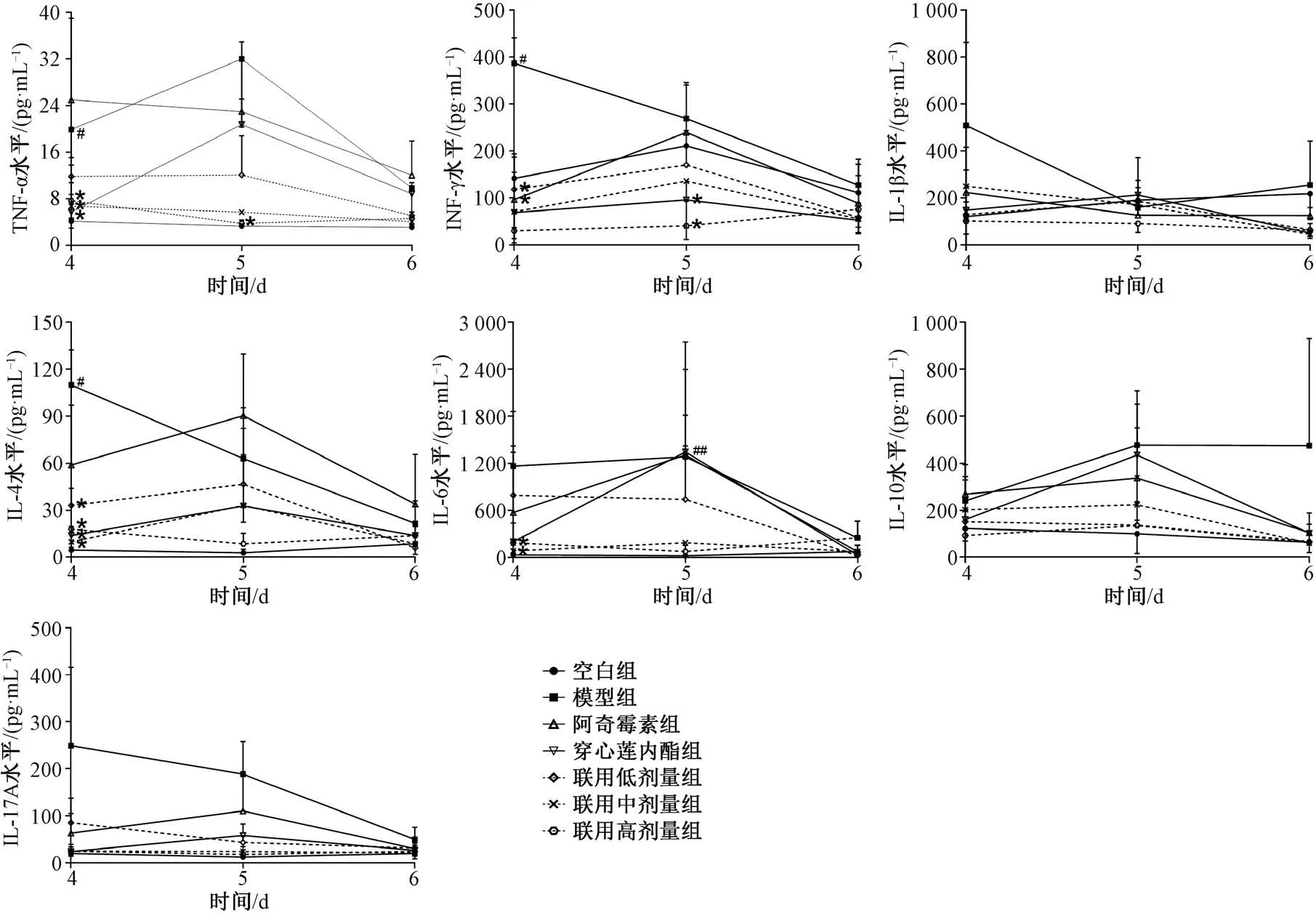
图3 观测时间段内各组大鼠各细胞因子时程图(n=6)

图4 炎症因子的相关性评价图
3.4 量效微分方程评价药物合用原理 采用非线性混合效应群体方法计算,模型竟争结果表明两种药物作用函数均为Emax×Dose/(IC50+Dose),即Emax型;合用组作用机制以加和性拟合较优。最终以IL⁃4 和IL⁃17A 为药效指标,一步求解所有个体时间、各药物剂量的量效微分方程组。最终模型拟合值与实测值比较图如图5 所示,表明采用的最终模型以较高的优度表征了两者合用对炎症因子抑制的合用机制,即合用以两者作用的相加为主,不具有级联放大作用,也不具有相互的交互影响。拟合参数如表1 所示。从表1 可见,对于IL⁃4 和IL⁃7 两炎症指标,穿心莲内酯的Emax值均大于阿奇霉素Emax值,提示穿心莲内酯效能优于阿奇霉素,特别是抑制IL⁃4 生成的作用;但是穿心莲内酯的IC50均大于5 mg/kg,说明药物要较大剂量时才能发挥最大效应,因此效价强度较差。
表1 量效微分方程模型拟合的穿心莲内酯和阿奇霉素合用对IL⁃4 和IL⁃17A 的效应参数表(, n=6)

表1 量效微分方程模型拟合的穿心莲内酯和阿奇霉素合用对IL⁃4 和IL⁃17A 的效应参数表(, n=6)

图5 量效微分方程拟合优度图
4 讨论
感染性肺炎已成为影响社会秩序的重大疾病,不论何种感染源,由于呼吸道的开放性和自身定殖菌的存在,几乎所有的患者疾病进展中均会合并一定的细菌感染。阿奇霉素由于其广谱、高效、良好的药物动力学性质和极好的安全性,已成为肺炎相关病的重要用药之一。近年来,除直接的抗菌作用外,阿奇霉素也被证实具有一定的抗炎作用[10]。其直接抗菌而间接降低炎症的刺激源,同时抑制STAT1 和NF⁃κB 等炎症通路,降低相应的炎症因子产生和分泌,避免机体出现严重的细胞因子风暴[11]。当肺部受到细菌侵袭时,机体全面启动免疫应答,诱发炎症。在炎症反应的早期阶段,TNF⁃α 是最早出现且最重要的炎症因子,可进一步激活免疫细胞[12];单核细胞和巨噬细胞合成IL⁃1β 介导外周循环的炎症因子在肺泡和肺间质聚集,加重炎症反应[13];IFN⁃γ 可增强免疫细胞活性[14];IL⁃4、IL⁃6、IL⁃10 发挥免疫刺激效应,是反映肺部感染及疾病严重程度的重要参考指标[15⁃17]。在此过程中,Th17细胞分泌的IL⁃17A 在中性粒细胞的增殖、成熟和趋化作用中扮演了重要角色,并与肺炎感染严重程度呈正相关[18]。
本研究结果显示,单独使用阿奇霉素可降低INF⁃γ、IL⁃10 和IL⁃17A 给药时程的整体浓度。在阿奇霉素给药中段TNF⁃α、IL⁃4、IL⁃6 的浓度具有反弹现象,这可能与其杀菌后死亡菌体刺激体内免疫反应,并强于其直接抗炎反应有关。合并使用穿心莲内酯后这一现象得到了极大缓解。既往研究表明穿心莲抗菌作用较差,但对炎症等体细胞反应在较低剂量时仍具有极强的抑制作用[19]。因此,抗菌药物与穿心莲内酯合用对感染性肺炎可能是双作用的整合,即抗菌药物发挥对抗感染源,降低肺部病原微生物数量,而穿心莲内酯作用于感染引起的机体炎症与免疫环节,减轻病理损伤,整体性地改善了患者的临床表现。本研究表明,引入穿心莲内酯可显著增加对相关炎症因子的分泌抑制,这一作用符合加和原理,即合用虽不产生级联放大的增效作用,但也没有影响疗效的交互影响。
同时,本研究表明穿心莲内酯与阿奇霉素的作用强度存在显著区别。对IL⁃4,穿心莲内酯的价效约为阿奇霉素的200 倍。但两者针对IL⁃17 A 的作用强度相似。模型揭示穿心莲内酯的IC50较大,效价强度较低,具有低效价高效应的作用特点。这也说明了穿心莲内酯在保证足够的给药量或改善相关生物利用度后,其最终作用仍较为明显。提示中药应用时,相关量效的研究具有重要的临床指导价值,基于量效微分药效动力学的群体建模与参数拟合可以较准确的获取具有参考意义的相关参数,可作为一个判断药物联用合理性的一个重要应用方法加以深入探索。
