黄芩苷通过调节miR⁃223⁃3p/NLRP3 通路对脓毒症急性肺损伤大鼠的保护作用
2021-08-23李长力郑喜胜贾明雅
李长力郑喜胜贾明雅
(河南省南阳市中心医院重症医学科,河南 南阳473000)
脓毒症是导致危重病房患者死亡的常见原因之一,多发于休克、严重烧伤、创伤、感染和大手术后,可引发全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)[1]。肺部是因SIRS 最早受累的器官,急性肺损伤(acute lung injury,ALI)是脓毒症患者常见的并发症之一[2]。ALI 与炎症相关,其进程伴随促炎因子大量释放,抗炎因子/促炎因子水平失衡是促进ALI 发展的关键因素[3⁃4]。黄芩苷是一种从唇形科植物黄芩根中提取而来的黄酮类成分,具有抗炎、抗氧化、抗肿瘤、抗纤维化等药理作用[5⁃6]。NOD 样受体蛋白3(NOD⁃like receptor protein 3,NLRP3)参与炎症反应,并在ALI 大鼠肺组织高表达[7]。微小RNA(microRNA,miRNA)可与靶基因3′⁃UTR 配对结合,参与机体生理进程,miR⁃223⁃3p 过表达可抑制促炎症因子表达[8]。本研究通过构建脓毒症ALI大鼠模型,使用不同剂量黄芩苷处理后,测定相关指标,旨在从miR⁃223⁃3p/NLRP3 通路揭示黄芩苷对脓毒症ALI 大鼠的保护作用,为黄芩苷在临床上治疗ALI 提供理论依据。
1 材料
黄芩苷(货号B20570⁃100 mg,纯度≥98%)、地塞米松(货号B25793⁃100 mg,纯度≥98%)均购自上海源叶生物科技有限公司;白细胞介素1β(interleukin⁃1β,IL⁃1β,货号E⁃EL⁃R0012c)、白细胞介素 10(interleukin⁃10,IL⁃10,货号E⁃EL⁃R0016c)、肿瘤坏死因子α(tumor necrosis factor⁃α,TNF⁃α,货号E⁃EL⁃R0019c)ELISA 试剂盒均购自南京建成生物工程研究所;兔抗鼠NLRP3 一抗(货号orb319065)购自武汉博欧特生物科技有限公司;兔抗鼠内参β⁃Actin(货号AP0060)、羊抗兔IgG/HRP 二抗(货号BD5003)均购自厦门研科生物技术有限公司;ZF⁃388 全自动凝胶成像分析系统购自深圳市三利化学品有限公司;XSP⁃9CA型生物显微镜购自上海光学仪器厂。SPF 级雄性Wistar 大鼠购自广州中医药大学实验动物中心,体质量220~250 g,7 周龄,动物使用许可证号SYXK(粤)2018⁃0001。
2 方法
2.1 造模、分组与给药 适应性饲养1 周后根据文献采用盲肠结扎穿孔法(CLP)建立脓毒症ALI大鼠模型[9]。大鼠术前不需禁食,以1.25 g/kg 剂量乌拉坦腹腔注射麻醉大鼠,取仰卧位固定,备皮,75%乙醇消毒,用手术剪沿腹正中线剪开约2 cm长的切口,分离肠系膜,暴露盲肠,用丝线结扎回盲肠瓣下方盲肠根部位置,用18号针头穿透结扎端盲肠,挤出粪便及肠内容物于腹腔内,随后将肠管收回腹腔,缝合,消毒。大鼠造模后6 h 出现竖毛、呼吸困难、腹泻、躁动、爪趾青紫、萎靡等症状,说明造模成功。实验分为假手术组(手术开腹后,仅暴露盲肠,随后缝合)、模型组、地塞米松组(0.27 mg/kg)[10]、低剂量黄芩苷组(10 mg/kg)、中剂量黄芩苷组(50 mg/kg)、高剂量黄芩苷组(100 mg/kg)[11],每组18 只。造模6 h后,腹腔注射给药(给药量2 mL/kg),假手术组和模型组注射等量生理盐水。
2.2 ELISA 测定大鼠血清TNF⁃α、IL⁃1β、IL⁃10水平 给药24 h 后,鼠尾抽血,离心后分离血清,置于-20 ℃冰箱中保存。从-20 ℃冰箱中取出各组大鼠血清,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定各组大鼠血清TNF⁃α、IL⁃1β、IL⁃10 水平,测定步骤严格按照试剂盒说明书进行。
2.3 大鼠肺组织病理学观察 各组任意选取6 只大鼠立刻脱颈处死,左肺组织用4% 多聚甲醛固定,将固定后的左肺组织用石蜡常规包埋,制成厚度4~6 μm 切片,行HE 染色,封片后在光学显微镜下参考王宝家等[12]改良版肺组织病理评分标准(见表1),观察各组大鼠肺组织病理改变情况并进行肺组织病理评分。
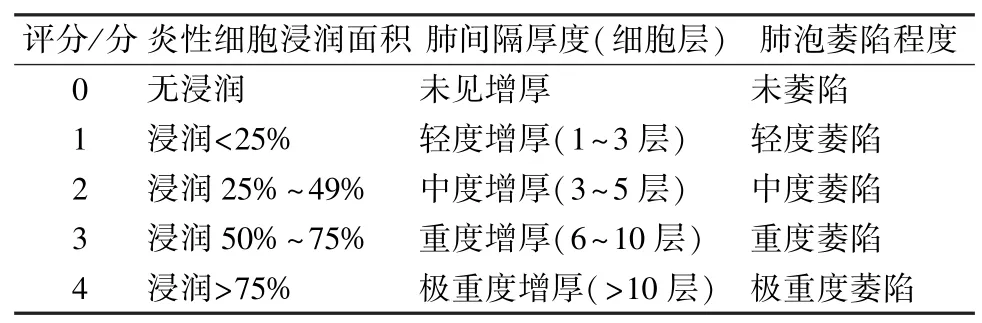
表1 肺组织病理评分标准Tab.1 Criteria for scoring of pulmonary pathology
2.4 大鼠肺组织含水量测定 取右肺组织用于测定肺组织含水量,用天平称量左肺组织湿质量(wet weight,WW),然后放入60 ℃烘箱烘干,称定其干质量(dry weight,DW),计算WW/DW比值以表示肺组织含水量。WW/DW比值=(WWDW)/DW。
2.5 大鼠AFC值测定 各组任意选取6 只大鼠脱颈处死,分离出全部气管、肺脏及心脏用于测定肺泡液体清除率(alveolar fluid clearance,AFC)。将气管导管插入右下肺,以4 mL/kg 剂量将5%白蛋白(0.15 mg 伊文思蓝标记)等渗生理盐水灌注液经气管导管滴入右肺下叶,随后给予2 mL 氧气,以确保灌注液顺利到达肺部。保持全氧,维持气道压在650~700 Pa 之间,持续通气1 h。最后取0.2 mL右下肺液体,测定620 nm 处吸光度值并根据公式计算AFC。AFC% =(灌入肺泡内液体量-肺泡内剩余液体量);泡内剩余液体量=灌入肺泡内液体量×最初蛋白浓度/最终蛋白浓度。
2.6 RT⁃qPCR 测定大鼠肺组织miR⁃223⁃3p表达剩余6 只大鼠脱颈处死,分离左肺组织,用于测定miR⁃223⁃3p表达。取左肺组织,加入匀浆液,充分匀浆,离心后取上清,用RNA 提取试剂盒提取总RNA,行逆转录得cDNA,反应体系为5×AMV buffer 2.0 μL,RNA(1.0 μg/μL)1.0 μL,DEPC water 2.0 μL,reverse primer(50 pmol/μL)0.5 μL,2.5 mmol/L each dNTP mixture 4.0 μL,AMV enzyme 0.5 μL。行RT⁃qPCR 反应,体系共20 μL为正反向引物各0.5 μL,去离子水4.0 μL,cDNA
5.0 μL,2 × SYBR Green PCR Master Mix 10.0 μL。反应程序为95 ℃5 min,95 ℃15 s、60 ℃34 s,40个循环,75 ℃5 min。miR⁃223⁃3p正向引物序列5′⁃GGGGTGTCAGTTTGTCAAA⁃3′,反向引物序列5′⁃CAGTGCGTGTCGTGGAGT⁃3′;内参U6 正向引物序列5′⁃ATTGGAACGATACAGAGAAGATT⁃3′,反向引物序列5′⁃GGAACGCTTCACGAATTTG⁃3′。采 用2-ΔΔCT法对miR⁃223⁃3p 表达行定量分析。
2.7 蛋白印迹法测定大鼠肺组织NLRP3 表达 取右肺组织测定NLRP3 表达,加入蛋白裂解液充分裂解,离心后取上清,提取总蛋白并测定浓度。电泳分离目标蛋白,转到PVDF 膜上,用5%BSA 封闭,分别加入相应兔抗鼠NLRP3、β⁃actin 一抗(1∶1 000)孵育24 h,加入羊抗兔IgG/HRP 二抗孵育2 h,显色,测定条带灰度值,蛋白相对表达=目标蛋白灰度值/内参蛋白灰度值。
2.8 统计学分析 通过SPSS 22.0 软件进行处理,数据以()表示,多组比较采用单因素方差分析,2组间比较采用SNK⁃q 检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 大鼠血清IL⁃1β、IL⁃10、TNF⁃α 水平 与假手术组比较,模型组大鼠血清IL⁃1β、TNF⁃α 水平升高(P<0.05),IL⁃10 水平降低(P<0.05);经黄芩苷治疗后,随着给药剂量增高,IL⁃1β、TNF⁃α 水平依次降低(P<0.05),IL⁃10 水平依次升高(P<0.05);高剂量黄芩苷组IL⁃1β、IL⁃10、TNF⁃α水平与地塞米松组比较差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清IL⁃1β、IL⁃10、TNF⁃α 水平比较(, n=18)Tab.2 Comparison of serum levels of IL⁃1 β, IL⁃10 and TNF ⁃α in rats of each group(, n=18)

表2 各组大鼠血清IL⁃1β、IL⁃10、TNF⁃α 水平比较(, n=18)Tab.2 Comparison of serum levels of IL⁃1 β, IL⁃10 and TNF ⁃α in rats of each group(, n=18)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与低剂量黄芩苷组比较,▲▲P<0.01;与中剂量黄芩苷组比较,△P<0.05,△△P<0.01。
3.2 大鼠肺组织病理学变化 与假手术组比较,模型组大鼠肺泡完整性破坏,可见大部分肺泡萎陷,肺间质增厚,可见明显水肿,并伴有大量炎症细胞浸润,肺组织病理得分升高(P<0.01)。经黄芩苷治疗后,大鼠肺泡结构有所恢复,肺间质水肿缓解,炎症细胞浸润减少,且呈剂量依赖性,肺组织病理得分随剂量升高依次降低(P<0.01)。高剂量黄芩苷组大鼠肺组织病理改变情况与地塞米松组相当,肺组织病理得分与地塞米松组比较差异无统计学意义(P>0.05)。见图1、表3。

图1 各组大鼠肺组织HE 染色(×100)Fig.1 Pulmonary morphology of rats in each group by HE staining(×100)
表3 各组大鼠肺组织病理评分比较(, n=6)Tab.3 Comparison of pulmonary pathological scores of rats in each group(, n=6)

表3 各组大鼠肺组织病理评分比较(, n=6)Tab.3 Comparison of pulmonary pathological scores of rats in each group(, n=6)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与低剂量黄芩苷组比较,▲▲P <0.01;与中剂量黄芩苷组比较,△△P<0.01。
3.3 大鼠肺组织含水量 与假手术组比较,模型组大鼠WW/DW比值升高(P<0.01);经黄芩苷治疗后,随着给药剂量增高,WW/DW比值依次降低(P<0.01);高剂量黄芩苷组WW/DW比值与地塞米松组比较差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠肺组织WW/DW 比值比较(, n=6)Tab.4 Comparison of pulmonary WW/DW ratio of rats in each group(, n=6)

表4 各组大鼠肺组织WW/DW 比值比较(, n=6)Tab.4 Comparison of pulmonary WW/DW ratio of rats in each group(, n=6)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与低剂量黄芩苷组比较,▲▲P <0.01;与中剂量黄芩苷组比较,△△P<0.01。
3.4 大鼠AFC值 与假手术组比较,模型组大鼠AFC值降低(P<0.01);经黄芩苷治疗后,随着给药剂量增高,AFC值依次升高(P<0.01);高剂量黄芩苷组AFC值与地塞米松组比较差异无统计学意义(P>0.05)。见表5。

表5 各组大鼠AFC值比较(%, x ±s, n=6)Tab.5 Comparison of AFC values of rats in each group(%, x ±s, n=6)
3.5 大鼠肺组织miR⁃223⁃3p、NLRP3 表达 与假手术组比较,模型组大鼠肺组织miR⁃223⁃3p表达降低,NLRP3 表达升高(P<0.05);经黄芩苷治疗后,随着给药剂量增高,miR⁃223⁃3p表达依次升高,NLRP3 表达依次降低(P<0.05,P<0.01);高剂量黄芩苷组miR⁃223⁃3p、NLRP3 表达与地塞米松组比较差异无统计学意义(P>0.05)。见图2、表6。

图2 各组大鼠肺组织NLRP3 表达比较Fig.2 Comparison of pulmonary NLRP3 expressions of rats in each group
表6 各组大鼠肺组织miR⁃223⁃3p、NLRP3 表达比较(, n=6)Tab.6 Comparison of pulmonary miR⁃223⁃3p and NLRP3 expressions of rats in each group(, n=6)

表6 各组大鼠肺组织miR⁃223⁃3p、NLRP3 表达比较(, n=6)Tab.6 Comparison of pulmonary miR⁃223⁃3p and NLRP3 expressions of rats in each group(, n=6)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01;与低剂量黄芩苷组比较,▲P<0.05,▲▲P<0.01;与中剂量黄芩苷组比较,△△P<0.01。
4 讨论
中医学认为ALI 属于“外感热病”,符合“温热病”的范畴[13]。近年来,中草药的药理作用受到广泛关注,黄芩苷因具有抗炎作用而有望成为治疗ALI 的候选药物,因此本研究通过构建脓毒症ALI 大鼠模型,探究黄芩苷治疗ALI 的作用机制。大鼠造模后6 h 出现竖毛、呼吸困难、腹泻、躁动、爪趾青紫、萎靡等症状,表明造模成功可用于后续实验。
炎症反应伴随ALI 进程,研究发现,黄芩苷可下调NLRP3 水平及促炎因子IL⁃1β、IL⁃6 水平,以缓解轻度抑郁症大鼠脑皮层炎症反应[14]。此外,黄芩苷对急性损伤器官具有保护作用,可显著减少马兜铃酸诱导的小鼠肾脏细胞凋亡并缓解肾脏损伤[15]。本研究发现,经黄芩苷治疗后,脓毒症ALI 大鼠肺泡结构有所恢复,肺间质水肿缓解,炎症细胞浸润减少,肺组织病理评分降低,且呈剂量依赖性。AFC 是由肺泡内的肾上腺素受体控制,是反应肺组织间质稳态的指标,亦可反映肺间质水肿情况,与肺功能联系紧密[16]。本研究发现,黄芩苷可减少脓毒症ALI 大鼠肺组织含水量,提升AFC值,提示黄芩苷可改善脓毒症ALI 大鼠症状,改善肺损伤,恢复肺功能。IL⁃1β 和TNF⁃α 是常见的促炎症因子,TNF⁃α 主要表达在中性粒细胞、淋巴细胞和巨噬细胞胞浆中,能够引起炎症细胞聚集,合成并释放IL⁃1β,参与炎症反应,IL⁃10 释放可抑制促炎症因子释放,抑制炎症反应[17⁃18]。Yang 等[18]发现IL⁃1β 和TNF⁃α 在脓毒症ALI 大鼠肺组织表达上调,可用于反映病情程度。另外,上调抑炎因子IL⁃10 水平,下调促炎因子IL⁃6 水平可抑制肺泡巨噬细胞及中性粒细胞聚集,可有效控制肺部炎症反应[19]。本研究发现,与假手术组比较,模型组大鼠血清IL⁃1β、TNF⁃α 水平升高,IL⁃10 水平降低,说明脓毒症ALI 模型大鼠发生炎症反应,可能造成炎症损伤。经黄芩苷治疗后,IL⁃1β、TNF⁃α 水平降低,IL⁃10 水平升高,提示黄芩苷可调整促炎因子/抑炎因子平衡,缓解脓毒症ALI 模型大鼠炎症反应。但是黄芩苷通过何种信号通路缓解炎症反应还需进一步探究。
NLRP3 炎症小体通路参与炎症调控进程,Luo等[20]发现血红素加氧酶⁃1 可抑制肺组织NLRP3、NF⁃κB 活性,减弱肺组织和血清IL⁃1β 和IL⁃18分泌,可用于治疗脓毒症ALI 大鼠。Yin 等[21]发现,异氟烷以活性氧依赖性方式降低NLRP3 活性,下调IL⁃1β、IL⁃18 mRNA 表达,以减轻脂多糖诱导的脓毒症ALI 大鼠肺组织病理学损伤、水肿和血管通透性。经黄芩苷治疗后,大鼠肺组织NLRP3 水平降低,提示黄芩苷可能通过抑制NLRP3 炎症小体活性,以缓解炎症损伤。miRNA 可靶向调控靶基因,而NLRP3 是miR⁃223⁃3p 的直接靶标,上调miR⁃223⁃3p 水平,可抑制NLRP3 活性[22]。本研究发现,经黄芩苷治疗后,大鼠肺组织miR⁃223⁃3p升高,提示黄芩苷可能通过上调miR⁃223⁃3p 表达,抑制NLRP3 活性,进而抑制炎症反应。
综上所述,黄芩苷可通过下调促炎因子IL⁃1β、TNF⁃α 水平,上调抑炎因子IL⁃10 水平,以缓解脓毒症ALI 大鼠肺损伤,可能与miR⁃223⁃3p/NLRP3 通路有关。
