枳实通降颗粒通过干预MK2 磷酸化抑制炎症反应防治术后炎性肠梗阻相关性肺损伤
2021-08-23黎李王华帅何永恒
莫 黎李 倩 王华帅 李 莹 黄 丽 何永恒
(1.湖南中医药大学第二附属医院,湖南 长沙410005; 2.湖南中医药大学,湖南 长沙410208; 3.湖南省中医药研究院附属医院,湖南 长沙410006)
肺部感染是腹部手术后的常见并发症之一[1],直接影响患者的术后康复,甚至危及患者的生命安全[2]。术后炎性肠梗阻(postoperative ileus,POI)是腹部尤其是肠道手术后无法避免的一个特殊时期或并发症,其持续时间的长短与术后患者肺部感染的发生具有一定的相关性[3⁃4]。手术创伤等导致的炎症反应不但是POI 的主要原因,其激发的瀑布式炎症反应也是造成肺脏损伤的重要原因[5]。因此,有效地防治POI,促进术后胃肠功能的早期恢复对预防术后肺部感染的发生,保障术后患者的顺利康复具有重要的临床意义[6]。
在前期的研究中证实,枳实通降颗粒不但能显著地促进结直肠肿瘤术后胃肠功能的恢复,有效地预防术后早期炎性肠梗阻的发生,并且对肺部感染的发生也有一定的防治作用[7]。为进一步论证及探明其可能的作用机制,本实验以POI 模型大鼠为研究对象,观察枳实通降颗粒对大鼠肺组织的MK2 磷酸化的影响,探讨其保护POI 相关性肺损伤的作用及可能机制,以期为该药的进一步开发和应用提供参考。
1 材料
1.1 动物 鼠龄6 周的SPF 级SD 大鼠84 只,雌雄各半,体质量180~220 g,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号SCXK(湘)2016⁃0002。饲养于湖南中医药大学动物实验中心实验室,实验动物使用许可证号SYXK(湘)2019⁃0009,适应性喂养1 周后开始实验。本实验已经湖南中医药大学实验动物理论委员会批准(LL2019092005)。
1.2 药物 专利方枳实通降颗粒[8]由枳实10 g、乌药10 g、大腹皮10 g、广木香10 g、黄柏10 g、泽泻12 g、三七6 g、西洋参6 g、川牛膝12 g、甘草6 g组成。中药饮片购自湖南中医药大学第二附属医院门诊中药房(湖南新汇制药厂生产),并由周平兰教授鉴定合格,按照传统法水煎浓缩成生药含量为3.4 g/mL 的药液,置于冰箱冷藏备用。琥珀酸普芦卡必利片(意大利Janssen Cilag S.p.A.公司生产,2 mg×7 片/盒,批号JGL6E00),将其制备成含药量为0.036 mg/mL 的混悬液。
1.3 试剂 IL⁃6、IL⁃8、TNF⁃α 试剂盒(上海晶天生 物,批号E20200103010、E20200103011、E20200103012);彩色预染蛋白标志物(美国Thermo 公司,货号26616);BCA 蛋白浓度测定试剂盒、化学发光检测试剂盒(北京康为世纪生物科技有限公司,货号CW0014S、CW0049);羊抗鼠二抗、羊抗兔二抗(美国PROTEINTECH 公司,货号SA00001⁃1、SA00001⁃2);髓过氧化物酶(MPO)试剂盒(南京建成海浩生物科技有限公司,货号A044⁃1⁃1)。引物[生工生物工程(上海)股份有限公司,221020117];逆转录试剂盒及PCR 试剂盒(美 国Promega 公 司,A3500、A6001);Trizol(美国Invitrogen 公司,15596018);Protein G Magnetic Beads(美国Cell Signaling 公司,9006S);蛋白质标志 物(美国 Thermo 公 司,26634);HE 染液(珠海贝索生物技术有限公司)。
1.4 仪器 紫外分光光度计(上海现科仪器有限公司);酶标仪(芬兰雷勃公司);全自动化学发光分析仪(上海天能生命科学有限公司);电泳仪、Real⁃time PCR 仪(美国BIO⁃RAD 公司);灰度分析软件(美国Alpha Innotech 公司);液基薄层细胞制片仪(武汉宏翔惠康生物制品有限公司)。
2 方法
2.1 造模与分组 84 只SD 大鼠按照随机数字表法随机分为7组:空白组,假手术组,模型组,枳实通降颗粒低、中、高剂量组和普芦卡必利组,每组各12 只,雌雄各半,分别于术后24 h 取材。所有大鼠于术前禁食24 h,禁水12 h,术后禁食不禁水。根据前期造模实验选择最优的造模方法为3%戊巴比妥钠(3 mL/kg 体质量腹腔注射麻醉大鼠)麻醉大鼠并固定,常规消毒铺无菌单,逐层开腹,找到盲肠,沿盲肠根部结扎并切除结扎部分盲肠,用两根盐水棉签自空肠起始部开始夹持并轻轻向远心端摩擦小肠壁,至回盲部为止,只处理1 次,然后回纳小肠,分两层关腹,整个手术过程约15 min左右;假手术组仅分层打开腹腔,然后用盐水纱布覆盖,15 min 后分两层关腹。
2.2 给药 造模术后6 h,所有大鼠均按5 mL/kg给药量标准一次性灌胃给药。根据大鼠体表面积换算确定给药剂量,枳实通降颗粒低、中、高剂量组分别按照4.2、8.3、16.6 g/kg 的标准给予中药浓缩药液,普芦卡必利组按照0.18 mg/kg 给药[9],空白组、假手术组、模型组则给予等量生理盐水。
2.3 标本采集及指标检测 术后24 h 再次麻醉后心尖取血处死大鼠,打开腹腔及胸腔采集标本后进行分别检测。
2.3.1 HE 染色观察肺组织病理形态学改变 取右肺下叶,固定、包埋、切片,苏木精伊红(HE)染色,光镜下观察肺组织病理形态学改变情况,并采用美国胸科协会肺损伤评分标准[5]进行评分,主要指标为肺泡上皮的损伤程度、炎症细胞的浸润、肺泡隔的厚度等,总分数为0~5分。见表1。
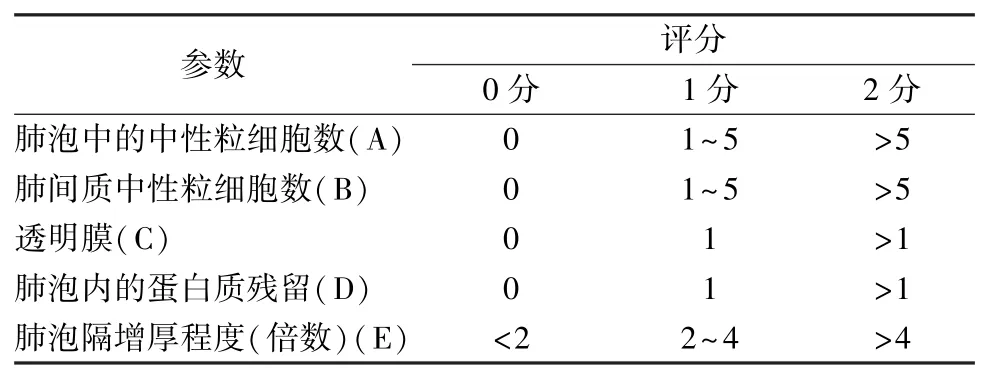
表1 肺损伤病理学评分标准Tab.1 Pathology criteria for scoring of lung injury
2.3.2 支气管肺泡灌洗液(BALF)肺泡中性粒细胞、巨噬细胞及淋巴细胞数量计算 将大鼠胸腔和颈部打开,显露气管及双侧主支气管,夹闭右主支气管及近咽喉处远端气管,将右肺标本取下。于主支气管夹闭处近端穿入的5#头皮针管,以5 mL 无热原生理盐水灌入左肺,保留9 s 后回收,再次注入并重复3 次,汇集3 次的肺泡灌洗液,立即以4 500 r/min 离心10 min,弃上清,用Hank’s 液洗细胞1 次,再离心,弃去上清液,HE 染色后,针对每份标本,在光学显微镜下取10个高倍镜视野统计细胞总数,并进行细胞分类(吞噬细胞、中性粒细胞、淋巴细胞)计数。
2.3.3 ELISA 法检测肺组织IL⁃6、IL⁃8、TNF⁃α 的水平及MPO 活性 取出右中上肺叶标本,-80 ℃冰箱保存,粉碎、匀浆、离心后取上清液,检测肺组织中IL⁃6、IL⁃8、TNF⁃α 水平;参照过氧化物酶(MPO)试盒说明书操作检测MPO 活性,MPO 活力(U/g)=(测定OD值-对照OD值)/(11.3×参与反应血清量)。
2.3.4 Western blot、RT⁃PCR 检测肺组织MK2、p⁃MK2 蛋白及mRNA 表达 取各组大鼠右下肺叶标本,按照以下步骤进行检测:提取组织总蛋白,BCA 法测蛋白浓度,SDS⁃PAGE 电泳,转膜,依次加入一抗及二抗进行免疫反应,化学发光并用显影,定影试剂进行显影和定影,PhotoShop 整理去色,Alpha 软件处理系统分析目标带的光密度值。观察肺组织中MK2 及p⁃MK2 蛋白表达情况。按照PCR 剂盒说明书操作,提取所得肺组织中总的RNA,进行扩增后检测并计算MK2、p⁃MK2 mRNA的表达情况。见表2。
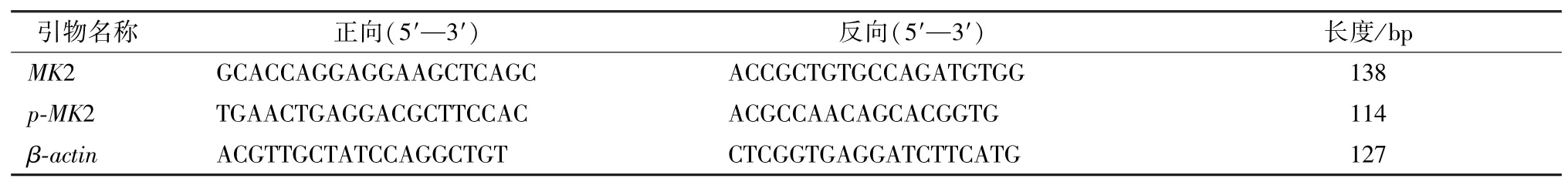
表2 PCR 引物序列Tab.2 PCR primer sequences
2.4 统计学分析 通过SPSS 21.0 软件进行统计学分析,计量资料以()表示,如符合正态分布和方差齐性,则采用单因素方差分析进行多组比较,组间比较采用LSD 法分析;如不符合正态分布及方差齐性,则采用Kruskal⁃Wallis H 检验。以P<0.05 为差异具有统计学意义。
3 结果
3.1 肺组织病理形态学及评分 模型组肺组织结构破坏明显,肺间质和肺泡腔中有明显的中性粒细胞浸润,肺间隔明显增宽,偶见少量的蛋白质残留物组,枳实通降颗粒中、高剂量组大鼠肺组织结构破坏减轻,肺间隔无明显增宽,肺泡腔和肺间质内中性粒细胞渗出减少。模型组与空白组及假手术组比较,评分升高(P<0.01);药物干预各组与模型组比较,各干预组病理结构改变相对较轻,以枳实通降颗粒高、中剂量为明显(P<0.05,P<0.01),其次为低剂量组及普芦卡必利组,但无统计学意义(P>0.05)。见图1、表3。
表3 各组大鼠肺组织病理学评分比较(, n=12)Tab.3 Comparison of pulmonary histopathological scores of each group(, n=12)

表3 各组大鼠肺组织病理学评分比较(, n=12)Tab.3 Comparison of pulmonary histopathological scores of each group(, n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与枳实通降颗粒低剂量组比较,☆☆P<0.01;与普芦卡必利组比较,△△P<0.01。

图1 枳实通降颗粒对大鼠肺组织病理形态学改变的影响(HE, ×100)Fig.1 Effects of Zhishi Tongjiang Granules on pulmonary pathomorphological changes of rats(HE, ×100)
3.2 枳实通降颗粒对模型大鼠肺组织IL⁃6、IL⁃8、TNF⁃α 水平的影响 与假手术组及空白组比较,模型组肺组织中炎性因子水平偏高(P<0.01);与模型组比较,各药物干预组炎性因子水平偏低(P<0.01),以枳实通降颗粒中、高剂量效果最明显,优于其他药物干预组(P<0.05,P<0.01),见表4。
表4 各组大鼠肺组织中炎症因子IL⁃6、IL⁃8、TNF⁃α 水平比较(, n=12)Tab.4 Comparison of pulmonary inflammatory factors IL⁃6, IL⁃8 and TNF⁃α in rats of each group(, n=12)

表4 各组大鼠肺组织中炎症因子IL⁃6、IL⁃8、TNF⁃α 水平比较(, n=12)Tab.4 Comparison of pulmonary inflammatory factors IL⁃6, IL⁃8 and TNF⁃α in rats of each group(, n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,##P<0.01;与枳实通降颗粒低剂量组比较,☆☆P<0.01;与普芦卡必利组比较,△P<0.05,△△P<0.01。
3.3 枳实通降颗粒对模型大鼠肺泡灌洗液中性粒细胞、巨噬细胞、淋巴细胞计数的影响 与假手术组及空白组比较,模型组肺泡灌洗液中炎性细胞计数偏高(P<0.01);与模型组比较,各药物干预组炎性细胞计数偏低(P<0.01),以枳实通降颗粒中、高剂量效果最明显,优于其他药物干预组(P<0.05,P<0.01),见表5。
表5 各组大鼠肺泡灌洗液中炎性细胞计数比较(, n=12)Tab.5 Comparison of inflammatory cell counts in BALF of rats in each group(, n=12)

表5 各组大鼠肺泡灌洗液中炎性细胞计数比较(, n=12)Tab.5 Comparison of inflammatory cell counts in BALF of rats in each group(, n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,##P<0.01;与枳实通降颗粒低剂量组比较,☆☆P<0.01;与普芦卡必利组比较,△P<0.05,△△P<0.01。
3.4 枳实通降颗粒对各组大鼠肺组织中MK2、p⁃MK2 蛋白及mRNA 表达情况及MPO 活性的影响 与空白组及假手术组比较,模型组小肠组织p⁃MK2 蛋白及mRNA 的表达、MPO 活性偏高(P<0.01);各药物干预组p⁃MK2 蛋白的表达水平、MPO 活性低于模型组(P<0.01),以枳实通降颗粒中、高剂量组最明显,与普芦卡必利组及低剂量组比较,差异有统计学意义(P<0.01)。各组MK2 蛋白及mRNA 的表达无统计学差异(P>0.05)。见图2、表6~7。
表6 各组大鼠肺组织中MK2 及p⁃MK2 蛋白表达情况及MPO 活性情况比较(, n=12)Tab.6 Comparison of pulmonary MK2 and p⁃MK2 protein expression and MPO activity of rats in each group(, n=12)

表6 各组大鼠肺组织中MK2 及p⁃MK2 蛋白表达情况及MPO 活性情况比较(, n=12)Tab.6 Comparison of pulmonary MK2 and p⁃MK2 protein expression and MPO activity of rats in each group(, n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,##P<0.01;与枳实通降颗粒低剂量组比较,☆☆P<0.01;与普芦卡必利组比较,△△P<0.01。

图2 枳实通降颗粒对各组大鼠肺组织中MK2、p⁃MK2蛋白表达的影响Fig.2 Effects of Zhishi Tongjiang Granules on the expression of pulmonary MK2 and p⁃Mk2 protein of rats in each group
4 讨论
表7 各组大鼠肺组织中MK2 及p⁃MK2 mRNA 表达情况比较(, n=12)Tab.7 Comparison of pulmonary MK2 and p⁃MK2 mRNA expression of rats in each group(, n=12)
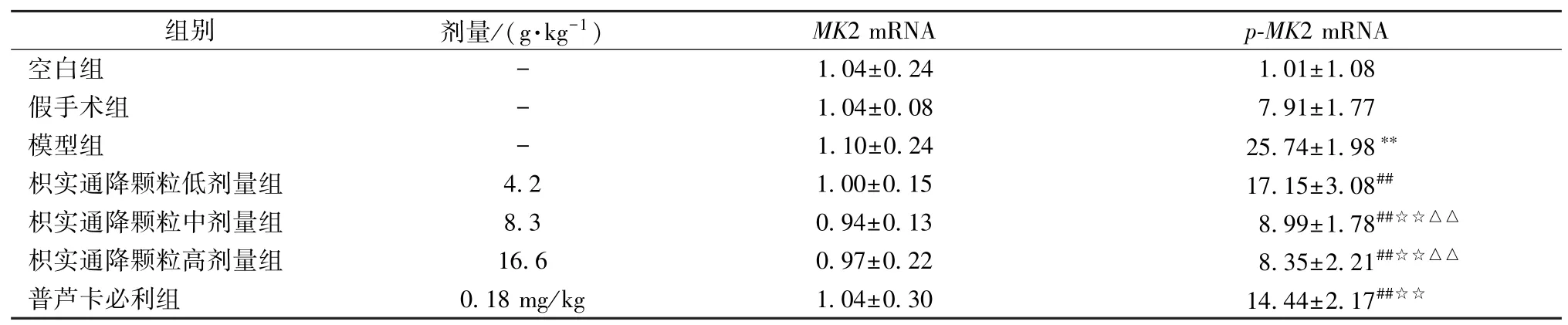
表7 各组大鼠肺组织中MK2 及p⁃MK2 mRNA 表达情况比较(, n=12)Tab.7 Comparison of pulmonary MK2 and p⁃MK2 mRNA expression of rats in each group(, n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,##P<0.01;与枳实通降颗粒低剂量组比较,☆☆P<0.01;与普芦卡必利组比较,△△P<0.01。
《灵枢·本输》曰:“肺合大肠,大肠者,传导之府”,五脏之肺与六腑之大肠互为表里,关系密切,是中医藏象学说的主要理论之一。肺与大肠不但在解剖上紧密联系,在生理和病理上也很容易相互影响。如《灵枢·四时气》有云,“腹中常鸣,气上冲胸,喘不能久立,邪在大肠。”二者在生理上相互依存,病理上相互传变,治疗上相互为用。《黄帝内经灵枢集注》 云,“大肠为肺之腑而主大便,……故大肠之病,亦能上逆而反遗于肺。”临床上当大肠有病时,往往会影响到肺,导致肺脏出现相应的病变,而肠道手术自然也会影响到肺,这也从中医理论上阐明了临床结直肠肿瘤手术后容易并发肺部感染的机理[10]。
研究证实[11⁃12],肺与肠道关系密切,不但在组胚生理上具有共源性,病理生理上也相互影响。二者的黏膜上皮细胞均来自胚胎时期的内胚层,且黏膜免疫因子具有同步性,通过淋巴系统归巢等途径相互联系,共同发挥局部特异性免疫功能,是人体的黏膜免疫系统的主要构成部分。肠道有病,肠源性有害因素可经肠道和全身循环淋巴管、血管循环系统到达肺部,导致肺部炎症反应;同时,肠道功能的障碍,也会影响机体营养的摄入,降低机体免疫力,容易造成术后肺部感染的易发。肺与大肠之间相互影响作用,形成了肺⁃肠轴联动学说的主要解剖和病理生理学基础,这也是结直肠肿瘤手术后肺部感染易发性的病理生理学基础。而肺泡液中的一些炎症因子也与肺部感染的发生密切相关,如检测肺泡灌洗液中IL⁃6 水平及白细胞分类计数对早期肺炎的临床诊断就具有重要临床意义,其敏感性要优于血液降钙素原检测[13]。因此,抑制手术造成的炎症反应,促进胃肠功能恢复对防治腹部大手术后肺部感染具有重要意义。
手术操作诱发的炎症反应在术后24 h 达到最高峰,48 h 后逐步降低,本实验也证实术后24 h肺组织中的炎症因子水平最高。引起POI 相关性炎症反应的机制复杂,涉及多个信号传导通路的共同作用[14]。P38 信号通路是炎症反应中最重要的一条通路,其中关键性物质MK2 激酶,参与并调控了炎症反应的发生、发展过程。MK2 通过磷酸化而得以激活,介导炎症反应中细胞因子的产生和细胞迁移,调节促炎因子的释放,产生炎症反应,进而介导POI 及其相关性肺损伤的重要途径[15⁃16]。从实验中可得知,枳实通降颗粒能有效的抑制MK2 的磷酸化,具有较强的抗炎作用,并且与用药剂量存在正相关。这可能正是枳实通降颗粒防治POI,进而促进术后胃肠功能的恢复和保护肺组织的作用机制所在。该机制的阐明,将为枳实通降颗粒的进一步的深入研究开发奠定了基础,也为中药复方在该领域的应用研究拓展了思路。然而,中药复方的有效成分复杂,作用靶点多,枳实通降颗粒是否其还能通过其他通路产生作用,以及对肺⁃肠轴的影响作用机制尚有待进一步研究。
