胆碱激酶α抑制剂MN58b对U87胶质瘤干细胞增殖及凋亡的影响①
2021-08-23岳芳倩邹有瑞孙胜玉宁夏医科大学临床医学院银川750004
岳芳倩 邹有瑞 孙胜玉 王 哲 马 辉 (宁夏医科大学临床医学院,银川750004)
胶质瘤是人脑中最常见原发性神经恶性肿瘤,约占中枢神经系统原发恶性肿瘤的80%,由于其生长过程中浸润广泛,手术很难将其彻底切除,预后极差,病死率较高[1-3]。胶质瘤干细胞(glioma stem cells,GSCs)是一类具有自我更新、多向分化潜能且致瘤性极强的细胞亚群,近年研究表明,胶质瘤发生发展及不良预后可能与GSCs关系密切[4-5]。
胆碱激酶(choline kinase,CHK)是磷酸胆碱生物合成过程中起关键作用的酶类,有胆碱激酶α(choline kinase alpha,CHKA)和胆碱激酶β(choline kinase beta,CHKB)2 个亚型[6]。在体内,CHKB 仅具有乙醇胺激酶活性,而CHKA 兼具CHK、乙醇胺激酶双重活性,在功能方面优于CHKB,是胆碱激酶的优势亚型。近年研究显示,CHKA 具有癌基因特性,在多种恶性肿瘤中表达明显上调,是肿瘤发生发展机制中的重要因子[7]。课题组前期研究中也发现CHKA 参与胶质瘤恶性进展过程,与胶质瘤发生发展有关,但其影响胶质瘤发生发展的具体机制尚未明确,推测其可能与GSCs聚集与活性有关。本研究拟探究CHKA在不同细胞中的表达情况及其活性被抑制后GSCs 增殖、凋亡情况,初步探讨CHKA 与GSCs的关系。
1 材料与方法
1.1 材料 人源性胶质瘤细胞株U87MG、小胶质细胞株HMC3(中国科学院上海细胞库);DMEM、DMEM-F12、胎牛血清(美国Gibco 公司);表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、B27因子(美国Invitrogen 公司);胰蛋白酶和青霉素、链霉素(上海碧云天公司);兔抗人CHKA抗体、鼠抗人Nestin 抗体、兔抗人 CD133 抗体、兔抗人 GAPDH 抗体(美国Abcam 公司);辣根过氧化物酶标记的山羊抗兔二抗、FITC标记的山羊抗兔二抗、Cy3标记的山羊抗鼠二抗(北京中杉金桥公司);CHK 抑制剂MN58b(上海一飞公司);逆转录试剂盒、SYBR®Pre‑mix ExTaqTM(日本TaKaRa 公司);凋亡试剂盒(联科生物);CCK8 试剂盒(日本同仁公司);细胞培养箱、酶标仪(美国Thermo 公司);低温高速离心机(德国Eppendrof 仪器公司);荧光显微镜(日本OLYMPUS公司);荧光定量PCR仪(美国ABI公司);电泳仪、转膜仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养及U87GSCs 提取 U87MG 细胞、HMC3 细胞 37℃ 水浴复苏,1 000 r/min 离心5 min,弃上清,铺于含10%胎牛血清、1%双抗DMEM 培养基的培养瓶中,37℃、5%CO2培养至对数生长期,胰酶消化U87MG细胞,以神经干细胞培养液制备细胞悬液,置于悬浮细胞培养瓶内培养,更换为神经干细胞培养基,即无血清DMEM-F12 中加入20 ng/ml EGF、20 ng/ml bFGF 及 2%B27 因子,培养 3~5 d,培养中期半换液。
1.2.2 免疫荧光法鉴定U87GSCs 收集生长状况较好的U87GSCs 肿瘤球重悬于含血清培养基中,在铺有无菌盖玻片的24 孔板中爬片4 h,弃培养基,PBS 缓冲液清洗 3 次,5 min/次,4%多聚甲醛固定30 min,PBS 冲洗,0.1%Triton100X 通透 30 min,PBS清洗 3 次,5 min/次,山羊血清封闭 30 min,加入CD133、Nestin 抗体 4℃ 孵育过夜,PBS 缓冲液清洗3 次,5 min/次,加入相应二抗,避光孵育 30 min,DAPI 染色 10 min,PBS 清洗 3 次,5 min/次,甘油封片,荧光显微镜下观察荧光情况并拍照。
1.2.3 RT-PCR 检测 CHKA 表达 RNA 提取试剂盒提取U87MG、HMC3、U87GSCs 细胞总RNA,测定其浓度和纯度,逆转录为cDNA,进行RT-PCR 反应。CHKA F:5'-CGGAAAGTGCTCCTGCGGCT-3',R:5'-AACCAAGCTGTGCAGCCCAA-3',以β-actin为内参,按照说明书加样体系检测。
1.2.4 Western blot 检测CHKA 蛋白表达 细胞裂解法提取不同细胞总蛋白,BCA 法定量,30 µg/孔上样,进行 SDS-PAGE 电泳(80 V),转至 PVDF 膜(300 mA,45 min),室温封闭 1 h,加入 CHKA 一抗4℃ 孵育过夜,次日收集一抗,TBST 清洗5 次,5 min/次,加入相应二抗孵育 2 h,TBST 漂洗 5 次,ECL显影。
1.2.5 CCK8 检测细胞增殖活性 收集U87GSCs细胞悬液,离心,弃上清,采用含不同剂量DMSO 溶解的MN58b溶液(10、20、40 µmo/l L)重悬,1×104个/100 µl 铺于96 孔板,分别培养24 h、48 h、72 h,在各时间段加入10µl CCK8 溶液,孵育2 h,酶标仪检测不同药物浓度在不同时间点各孔450 nm处吸光度。
1.2.6 流式细胞术检测细胞凋亡 采用20µmo/l L MN58b溶液和DMEM溶液处理U87GSCs,培养48 h,收集上清中的细胞,预冷PBS 缓冲液洗涤,离心,弃上清,500µl Binding Buffer重悬细胞,在各处理管中加入5µl Annexin V-APC 和10µl 7-AAD,移液器吹打均匀,室温下避光孵育5 min,流式细胞仪检测。
1.3 统计学处理 采用SPSS24.0软件进行统计学分析,两样本比较采用t检验,多样本比较采用单因素方差分析,数据以表示,P<0.05为差异具有统计学意义。
2 结果
2.1 U87GSCs 阳性表达 CD133、Nestin 分子标志物 免疫荧光结果显示,将U87MG细胞重悬于神经干细胞培养基中24 h,可见部分细胞悬浮于培养液中且聚集成不规则细胞团,48~72h期间半换液,肿瘤细胞团逐渐呈圆球形生长,折光性良好,提示U87MG 采用神经干细胞培养基培养后可形成类似神经干细胞球的肿瘤干细胞球,其表面阳性表达肿瘤干细胞表面分子标志物CD133 和神经干细胞表面分子标志物Nestin,表明神经干细胞培养基中培养出的细胞球为典型GSCs(图1)。

图1 U87GSCs免疫荧光结果(×200)Fig.1 U87GSCs immunofluorescence results(×200)
2.2 正常小胶质细胞、GSCs 及胶质瘤细胞中CH‑KA 表达 RT-PCR 结果显示,U87GSCs、U87MG 细胞 CHKA 表达显著高于 HMC3 细胞(F=31.3,P<0.001,图 2A)。Western blot 结果显示,U87GSCs、U87MG 细胞 CHKA 表达显著高于 HMC3 细胞(F=5.24,P<0.05,图2B、C)。

图2 CHKA在U87GSCs、U87MG、HMC3细胞中的表达Fig.2 CHKA expressions in U87GSCs,U87MG,HMC3 cells
2.3 CHKA 抑 制 剂 MN58b 抑 制 U87GSCs 增殖 CCK8 结果显示,随 MN58b 浓度增加,U87GSCs 增殖能力逐渐被抑制(图3),与0 mol/L MN58b 组相比,不同MN58b 浓度组各时间段差异均有统计学意义(表1,P<0.001)。随作用时间延长,不同MN58b浓度对U87GSCs 增殖抑制率差异显著,40 µmol/L MN58b作用72 h对U87GSCs增殖抑制最为明显(F=18.33,P<0.05)。
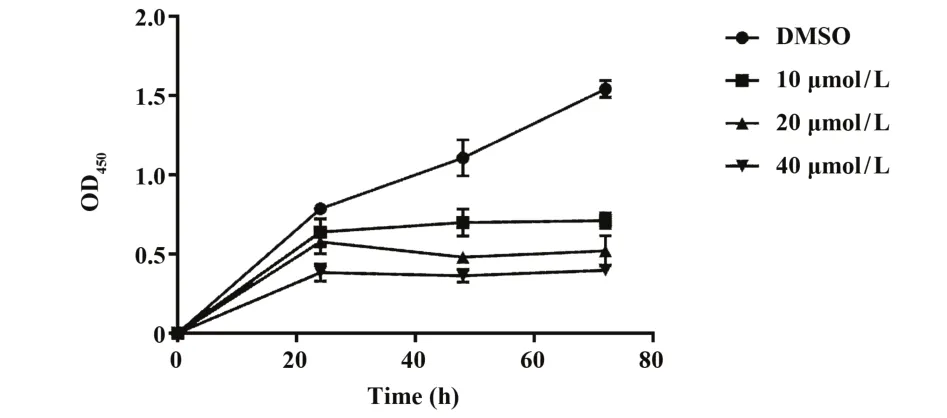
图3 MN58b对U87GSCs增殖的影响Fig.3 Effect of MN58b on proliferation of U87GSCs
表1 不同浓度MN58b对培养不同时间U87GSCs的抑制率比较()Tab.1 Comparison of inhibition rates of different concen⁃trations of MN58b on U87GSCs in different cul⁃ture time()
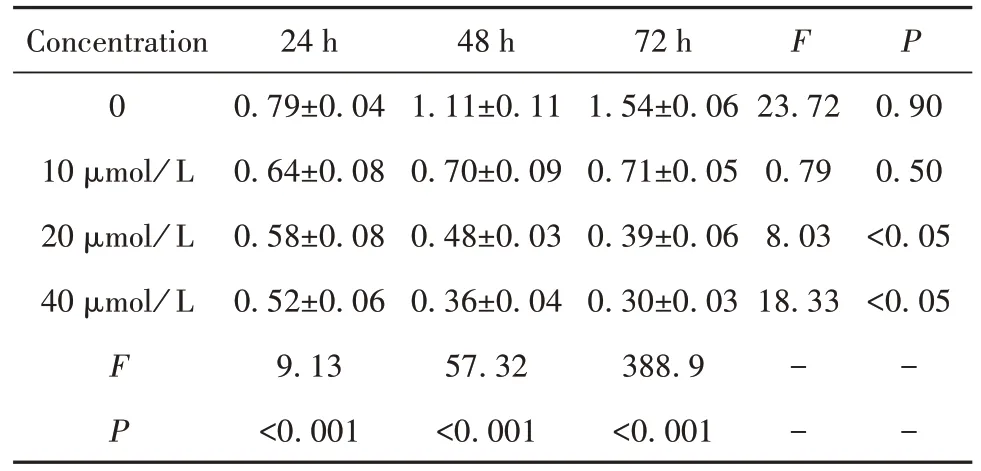
表1 不同浓度MN58b对培养不同时间U87GSCs的抑制率比较()Tab.1 Comparison of inhibition rates of different concen⁃trations of MN58b on U87GSCs in different cul⁃ture time()
Concentration 0 10µmol/ L 20µmol/ L 40µmol/ L F P 24 h 0.79±0.04 0.64±0.08 0.58±0.08 0.52±0.06 9.13<0.001 48 h 1.11±0.11 0.70±0.09 0.48±0.03 0.36±0.04 57.32<0.001 72 h 1.54±0.06 0.71±0.05 0.39±0.06 0.30±0.03 388.9<0.001 23.72 0.79 8.03 18.33 0.90 0.50<0.05<0.05 F P− −− −
2.4 MN58b 促进U87GSCs 凋亡 流式细胞术检测结果显示,加入DMSO 溶液的U87GSCs 凋亡率为1.87±0.45,加 入 CHKA 抑 制 剂 MN58b 溶 液 的U87GSCs 凋亡率为7.47±0.74,差异有统计学意义(T=11.22,P<0.001,图 4),提 示 CHKA 抑 制 剂MN58b可促进U87GSCs凋亡。
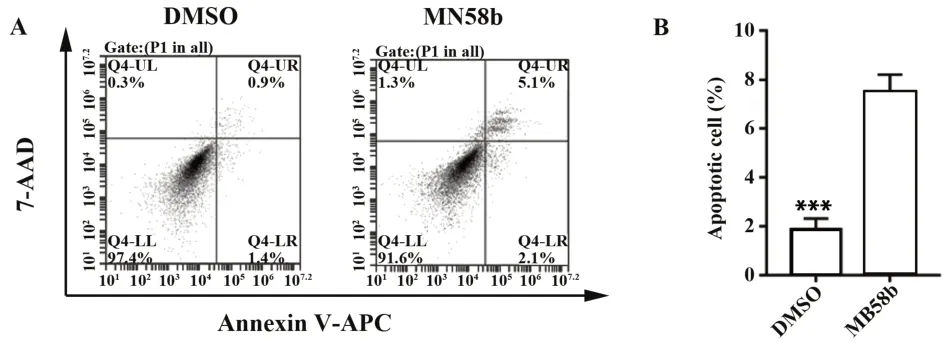
图4 DMSO和MN58b对U87GSCs凋亡的影响Fig.4 Effect of DMSO and MN58b on apoptosis of U87GSCs
3 讨论
近年研究表明,GSCs可能是胶质瘤细胞对放化疗产生耐受性,以及胶质瘤预后不良和复发的根源[8-9]。但其发挥作用的具体作用机制尚未阐明,但可以确定的是GSCs 独特的生物学特性与胶质瘤对放化疗不敏感、易复发密切相关[10],如GSCs 可稳定自我更新及高度增殖侵袭生长,使其在周围正常脑组织中不断浸润生长,手术难以完全切除,而其极强的致瘤特性及高分化潜能使其比一般胶质瘤细胞具有更强的耐放化疗能力,因此,GSCs 作为胶质瘤治疗的靶点已成为胶质瘤研究重点。
CHKA 是胆碱激酶蛋白家族成员,在卵巢癌、肺癌、肝癌、乳腺癌等人类肿瘤形成过程中扮演重要角色,且在恶性肿瘤发展和预后过程中发挥重要作用[11-12]。MN58b 是 CHKA 小分子抑制剂 HC-3 的衍生物,与HC-3一样可抑制CHKA 活性从而抑制肿瘤细胞生长,另外MN58b 还可加剧内质网应激进而触发 肿 瘤 细 胞 凋 亡[13]。 HERNÁNDEZ-ALCOCEBA等[14]研究显示,MN58b 作为 CHKA 抑制剂在结肠癌细胞增殖和移植瘤生长过程中起明显抑制作用。
课题组前期实验发现,多体素1H-MRS 参数胆碱/肌酸(Cho/Cr)代谢差异区域与胶质瘤中肿瘤干细胞富集密切相关[15-16]。初步研究证实,Cho/Cr 低代谢区脑胶质瘤组织中含有少量神经GSCs,而Cho/Cr 高代谢区神经GSCs含量明显高于Cho/Cr低代谢区,神经GSCs 分布与Cho 含量呈正相关。课题组前期研究发现,给予CHKA 特异性抑制剂MN58b,U87MG 增殖明显被抑制,而其凋亡能力则被促进。CHKA 作为Cho 代谢过程中的关键酶可能与GSCs发生发展有关,但其作用机制尚不明确,推测其可能通过对GSCs 生物功能的调节从而影响胶质瘤不良预后。因此,课题组从不同细胞系入手发现,脑胶质瘤细胞及GSCs 中CHKA 表达明显高于正常小胶质细胞,随后采用CHKA 特异性抑制剂MN58b 降低CHKA 生物活性,并进一步通过CCK8 实验证明CHKA的生物活性被抑制后U87GSCs增殖能力明显被抑制,同时采用流式细胞仪检测U87GSCs 凋亡,发现CHKA活性被抑制后可促进细胞凋亡。
综上所述,CHKA 在胶质瘤细胞及GSCs 中表达明显高于正常小胶质细胞,且CHKA 生物活性被MN58b 抑制后可有效抑制GSCs 增殖,促进其凋亡。因此,CHKA 可能是一种促癌基因,有望成为胶质瘤诊断及预后的生物标志物,而MN58b 作为CHKA 的特异性抑制物可以作为抑制CHKA 的靶向药物,与目前胶质瘤的治疗药物相结合可能将会有效抑制胶质瘤的发展,改善胶质瘤患者的预后。
