信号素6d(Sema6d)对树突状细胞天然免疫功能的影响及机制研究①
2021-08-23程玉洁海军军医大学免疫学研究所暨医学免疫学国家重点实验室上海200433
程玉洁 刘 娟(海军军医大学免疫学研究所暨医学免疫学国家重点实验室,上海200433)
树突状细胞(dendritic cells,DC)作为天然免疫和获得性免疫的连接桥梁,在维持免疫稳态、调节免疫平衡中发挥关键作用[1]。DC的数量、功能异常与炎症性疾病、自身免疫性疾病等免疫相关性疾病的发生发展密切相关[2-3]。鉴定DC分化发育和功能活化的关键调节蛋白对于深入了解免疫应答的内在规律、寻找免疫性疾病新型发病机制具有重要意义。
不同的DC亚群及其不同的功能状态在免疫应答中发挥多样化的调节作用[4]。外周未成熟DC(immature DC,imDC)在受到炎症环境或抗原刺激下摄取抗原并加工为抗原肽,同时分泌IL-6、TNF等炎症性细胞因子,在此过程中逐渐发育为成熟DC(mature DC,mDC),并在细胞膜表面趋化因子受体CCR7的相应趋化因子配体19(chemokine ligand 19,CCL19)和趋化因子配体21(chemokine ligand 21,CCL21)的诱导下向次级淋巴结迁移,最终向T细胞提呈抗原肽,进而活化T细胞反应。DC摄取抗原后迅速启动迁移过程,并在后期及时终止,以保证机体在及时启动保护性免疫应答的同时避免免疫反应过度造成自我损伤[5]。课题组前期研究发现长链非编码RNA lnc-dpf3通过缺氧诱导因子HIF-1α途径抑制CCR7依赖的DC迁移,进而负向调节炎症性疾病的发生[6]。同时,也有文献提示CCL19在DC凋亡过程发挥调控作用[7]。因此,需要进一步探究体内是否存在其他机制对DC成熟活化和迁移功能的平衡进行精密调控,促使机体能够及时清除病原体,同时避免不必要的炎症损伤。
信号素家族为一类含有共同胞外信号素结构域的蛋白家族,在神经发育、骨骼形成、肝脏、肾脏等器官功能中发挥重要调节作用[8-13]。多个信号素家族成员在免疫系统发育及免疫细胞功能中可能发挥重要调节作用。比如,信号素4d能够促进DC活化并诱导T细胞启动免疫应答[14];信号素7a可通过整合素途径活化T细胞以启动免疫应答,同时通过整合素和丝裂原激活的蛋白激酶(mitogen activated protein kinase,MAPK)通路促进神经轴突的生长[15-16]。表达信号素6a分子的朗格汉斯细胞(langerhans cell,LC)在功能未成熟状态时表达趋化因子受体CCR7并具有体内迁移功能,提示信号素6a在抗原提呈细胞的天然免疫功能中可能发挥调节作用[17]。DC是体内最重要的抗原提呈细胞,关于信号素6亚家族成员(Sema6a、6b、6c、6d)在其成熟、活化及迁移过程中具体发挥何种功能尚不清楚。因此,本研究通过筛选,获得在CCL19/CCL21刺激后表达量显著上调的信号素亚家族分子信号素6d(Semaphorins 6d,Sema6d),并探究该分子在DC成熟、活化和迁移中发挥的调节作用及机制,为机体天然免疫应答提供新的分子机制解释。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄C57BL/6J雄鼠,体重16~20 g,动物许可证号:scxk(沪)2018-0006,购自上海西普尔-必凯公司。
1.1.2 主要试剂与仪器 基础培养基PRIM1640购自Gibco公司;胎牛血清购自Biowest公司;重组小鼠CCL19、CCL21、粒细胞巨噬细胞刺激因子、IL-4购自R&D公司;转染试剂Lipofectamine2000、缓冲液购自Invitrogen公司;逆转录试剂盒、TB green购自TaKaRa公司;红细胞裂解液、流式抗体购自BD公司;BCA试剂盒、显影发光底物购自Thermo Fisher公司;蛋白免疫印迹抗体购自CST和Abcam公司;RNA Fast 2000试剂盒购自飞捷公司;迁移孔板购自康宁公司;脂多糖(lipopolysaccharide,LPS)、蛋白酶抑制剂Cocktail、PMSF购自Sigma公司;小干扰RNA由上海吉玛公司合成;5×Loading buffer购自生工公司;LSRFortessa流式细胞仪购自BD公司。
1.2 方法
1.2.1 骨髓来源树突状细胞(bone marrow-derived dendritic cells,BMDC)的培养及刺激 取6~8周龄雄鼠,颈椎脱臼处死,取股骨和胫骨骨髓组织,注射器反复吹打分散,过滤,离心获得细胞沉淀,加入1 ml 1×红细胞裂解液,混匀后静置3 min破红,加入2 ml 1×PBS终止破红,3 000 r/min离心5 min,弃上清获得细胞沉淀,加入18 ml细胞培养基(500 ml PRIM1640+50 ml胎牛血清+55μl 100 ng/μl GMCSF+11μl 50 ng/μl IL-4),充分混匀后均匀接种至6孔板。以培养当天算作第0天,分别在第2和第4天每孔补充DC培养液1 ml,第5天加入LPS(100 ng/ml)刺激12 h促其成熟。
1.2.2 小RNA干扰 成熟细胞铺板后,静置2~3 h使其稳定,3×105个细胞以100μl缓冲液+1μl小干扰RNA+3μl干扰用混合液,6×105个细胞以200μl缓冲液+2μl小干扰RNA+5μl干扰用混合液缓慢滴入。干扰24~48 h后检测细胞天然免疫功能及信号通路活化。干扰RNA序列见表1。

表1 干扰RNA序列Tab.1 Interference RNA sequence
1.2.3 总RNA的提取及逆转录 根据试剂盒说明书提取RNA,取13.5μl RNA、4μl MLV缓冲液、1μl脱氧核糖核苷三磷酸、1μl多聚胸腺嘧啶、0.5μl逆转录酶混匀,然后以72℃59 min,42℃15 min的PCR程序逆转录。逆转录结束后加入60μl无菌水稀释获得cDNA。
1.2.4 荧光定量PCR(fluorogenic quantitative PCR,qPCR)根据试剂盒说明书进行qPCR,扩增体系为每孔5μl灭菌水+10μl TBgreen+1μl目标引物+4μl cDNA,PCR程序在quant studio flex7仪器上完成。以β-actin的循环数值作为背景并减去,2ΔCt公式计算获得样品的扩增倍数。引物序列见表2。

表2 qPCR引物序列Tab.2 Primers used for qPCR
1.2.5 流式微球技术(cytometric bead array,CBA)根据CBA检测试剂盒进行细胞上清蛋白定量检测。50μl细胞上清加入1μl捕获微球和50μl检测液,室温避光结合1 h后加入1μl检测微球和50μl检测液,继续室温避光结合2 h后加入800μl洗液,12 000 r/min离心5 min,弃上清,加入200μl 1×PBS,流式细胞仪上机检测。
1.2.6 细胞迁移实验(Transwell assay) 本实验在含有8μm孔径聚碳酸酯过滤器的24孔迁移板进行。提前30 min在迁移板下层室加入600μl 10%1640培养基,上层室加入100μl 10%1640培养基并于37℃孵箱预热。将对照组和干扰组细胞数量调整至100μl,培养基内含有3×105个细胞,吸净预热用培养基后,下层室加入600μl 10%1640培养基,设置对照孔和实验孔,实验孔中加入CCL19和CCL21(50 ng/ml),对照孔不添加,在上层室加入细胞。37℃共孵育12 h后收集下层室细胞,3 000 r/min离心5 min,弃上清,加入200μl 1×PBS,流式细胞仪记录1 min内检测到的细胞数量。以对照孔内自发迁移的细胞数为背景,减去背景后得到迁移细胞数量。以对照组迁移数量为基础值,实验组迁移数量除以基础值得到实验组相对迁移比值。
1.2.7 Western blot
1.2.7.1 制备样品 细胞干扰48 h后收集至1.5 ml离心管,3 000 r/min离心5 min,弃上清,每管加入100μl按比例配制的细胞裂解液,4℃振荡裂解30 min后,12 000 r/min离心10 min,将上清转移至新的1.5 ml离心管,BCA试剂盒检测蛋白浓度,在上清中加入20μl 5×loading buffer,10 min水浴煮沸制备。
1.2.7.2 免疫印迹 根据待检测的蛋白分子量大小制备相应浓度的电泳凝胶,取20μg蛋白样品进行电泳分离(80 V,室温,3 h)、转膜(300 mA,4℃,90 min)、封闭(5%BSA,室温,2 h),孵育盒中加入按说明书稀释的一抗,4℃过夜。次日以1×TBST,10 min×4次洗净一抗后加入按说明书稀释的相应二抗,室温孵育1~2 h。孵育结束后,1×TBST,10 min×4次洗净。参照显影试剂盒说明书配制显影发光底物,将膜置于底物溶液中孵育,在显影仪下曝光拍照。
1.2.8 流式细胞术 细胞干扰24 h后收集至1.5 ml离心管,3 000 r/min离心5 min,弃上清,每管加入50μl 1×PBS和1μl相应流式抗体,室温避光结合20 min后加入1 000μl 1×PBS清洗,3 000 r/min离心5 min,弃上清后加入200μl 1×PBS上机检测。
1.3 统计学处理 采用双尾t检验统计分析差异显著性,*表示P<0.05,**表示P<0.01,***表示P<0.001,NS(not significant)表示差异无统计学意义。
2 结果
2.1 CCL19/CCL21刺激12 h后信号素6d表达量改变 成熟DC铺板后加入CCL19/CCL21刺激12 h,收集细胞并获得cDNA后,qPCR检测信号素6a、6b、6c和6d mRNA水平变化。结果显示,经CCL19/CCL21刺激后,信号素6a和信号素6c表达量无明显变化,信号素6b表达下调,信号素6d表达上调(图1)。提示趋化因子配体刺激后可诱导信号素6d分子表达量上调。因此,锁定信号素6d为目标研究分子。

图1 DC在CCL19/CCL21刺激12 h后信号素6d表达上调Fig.1 Expression of Sema6d in DC was up regulated after stimulation of CCL 19/CCL21 for 12 h
2.2 干扰信号素6d对DC膜表面标志物和凋亡功能的影响 以小RNA干扰实验研究信号素6d功能。成熟DC分别使用si-NC和si-Sema6d干扰36 h并获得cDNA,qPCR检测信号素6d mRNA水平表达量变化结果显示,si-Sema6d处理后信号素6d表达量著下调,表明信号素6d被有效干扰(图2A)。流式细胞术检测DC干扰信号素6d分子24 h后膜表面标志物以明确该分子是否影响细胞成熟、活化。结果表明,与对照组相比,干扰组DC膜表面标志物CD11c、CD40、CD86和CD80无明显差异(图2B)。同时检测成熟DC干扰信号素6d分子24 h并使用CCL19/CCL21刺激12 h后的凋亡标志物。结果显示,细胞凋亡标志无明显变化(图2C)。以上结果提示,信号素6d对细胞膜表面成熟标志物及凋亡功能无明显影响。
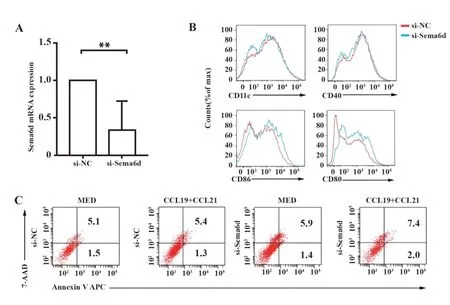
图2 信号素6d干扰后DC膜表面成熟标志物和凋亡功能无变化Fig.2 Expression of surface markers and apoptosis function did not change after Sema6d interference in DC
2.3 干扰信号素6d对DC天然免疫功能的影响qPCR和流式微球实验检测干扰信号素6d 36 h并LPS刺激12 h后细胞炎症因子表达量变化,同时通过体外迁移实验检测迁移功能变化。结果显示,信号素6d干扰后炎症因子表达上调(图3A),而迁移功能下调(图3B)。以上实验结果证明,信号素6d分子在成熟DC中发挥抑制炎症因子分泌,同时促进趋化因子介导的细胞迁移作用。
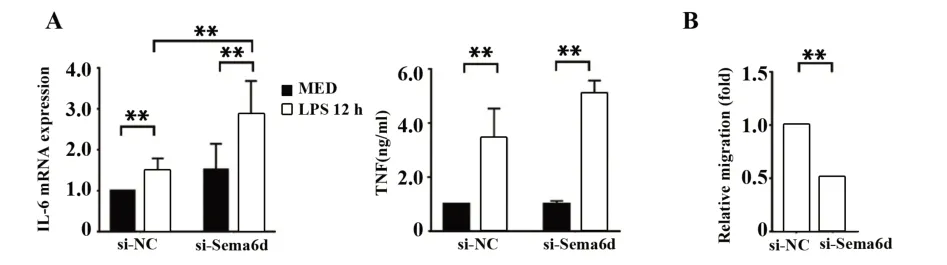
图3 信号素6d干扰后对DC天然免疫功能的影响Fig.3 Effect of Sema6d interference on DC innate immune function
2.4 干扰信号素6d对MAPK和NF-kB信号通路的影响 Western blot检测MAPK通路和NF-κB通路相关信号蛋白在细胞干扰48 h,并分别以LPS或CCL19/CCL21刺激不同时间点的表达。结果显示,干扰信号素6d后,LPS刺激后的MAPK信号蛋白pp38和p-Erk表达下调,而NF-κB信号蛋白p-p65表达上调,提示信号素6d分子可能通过抑制p-p65的活化发挥抑制LPS刺激的炎症因子分泌的功能。而在干扰信号素6d后,CCL19/CCL21刺激的p-p38、p-Erk及p-p65表达均下调,提示信号素6d分子能够广泛促进细胞迁移信号触发的MAPK及NF-κB通路相关蛋白表达变化(图4)。以上结果提示,信号素6d分子对LPS或CCL19/CCL21刺激的MAPK和NFκB信号通路发挥差异化调控作用。
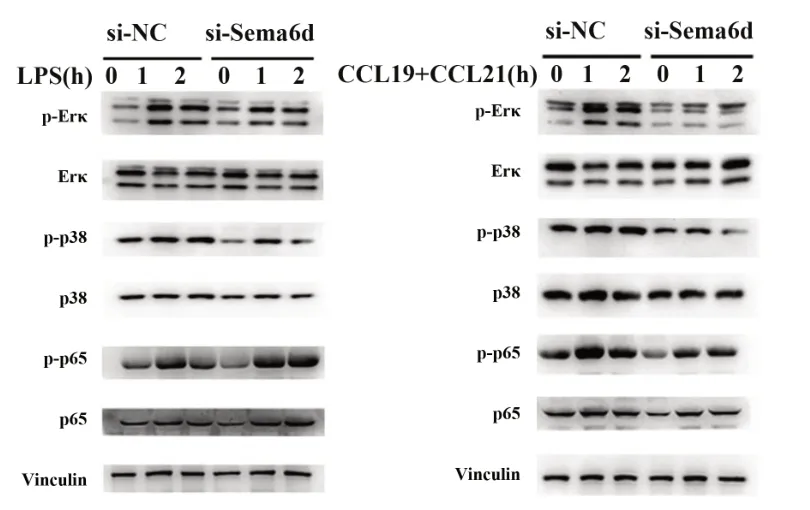
图4 信号素6d干扰后对MAPK和NF-κB信号通路关键蛋白表达的影响Fig.4 Effect of Sema6d interference on expressions of key molecules of MAPK and NF-κB signaling pathways
3 讨论
信号素6d分子在调控帕金森疾病、心脏疾病及急性肾损伤过程中发挥关键调控作用,并被发现是骨肉瘤及三阴性乳腺癌治疗的关键靶点[18-20]。但该分子在免疫细胞功能调节中的作用尚不清楚。本研究证实信号素6d分子在天然免疫中具有重要调控作用。CCL19和CCL21刺激可诱导信号素6d表达量著上调,上调的信号素6d分子能够反馈性地抑制脂多糖引发的炎症反应,同时促进趋化因子介导的细胞迁移。因而,信号素6d分子促使免疫系统在受到病原体刺激后能够抑制过度的炎症因子分泌,同时及时启动细胞迁移,是DC实现免疫调控、维持免疫平衡的重要分子。
代谢调控作为一种动态精准的胞内调控方式得到广泛关注。已有研究证实了胞内糖酵解途径在DC的炎症反应及迁移过程中发挥重要作用[21]。近期研究发现,mTOR信号通路在信号素6d调控巨噬细胞的抗炎极化和脂质代谢过程中发挥重要作用[22]。本课题组发现,信号素6d分子在DC中能够促进CCL19/CCL21刺激后的p-p65活化,抑制LPS刺激后的p-p65信号活化。信号素6d分子是否通过影响胞内代谢通路活化,或借助某些代谢产物的改变发挥影响DC的天然免疫信号及活化和迁移功能仍有待进一步研究。
CCL19/CCL21与DC膜表面趋化因子受体相结合以触发细胞迁移。信号素6d通过何种方式调控趋化因子受体与配体间介导的信号通路活化以实现促进细胞迁移的功能尚不明确。文献提示信号素家族的信号素结构域通过与丛状蛋白受体结合参与诱导肌动蛋白丝在细胞质膜上的重组并促进细胞迁移[23]。信号素6d是否依赖丛状蛋白受体影响趋化因子受体内化及下游信号激活,是否通过其信号素结构域影响细胞骨架系统重塑,进而影响细胞迁移运动仍有待进一步研究。
综上所述,本研究发现了信号素6d分子在DC天然免疫功能中的重要调控作用,揭示了免疫平衡的新型调控机制,可能为DC功能紊乱相关炎症性疾病、自身免疫性疾病提供新型机制揭示和潜在防治靶标。
