内质网应激在危重病肠黏膜屏障损伤中的作用①
2021-08-23李福龙赵自刚河北北方学院微循环研究所张家口075000
尹 蒙 王 鹏 李福龙 赵自刚(河北北方学院微循环研究所,张家口075000)
肠屏障是机体防御系统的重要组成部分。良好的肠屏障功能可有效阻止肠道细菌、内毒素向肠外组织、器官移位,维持内外环境稳定。肠屏障损伤成为多种严重致病因素引起全身炎症反应失控和多器官功能障碍和衰竭的主要机制之一[1]。一般来说,肠屏障由机械屏障、化学屏障、免疫屏障与生物屏障共同构成,以机械屏障最为重要,其结构基础为完整的肠黏膜上皮细胞及细胞间紧密连接,亦称为肠黏膜屏障。研究显示,失血性休克、严重烧伤、重症急性胰腺炎(severe acute pancreatitis,SAP)、脓毒症等危重病可引起肠黏膜屏障损伤,因此,研究肠黏膜屏障损伤的发生机制对探寻肠屏障损伤的防治策略显得尤为重要。内质网应激(endoplasmic reticulum stress,ERS)指细胞受到内外因素(缺血/缺氧、感染、炎症等)刺激后,内质网结构损伤,功能障碍,蛋白质加工运输受阻,表现为大量未折叠或错误折叠蛋白累积及Ca2+平衡紊乱,从而导致细胞功能障碍和细胞损伤[2-4]。因此,过度ERS成为疾病发生发展的重要机制之一,ERS在多种危重病肠黏膜屏障损伤中的作用值得关注。本文综述了ERS参与失血性休克、严重烧伤、SAP、脓毒症引起肠黏膜屏障损伤中的作用,以期针对ERS探寻防治肠屏障损伤的新策略。
1 ERS参与失血性休克引起的肠黏膜屏障损伤
失血性休克引起有效循环血量减少,全身血液重新分布,保证了心、脑等重要器官的血液供应,而肠道微循环低灌注最易发生缺血缺氧性损害。研究发现,失血性休克大鼠肠黏膜上皮细胞水肿、坏死脱落,有淋巴细胞及中性粒细胞浸润;肠绒毛高度显著降低,排列紊乱,肠黏液层破坏,分泌黏液蛋白的杯状细胞数目减少,肠通透性显著升高,紧密连接蛋白ZO-1、occludin、claudin-2的蛋白与基因表达显著降低。以上研究表明,失血性休克可引起肠黏膜屏障损伤[5-6]。
研究显示,失血性休克后,缺血缺氧在引起组织细胞出现能量代谢障碍、钙超载和自由基大量生成的同时,错误折叠和未折叠蛋白在内质网逐渐堆积,引起内质网功能障碍,发生ERS[7]。失血性休克在引起肠屏障损伤的同时,增加了肠黏膜上皮细胞内质网分子伴侣免疫球蛋白结合蛋白(binding immunoglobulin protein,BIP)/糖调节蛋白78(glucose regulated protein 78 kD,GRP78)蛋白表达、ERS标志物剪接型X盒结合蛋白1(spliced X-box binding protein 1,XBP-1s)mRNA表达[8];失血性休克大鼠复苏后,小肠组织涉及蛋白激酶RNA样内质网激酶(protein kinase RNA-like ER kinase,PERK)和肌醇必需酶1(inositol-requiring enzyme 1,IRE1)通路的ERS标志分子XBP-1s、总XBP-1、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、生长抑制与DNA损伤基因34(growth arrest and DNA damage-inducible 34,GADD34)、GRP78、GRP94、跨膜蛋白活化转录因子4(activating transcription factor 4,ATF4)的mRNA表达均显著降低[9]。这些研究结果表明失血性休克引起了肠黏膜上皮细胞ERS。
针对失血性休克引起肠黏膜上皮细胞ERS机制的研究显示,Toll样受体4(Toll like receptor 4,TLR4)基因缺陷及TLR4抑制剂C34显著降低了GRP78、XBP-1s蛋白表达,肠损伤程度减轻;给予外源性高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)显著增加了TLR4基因缺陷小鼠失血性休克后的肠损伤,说明TLR4/HMGB1信号通路参与失血性休克引起的肠黏膜上皮细胞ERS的发生[8]。除此以外的其他机制还有待深入研究。
2 ERS参与严重烧伤引起的肠黏膜屏障损伤
大面积烧伤除了引起皮肤和皮下组织严重损毁外,还可导致其他多种脏器功能不同程度的损伤[10]。由于肠道极易受到组织灌注不足和缺氧的影响,故烧伤后应激反应引起的组织缺血缺氧,使肠道成为受损最为严重的器官之一[11]。缺血缺氧造成细胞能量代谢障碍,引起氧化应激和炎症反应,进而引起细胞功能紊乱、凋亡甚至死亡,最终导致黏膜受损、抑制黏膜修复,发生肠屏障损伤[12-13];严重烧伤引起肠黏膜组织学损害的主要表现为绒毛排列不规则、脱落,并可见固有层慢性炎症细胞浸润。HUANG等[14]研究发现,严重烧伤后肠黏膜上皮细胞紧密连接蛋白ZO-1、occludin、Claudin-1表达显著降低,Claudin-2表达显著增高,提示烧伤可引起肠上皮细胞紧密连接破坏,成为肠屏障损伤的结构基础。DEITCH等[15]和EPSTEIN[16]等分别经临床和动物实验研究发现,在发生中度至重度烧伤后不久,肠道通透性显著增加,进一步证实烧伤引起的肠屏障损伤。黏膜和屏障损伤导致细菌和毒素移位进入肝脏和血液,尤其是通过肠淋巴途径回流至全身,导致全身炎症反应综合征和远隔器官功能障碍和损伤,成为严重烧伤患者死亡的主要原因[17-18]。
研究显示,ERS参与严重烧伤相关的肠黏膜屏障功能障碍。HUANG等[14]应用30%体表面积烧伤小鼠,发现肠通透性增加程度、黏液层和紧密连接蛋白破坏程度与烧伤延续时间正相关;最重要的是,烧伤引起了肠黏膜上皮细胞BIP、CHOP、IRE1/XBP1的蛋白表达增加,表明严重烧伤引起肠黏膜受损的机制与ERS有关。一般来说,谷氨酰胺是肠黏膜重要的能源物质。研究显示,谷氨酰胺在改善肠上皮组织灌注、能量代谢的同时,降低了ERS程度,在维护肠黏膜结构和功能方面发挥重要作用[12]。胡建红[19]研究发现,肠三叶因子治疗能明显减轻烧伤动物的ERS,降低CHOP含量,改善内质网环境的氧化还原状态,促进二硫键异构酶合成,从而促进谷氨酰胺转运,改善烧伤后肠黏膜屏障功能。这些研究不仅表明ERS参与烧伤损伤肠黏膜屏障的过程,也为针对ERS改善严重烧伤后的肠屏障功能开辟了新的方向。但相关机制还需进一步探索。
3 ERS参与SAP所致肠黏膜屏障损伤
由于生活习惯和饮食习惯的变化,急性胰腺炎的发病率逐渐增加,且有20%的急性胰腺炎患者发展为SAP;而由于SAP进展迅速、并发症多、预后差、死亡率约为20%~30%而备受关注[20]。研究表明,SAP可破坏肠黏膜结构,导致肠道通透性增加,使肠道细菌和内毒素进入肠外组织和全身循环,引起全身炎症反应失控及远隔器官损伤;肠黏膜屏障的完整性在SAP的发展进程中发挥重要作用[21]。
针对ERS与SAP损伤肠黏膜屏障的相关研究显示,SAP大鼠血清二胺氧化酶和内毒素水平显著升高;出现肠水肿、绒毛脱落,肠黏膜上皮细胞变性、坏死,伴有出血、白细胞浸润等;血清促炎因子TNF-α、IL-6和IL-1β水平均显著升高;回肠组织ERS标志分子GRP78、PERK、ATF6、IRE1α的蛋白与mRNA表达显著增高;透射电镜显示肠黏膜上皮细胞的内质网出现广泛肿胀;ERS特异性抑制剂4-苯基丁盐(4-phenylbutyrate,4-PBA)治疗显著抑制了SAP大鼠上述指标的变化[22]。研究结果表明,ERS是SAP引起肠黏膜屏障损伤及过度炎症反应的主要机制之一。
OUYANG等[23]研究显示,SAP大鼠肠组织磷酸化的p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、p53信号分子高表达,p38MAPK/p53信号通路特异性抑制剂SB203580可降低肠组织炎症细胞因子水平,减少肠上皮细胞凋亡,上调紧密连接蛋白表达,从而减轻肠黏膜屏障损伤,结果表明p38MAPK/p53信号通路也参与肠黏膜屏障损伤过程。但SAP后肠黏膜上皮细胞发生ERS的机制是否与p38MAPK/p53信号通路有关还缺乏文献支持。
4 ERS参与脓毒症所致肠黏膜屏障损伤
脓毒症是重症患者死亡的主要原因。肠黏膜屏障损伤是脓毒症引起重要脏器结构损伤与功能障碍的关键环节[24]。在盲肠结扎穿孔(cecal ligation and puncture,CLP)致大鼠脓毒症的过程中,肠道通透性增加、肠黏膜紧密连接蛋白ZO-1和Claudin-1表达显著降低[25];在脂多糖(lipopolysaccharide,LPS)引起大鼠内毒素血症的过程中,亦发生肠组织学损伤加重、黏膜通透性增加、细菌移位增多、炎症反应亢进的现象,紧密连接蛋白occludin、claudin-1和缝隙黏附分子A表达下调[26];相关治疗措施在改善肠黏膜屏障的同时,提高了模型动物的存活率、延长了存活时间[25-26]。
针对ERS与脓毒症肠黏膜屏障损伤关系的研究发现,早期给予4-PBA在显著抑制CLP致脓毒性休克大鼠肠损伤、提高存活率的同时,抑制了肠组织ERS标志蛋白CHOP表达,进一步抑制ERS介导的氧化应激、细胞凋亡和炎症反应[27];CHOP-/-小鼠在遭受CLP或LPS攻击后,存活率显著提高[28];基质金属蛋白酶(matrix metalloproteinase,MMP)13-/-小鼠在遭受LPS攻击后,肠黏膜ERS受到显著抑制,肠黏膜杯状细胞消耗减少、肠通透性降低、紧密连接蛋白表达恢复正常,说明脓毒症肠黏膜ERS的发生机制与MMP13有关[29]。可见,ERS参与脓毒症损伤肠黏膜屏障的过程,但详细机制有待进一步研究。
5 小结与展望
肠道是危重症发展为多器官功能障碍综合征的“发动机”,肠黏膜屏障损伤在这一过程中扮演重要角色。ERS参与失血性休克、严重烧伤、SAP、脓毒症等急危重症引起的肠黏膜上皮细胞破坏→肠黏膜屏障损伤过程,表现为IRE1、PERK和ATF6等主要信号分子及其构建的信号转导通路发生的一系列变化(图1)。总体来看,研究者对于ERS参与危重病引起肠黏膜屏障损伤的过程已有较为深入的研究,但是对于肠黏膜发生ERS详细机制的关注相对较少。目前,多种因素通过多种机制引起细胞ERS,ERS进一步通过IRE1/XBP1、PERK/CHOP、ATF6等信号通路介导了随后的细胞凋亡[30]。究竟哪些机制参与了危重病发展进程中ERS介导的肠黏膜屏障损伤还有待深入研究。一些抑制ERS和能够帮助蛋白质正确折叠或者调节未折叠蛋白反应信号分子的药物对于改善肠屏障功能有良好的作用,但其分子机制尚不明确,且多是在动物模型上得以证实,缺乏临床实验的验证。相信相关机制的阐明有利于今后从抑制ERS的角度寻找防治危重病的治疗新策略。
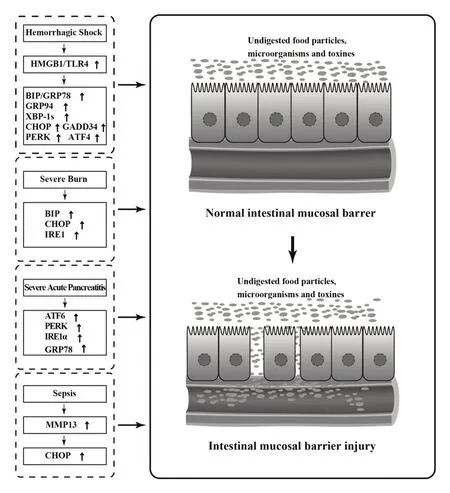
图1 ERS参与危重病发展进程中的肠黏膜屏障损伤Fig.1 ERS involves in intestinal mucosal barrier injury during critical disease