七项TAAbs联合影像临床特征在肺部结节恶性风险评估中的研究
2021-08-23刘霄江智蛟马铮曾品强沈庆廖宇黄静
刘霄 江智蛟 马铮 曾品强 沈庆 廖宇 黄静
肺癌在全球恶性肿瘤所导致的相关死亡中居首位[1]。不同分期的肺癌患者5年生存率有很大的差别,IA期非小细胞肺癌患者5年生存率高达73%,IV期患者五年生存率降至13%[2-3]。故早期诊断能显著降低肺癌患者的死亡率,但目前仅30%的患者得到早期诊断[4]。北美国家肺筛查试验使用LDCT在高危患者中进行肺癌早期筛查可使肺癌全因死亡率下降20%[5]。在管理筛查中发现的大量肺部结节具有极大挑战性,并可能会出现过度使用侵入性评估、辐射暴露及增加患者焦虑的风险[6-7]。 因此用生物标记物无创排除恶性肿瘤将是管理肺部结节的优化策略。本研究将评估血清肿瘤相关自身抗体 (serum tumor-associated autoantibodies,TAAbs)联合胸部CT影像及临床特征对早期肺癌风险预测的临床意义。
资料与方法
一、研究对象
收集重庆市人民医院2018年7月至2020年3月胸部CT筛查的109例肺部结节(所有结节直径≤30mm)患者,所有患者经外科手术或经皮肺穿刺获取病变组织进行病理学检查确诊为肺癌组(LC,86例),其中鳞癌组(SCC,21例)、腺癌组(ADC,65例),良性结节组(23例)。肿瘤分期参照第八版肺癌分期标准[8]。排除标准:对非肺癌初诊患者,或同时患有严重的肝肾功能不全、糖尿病、感染、其他类型肿瘤、分期不明确,予以排除。本研究经院医学伦理委员会批准执行。
二、 研究方法
1 影像学检查及血液样本采集
所有患者进行了胸部薄层CT扫描,在手术或活检前采集纳入者空腹血样5mL,在3小时内4 ℃下3500 r/min离心5分钟,分离血清,并储存在-80 ℃的无菌试管中待用。
2 主要试剂和仪器64排CT扫描仪(日本东芝Aquilion CX)
CT扫描所使用的参数为:切片厚度1.00mm,切片间隔0.8mm,螺旋扫描模式。7 种自身肿瘤抗体检测试剂盒(酶联免疫法) 及其配套试剂盒购自杭州凯保罗公司。美国热电Thermo MK3酶标仪。
3 实验方法
患者胸部CT影像学特点由高级职称专人测量分析。ELISA 检测7种TAAbs,严格按照试剂盒说明书操作,专人检测。酶标仪读取450 nm 处吸光度(A450 nm)值。
阳性判断标准: 如果血清7种肿瘤自身抗体检测浓度任中一项高于其阳性判断值则为阳性。
三、统计学方法
SPSS 26.0 统计学软件进行。三组间比较采用Kruskal-Wallis 秩和检验,两组间比较采用非参数Mann-Whitney U 检验; 评估自身抗体诊断肺癌的敏感性及特异性,通过以95%的置信区间(CI)绘制ROC 曲线分析; 阳性率比较采用卡方检验及Fisher精确检验;肺癌与七项TAAbs、影像学特征及人口学特点的关联性,采用二元Logistic回归分析。以P<0.05 表示有统计学意义。
结 果
一、一般资料比较
收集符合条件的肺部结节患者109例,肺癌86例,其中腺癌65例,鳞癌21例;良性肺部结节23例,其中炎性肉芽肿12例,结核9例,放线菌1例,错构瘤1例。各组在年龄、肺癌家族史、肿瘤个人史无显著差异,鳞癌组吸烟患者及男性患者显著多于腺癌组及良性结节组(见表1)。

表1 各组患者一般资料比较
二、各组患者七项血清肿瘤相关自身抗体检测结果比较
肺癌组及良性结节组比较,肺癌组单个自身抗体检测p53水平显著高于良性肺部结节组,其余自身抗体水平无显著差异(见表2)。进行腺癌及鳞癌亚组分析,各组间自身抗体检测水平无显著差异。
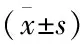
表2 肺癌组与良性结节组七项TAAbs检测结果比较
三、单个自身抗体阳性及七项TAAbs阳性,在早期肺癌诊断价值中的比较
单个自身抗体阳性在肺癌诊断中的敏感性低,最高为p53,仅15.12%,而单个自身抗体阳性的特异性高,大于91.3%。七项TAAbs联合阳性诊断降低了部分特异性(86.96%),但敏感性明显提高,达48.84%,阳性预测值高达93.33%(见表3)。在肺癌亚组里,鳞癌组七项TAAbs阳性诊断敏感性(57.14%)高于腺癌(45.15%),两组诊断特异性相当(见表4)。

表3 单个自身抗体及七抗联合在早期肺癌诊断中敏感性和特异性分析

表4 七种抗体联合检测对不同类型肺癌诊断的评价
四、各亚组肺癌患者七项TAAbs阳性率的比较
对肺癌患者进行结节大小、结节类型、病理分型及TNM分期进行分组,各组阳性率差异均无统计学意义(P均>0.05)(见表5)。

表5 各亚组肺癌患者七项TAAbs阳性率的比较
五、七项TAAbs联合胸部影像学及人口学特点建立早期肺癌预测模型
引入年龄、性别、吸烟等基本人口学特征及胸部影像学特征建立回归模型分析,模型准确度85.45%,敏感度90.8%,特异度68.18%,阳性预测值91.86%,阴性预测值62.5%。在该模型中再引入七项TAAbs进行二元Logistic回归分析,ROC曲线(见图1)。设置男性为1,女性为0;年龄≥60岁为1,小于60岁为0;吸烟大于30包年为1,小于30包年及未吸烟为0(二者无显著性差异),20mm<结节直径≦30mm为2(large),10mm<结节直径≦20mm为1(small),结节直径≦10mm为0;实性结节(SPN)为0,亚实性结节(PSN)为1,磨玻璃结节(GGN)为2,建立早期肺癌预测模型为:logit(p) = -2.33+2.726genderM+1.054age+3.161smoking+1.951small+2.576 large+3.632PSN+3.221GGN+1.738七抗阳性。该模型的准确度提高到89.09%,特异度由68.18%提升到87.5%,仍保持较高敏感度(89.36%),阳性预测值(PPV)和阴性预测值(NPV)分别为97.67%和58.33%。

图1 七项TAAbs联合胸部CT及人口学特点诊断早期肺癌的ROC曲线
讨 论
早期诊断可使肺癌患者在转移前获得有效治疗,明显提高生存率。LDCT筛查能发现体积较小、分期较早的肺部肿瘤,虽然其灵敏度很高,但假阳性率也很高,有许多肺部结节最终经外科手术证明是良性病变[9]。随着分子生物学研究进展,“液体活检”的概念应运而生,液体活检技术路径包括ctDNA、肿瘤免疫信号、蛋白组学信号与其他技术路径[10],可能成为肺癌早期筛查的无创手段。肿瘤相关抗原(TAAS)过表达、突变、错误折叠等可导致机体产生针对肿瘤的自身反应性细胞免疫应答,通过TAAs刺激B淋巴细胞产生针对这些抗原的自身抗体[11],并可使抗原信号形成放大作用,在体内持续时间长,可在肿瘤早期,甚至早于肿瘤5年前检测到抗体[12],且检测成本低,这使得TAAbs更可能成为肺癌早期诊断筛查有价值的生物标志物。
本研究纳入肺部结节(直径≤30mm)患者进行单中心回顾性研究,使用ELISA方法检测血清7个肿瘤自身抗体(p53、PGP9.5、SOX2、GAGE7、GBU4-5、MAGEA1及 CAGE)水平,发现与良性结节组相比,单一自身抗体特异性高,均在91.3%以上,但敏感性低,最低为17.44%(SO2)。陆柳[13]、赵娟等[14]研究显示七项自身抗体检测水平和对照组比较都有显著差异,而我们研究仅p53在良性结节组和肺癌组具有显著差异。这可能和收集的患者数量、结节大小、TNM分期等不同相关。
由于单一肿瘤自身抗体敏感性低,临床上常用的是联合使用生物标志物[15-16]。既往较多研究筛选了不同的肿瘤血清自身抗体组合来提高肺癌的诊断效率[17-19]。本研究肺癌组患者的七项自身抗体联合阳性诊断敏感性48.84%,特异性达86.96%,与国内外研究基本一致。此外,我们还发现七项抗体对鳞癌和腺癌诊断的特异性相当(均为86.96%),但对鳞癌的诊断具有更高的敏感性(分别为57.14%,46.15%)。
虽然七项TAAbs联合判断后敏感度明显提高,仍不到50%,临床单独使用具有局限性。而将人口学特点和胸部影像学特征建立回归模型并引入七项TAAbs后行二元Logic回归分析显示模型准确度提高到89.09%,特异度提升到87.5%,仍保持89.36%高敏感度。模型利用TAAbs高特异性克服了胸部CT筛查的高假阳性率,同时维持了高敏感性及准确度。该模型在肺部结节中恶性阳性预测值达97.67%,表明对高危人群进行早期肺癌筛查时能得到良好的预判。研究者Massion等对低剂量螺旋CT筛查直径为4~20 mm的肺部结节患者进行血清EarlyCDT肺7种自身抗体筛查,阳性患者的结节恶性风险增加2倍以上[20]。同样提示肺部结节筛查影像学改变联合TAAbs明显提高肺癌的早期诊断准确度,使更多的患者在肺癌早期得到及时治疗,从而提高生存率,减少治疗疾病的经济负担。
我们的研究也存在不足。本次研究样本量偏少,主要针对TAAbs联合影像学特点及人口学特征对非小细胞肺癌的早期诊断研究,需要纳入更多的鳞癌及小细胞肺癌等其他病理类型早期肺癌进一步校正风险预测模型公式,达到最佳预测结果。
