格拉斯哥及改良格拉斯哥预后评分对特发性肺纤维化急性加重患者预后的意义
2021-08-23卢文佳张晓萍孙广浩王瑞涛邵润霞
卢文佳 张晓萍 孙广浩 王瑞涛 邵润霞
特发性肺纤维化急性加重(acute exacerbation of idiopathic pulmonary fibrosis,AE-IPF)是特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)患者死亡的主要原因,患者一旦发生急性加重,其死亡率会增加至40%~80%[1-3]。而应用血清学标志物及便捷的评分系统预测AE-IPF患者预后的报道并不多见。
格拉斯哥预后评分(glasgow prognostic score,GPS)及改良格拉斯哥预后评分(modified glasgow prognostic score,mGPS)不仅能反应全身炎症情况,也可反映机体近期的营养状态,能综合性评估患者身体状况[4-5]。近年来多研究表明GPS、mGPS是多类癌症的独立预后因素[6-8],而GPS可作为AE-IPF患者预后评估的报道目前仅发现1篇[9],mGPS对其预后价值的报道尚未发现。本文回顾性分析了GPS、mGPS及血清学标志物与AE-IPF患者预后的关系,并比较了GPS、mGPS预测AE-IPF患者预后的优劣。
资料与方法
一、资料来源
回顾性收集 2012年7月~2020年6月郑州大学第二附属医院以IPF为出院诊断的239例患者的临床资料,共纳入了61例AE-IPF患者为研究对象。纳入标准:(1)符合2016AE-IPF诊断标准的患者[10]。(2)临床病例资料、实验室检查完善者。排除标准:(1)入院时患有明确的肺炎、左心衰竭、肺栓塞或有明确原因的急性肺损伤的患者;(2)病历资料及随访信息不完善者。
二、方法
(1)从病历资料中提取性别、年龄、体质量指数、吸烟史、基础病史、本次发病呼吸困难持续的时长、入院体温、入院前IPF治疗、入院治疗、住院时长及患者结局。(2) 实验室数据:患者当次入院初次的血液前白蛋白(PA)、白蛋白(ALB)、总蛋白(TP)、C-反应蛋白(CRP)、白细胞计数(WBC)、嗜酸性粒细胞绝对值(EOS)、白介素-6(IL-6)、乳酸脱氢酶(LDH)检验结果;(3)行GPS、mGPS评分。GPS评分标准如下:血ALB≥35g/dL且CRP≤10mg/L为0分,血ALB<35g/dL或CRP>10mg/L为1分,血ALB<35g/dL且CRP>10mg/L为2分;mGPS评分标准如下:血CRP≤10mg/L为0分,血ALB≥35g/dL且CRP>10mg/L为1分,血ALB<35g/dL且CRP>10mg/L为2分。血PA、ALB、CRP由免疫比浊法检测,WBC、EOS由全自动血细胞分析仪(型号 Sysmex XE-2100)及配套试剂测定,IL-6由双抗体夹心ELISA法测定,LDH的ELISA检测试剂盒由默沙克公司提供。
三、治疗及随访
AE-IPF的治疗方案多应用糖皮质激素治疗,必要时可联合免疫抑制剂,目前尚无循证医学证据证明疗效[11-12],如有感染,联合抗生素治疗。记录患者当次住院结局,幸存者随访自入院至3个月内的生存状态。
四、统计学方法
结 果
一、不同结局患者的临床特征、血清学检查、院前用药的比较:死亡组(33例)伴有发热的比例较幸存组(28例)高,且院前口服吡非尼酮抗纤维化治疗者较幸存组低,有统计学差异(P<0.05)(见表1)。死亡组PA、ALB、TP、EOS水平较幸存组低,CRP、IL-6、LDH较幸存组高,均具有统计学意义(P<0.05)(见表2)。
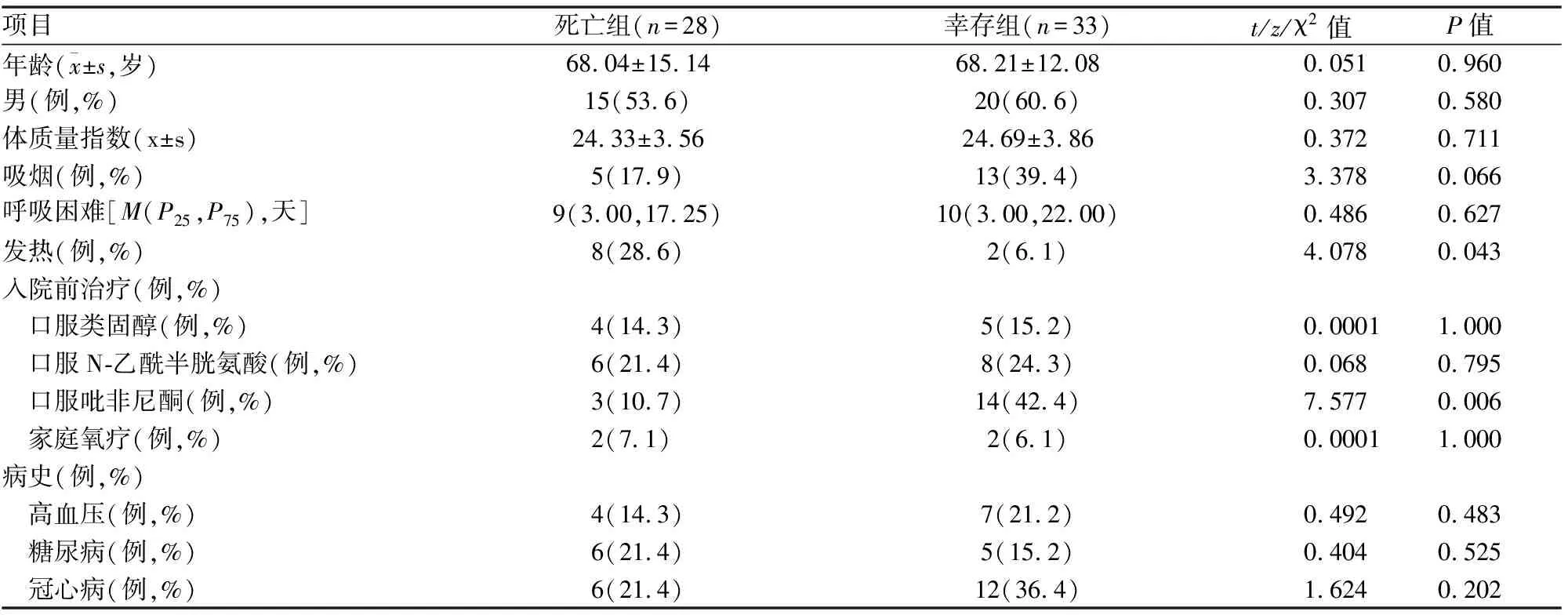
表1 不同结局患者一般临床特征的比较
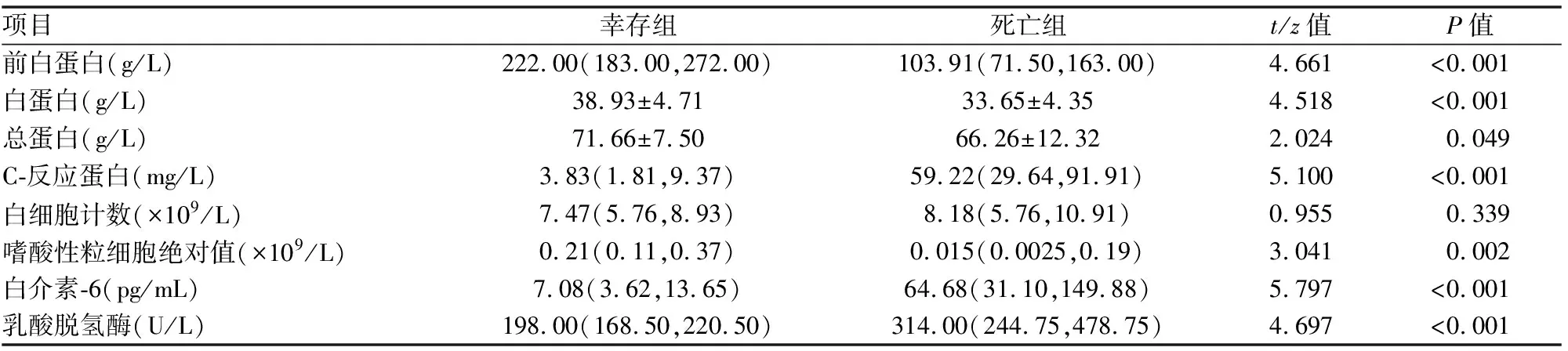
表2 不同结局患者的血清学检查结果比较
二、各因素分别与不同GPS、mGPS分值的比较。血PA、ALB、TP、CRP、WBC、EOS、IL-6、LDH与GPS、mGPS间均有关联(P<0.05)(见表3、4)。

表3 不同GPS分值临床特征及血清学水平的比较
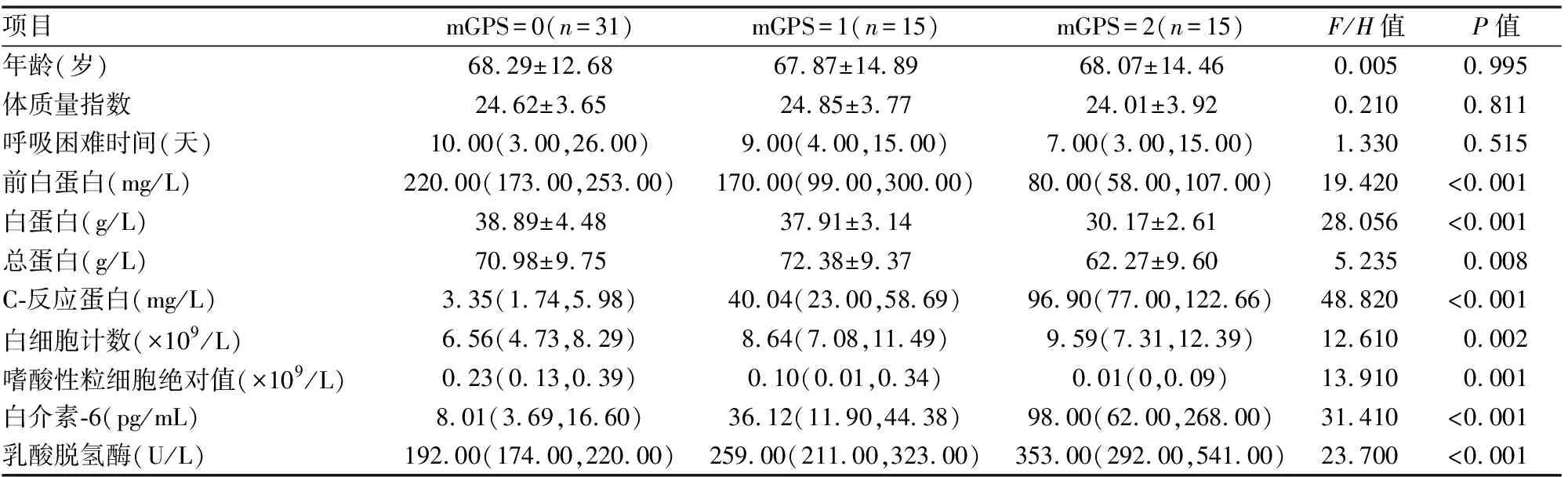
表4 不同mGPS分值临床特征及血清学水平的比较
三、单因素、多因素生存分析。单因素分析显示,血液中低PA(OR 0.98, 95%CI0.970~0.990,P<0.001)、ALB(OR 0.77, 95%CI0.685~0.890,P=0.001)含量,高CRP(OR 1.05, 95%CI1.022~1.072,P<0.001)、IL-6(OR 1.08, 95%CI1.030~1.130,P=0.001)、LDH(OR 1.02, 95%CI1.010~1.030,P=0.001)水平,GPS 1(OR 13.71, 95%CI3.000~62.690,P<0.001)、GPS2(OR 52.00, 95%CI7.680~351.960,P=0.008)、mGPS1(OR 18.56, 95%CI3.930~87.731,P<0.001)、mGPS2(OR 43.87, 95%CI7.100~271.270,P<0.001)是不良的生存预后因素(P<0.05)。将上述与总生存期(OS)相关的因素行多因素分析示:低PA、高LDH水平及GPS1-2、mGPS1-2是OS的独立预后因素(P<0.05)。如:表5。GPS、mGPS分组的生存曲线分别(见图1、2)。
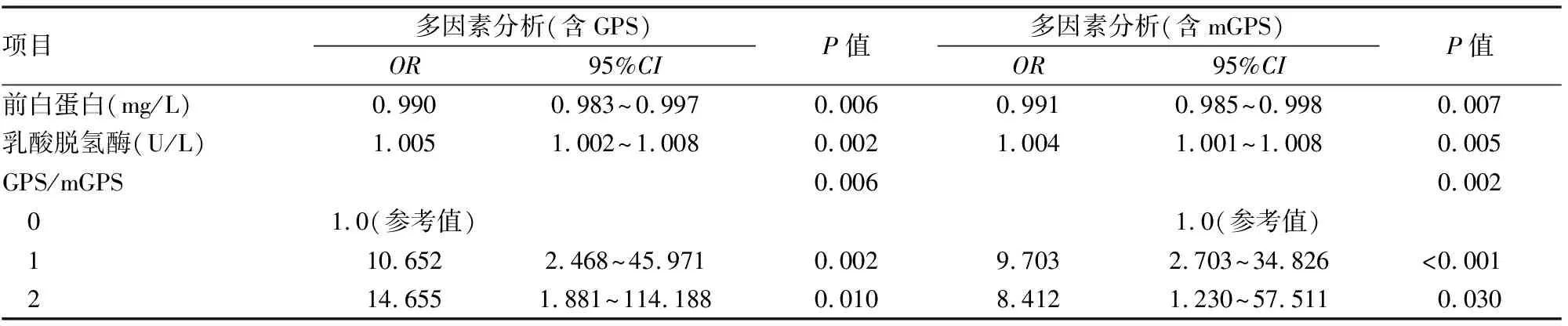
表5 多因素生存分析
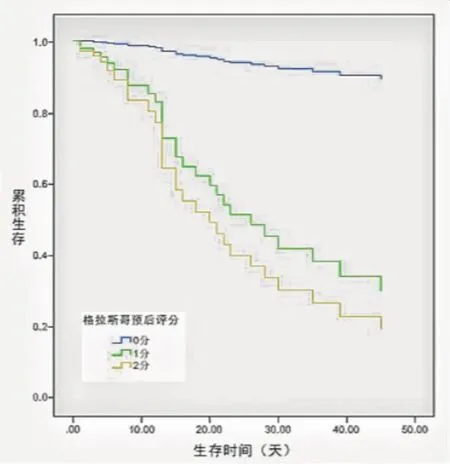
图1 基于GPS的患者的总体生存曲线
讨 论
GPS、mGPS系统中包含CRP、ALB两个因素。CRP是一种由肝细胞响应细胞因子的刺激而产生的蛋白质,在一定意义上可反映机体的全身炎症反应程度。已有多篇报道提出可将CRP水平作为AE-IPF患者死亡的预测因素[13-14],其中Song等对461例IPF患者进行回顾性调查研究后,认为将血清CRP水平作为AE-IPF院内死亡的预测因素具有一定的可行性。Matsumura等[15]报道称在应用吡非尼酮治疗IPF的过程中降低了血液中多种炎性标志物的水平,其中包括CRP,这表明高CRP水平在促进IPF的发生发展中有着不可忽视的作用。Kishaba等[16]通过对65例AE-IPF患者行回顾性研究发现由感染、手术或药物触发的AE-IPF患者与非触发性AE组相比,浸润范围更广,生存期更短,高血清LDH是AE-IPF患者90天死亡率的重要预测指标。本研究比较发现,死亡组发热比例、CRP水平较幸存组高,而院外规律口服吡非尼酮比例较幸存组低,具有统计学意义,支持了上述报道。在入院治疗的比较上,幸存组单纯使用激素治疗较多(42.4%,P=0.039),而死亡组使用抗生素、激素联合治疗较多(64.3%,P=0.004)均具有统计学意义(P<0.05),这也在侧面提示死亡组或许存在由细菌或病毒感染而触发的全身炎症反应。
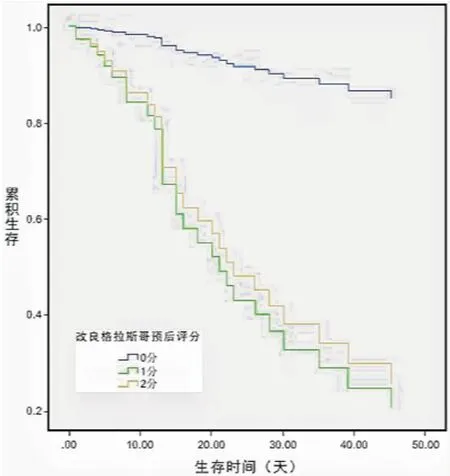
图2 基于mGPS的患者的总体生存曲线
PA、ALB均是由肝脏合成的负性急性时相蛋白,炎症反应时由血管内迁移至组织间隙,使血清含量降低。Li等[17]研究发现外周血PA较低是IPF预后不良的预测指标。PA较ALB对炎症反应更为灵敏,半衰期更短,在营养不良时反应迅速[18]。这也解释了本研究中PA是AE-IPF患者独立预后因素的原因。
多研究证明LDH是AE-IPF患者的死亡率预测因子[19-20]。Liang等[21]行小鼠实验研究发现通过抑制博来霉素诱导的小鼠急性肺损伤期间的LDH释放,能改善小鼠肺纤维化和炎症反应。Hachisu等[22]回顾性研究了84例AE-IPF患者发现:CRP,LDH可能是预测AE-IPF患者死亡率的生物标志物。本研究结果中,幸存组与死亡组间LDH有显著统计学差异,且LDH是AE-IPF的独立预后因素也符合以上结论。
本研究的多因素COX生存分析中GPS1、2,均是OS的独立预后因素。GPS 2分死亡率为86.7%(13例)高于GPS 1的死亡率63.2%(12例),GPS 1的中位总生存期(mOS)为30天,GPS 2的mOS为12天,相应的GPS 2(OR=14.655)的危险度较GPS1(OR=10.652)高,其评分等级越高,死亡危险度就越高,mOS就越短。KANG等[9]分析66例AE-IPF患者,认为关于预后不良和GPS评分呈正相关的一种可能解释是,炎症在AE-IPF中起着重要作用。在多因素分析中mGPS1、2也均是OS的独立预后因素。mGPS 2死亡率为86.7%(13例),mGPS 1的死亡率73.3%(11例),mGPS 1的mOS为23天,mGPS 2的mOS为12天,然而mGPS1分(OR=9.703)的危险度却要高于2分(OR=8.412)。根据mGPS的评分标准,将原为GPS1分的3例幸存者、1例死亡者划至了mGPS0分,而在2分组,两者评分标准一致,因此在mGPS评分制中加大了0分与1分之间的生存时间差异,提高了1分的危险度。在肺癌及多种癌症的生存预后分析中,GPS、mGPS预测癌症患者生存预后的优劣,不尽相同,结合本研究结果,初步提示与mGPS相比较,GPS在评分等级上对AE-IPF预后的参考意义要优于mGPS。
GPS、mGPS及血清学标志物对AE-IPF患者的预后评估简单易行、费用低廉、便于临床应用,在临床综合管理及治疗上可有一定的帮助。
本研究收集样本量较少,GPS0、1与mGPS0、1例数相差不大,对总体估计的准确率不高;由于本研究是回顾性研究,对于血清学分析及GPS、mGPS评分的选取,均采用住院首次检验结果,没有动态观察血清学波动及GPS、mGPS评分后续的改变,有待于前瞻性的、大样本资料的研究完善相关论证。
综上所述,低PA、高LDH水平、GPS1-2、mGPS1-2均是AE-IPF患者的独立预后因素;在评分等级上GPS评分与AE-IPF患者死亡的危险度呈正相关,要优于mGPS。
