4-香豆酸辅酶A连接酶响应大豆孢囊线虫胁迫的潜在功能
2021-08-22王惠张顺斌金贺王晗张耕华夏诗宁陈井生段玉玺
王惠 张顺斌 金贺 王晗 张耕华 夏诗宁 陈井生 段玉玺
(1. 沈阳农业大学生物科学技术学院,沈阳 110866;2. 黑龙江省农业科学院,哈尔滨 1500862;3. 沈阳农业大学植物保护学院, 沈阳 110866)
大豆孢囊线虫(Heterodera glycines Ichinohe)是动物界、纽带科、孢囊线虫属土传内寄生线虫,其独特的生物学特性和在恶劣条件下长期存活的能力使得它仍然是大豆产区病虫害防治策略的目标之一[1]。大豆孢囊线虫病在全世界各地均有发生,并造成了不同程度的危害[2]。它不仅通过侵染大豆根部影响地上部分的生理性状,如叶片发黄、矮小等,而且也会使得大豆地下部分根瘤减少造成其他微生物对伤口的二次侵染[3],甚至在条件适合的情况下,形成的孢囊在土壤中可以存活10年之久[4]。因此,对于大豆孢囊线虫的防控治理显得刻不容缓。
大豆孢囊线虫入侵大豆根部,需破坏植物的细胞结构并进一步诱导形成使其生长发育的唯一营养结构合胞体(syncytia)。由此可见,大豆孢囊线虫与大豆的互作涉及大豆的物理防御[5]及由物理防御诱发的其他防御反应。细胞壁作为维持植物细胞结构的一种物理障碍[6],可以阻止真菌、细菌、线虫等病原物对植物的侵害[7],是防御大豆孢囊线虫的关键因素之一。因此,将细胞壁与大豆孢囊线虫抗性联系起来[7],通过分析细胞壁的生物学成分及其相关的调节因子有助于了解大豆孢囊线虫的抗性机制。木质素作为构成细胞壁、内皮层和凯氏带的重要成分[8],在植物逆境调控和细胞壁抗性中发挥关键作用,目前对木质素的研究涉及各种病虫害胁迫下含量和相关基因的响应分析[9],以及木质素降解和高值转化利用[10]等,而关于大豆孢囊线虫胁迫下木质素生物合成的关键酶4-香豆酸辅酶A连接酶(4-coumaric acid-CoA ligase)的响应和基因应答研究较少,因此本论文从细胞壁中木质素生物合成关键酶4CL出发,探讨4CL在大豆孢囊线虫胁迫中的响应机制。
1 大豆孢囊线虫概况
1.1 大豆孢囊线虫
大豆孢囊线虫是大豆的重要病害[11],分布于世界种植大豆的所有产区[3]。据统计,线虫大概有4 100种,2012年研究者调查了线虫的基本情况列举出10种重要线虫。其中,孢囊线虫(cyst nematode)和根结线虫(root-knot nematode)因需要建立取食结构供给营养较为突出而包含在其中[12]。大豆孢囊线虫是一种土传性病害,其孢囊在土壤中孵化出二龄幼虫(second-stage juveniles,J2)[12],J2只有在条件适宜并遇到合适寄主和相应的根系分泌物后才会对寄主根部进行侵染。大豆孢囊线虫寄主相对专一,主要为豆科植物,但是在烟草、卷心菜等[13]也见其寄生为害。虽然大豆孢囊线虫可以侵入非豆科植物,但在这些植物上一般不能完成生活史。大豆孢囊线虫的生活史和致病特性使其成为研究植物-寄生线虫寄生机制和致病机制的重要模型[1],为本文的主要阐述对象。
1.2 大豆孢囊线虫致病机制
大豆孢囊线虫的生活史可以简单归类为3个时期:卵期、幼虫期和成熟期[14]。其中J2在识别寄主之后通过口针刺入根组织来完成侵染[15],这一过程会造成大豆根部的机械损伤,也是大豆受到二次感染和木质素沉积修复机械损伤的一个阶段。前人研究发现由机械损伤引起的木质素积累和响应基因的表达,结合线虫的致病机制,侵染初期木质素很可能也参与其中[16-17],并通过木质化和衍生的细胞壁抗性对大豆孢囊线虫抗性进行调控。J2穿透表皮组织后向维管组织迁移,整个过程依靠口针的反复刺入和分泌物的作用破坏表皮细胞和皮质[18];幼虫在到达维管束后开始建立取食位点并注入大量的分泌物来溶解相邻细胞的细胞壁,细胞壁溶解后原生质体融合形成多核取食位点:合胞体[1]。综上,在线虫侵染初期和合胞体建立后期,植物寄生线虫效应因子对宿主细胞壁的修饰作用均具有重要功能。可见讨论构成细胞壁抗性的木质素的生物合成与大豆孢囊线虫抗性之间的关联非常必要。
1.3 大豆孢囊线虫防控
大豆孢囊线虫的防治目前集中在轮作、生物防治及利用分子生物学手段进行抗性育种几个方面。轮作指在大豆种植地区种植非宿主植物或抗感混种的方法,但轮作效果受到轮作植物、年限以及种植顺序的影响,且由于线虫在土壤中的久居性不能短时间内从根本上控制线虫,也不是防治线虫达到增产的最佳方式。生物防治主要包括食线虫真菌、内寄生真菌、产生抗生素的真菌、调节植物应答反应的真菌及其诱导大豆系统获得性抗性和诱导防御反应的真菌[19],是一种更加友好的方式[20]。而利用分子生物学手段探究抗性机制,进行抗性育种是目前研究者进行大豆孢囊线虫研究的一种方法,也是目前线虫防治领域比较经济有效的手段之一[21]。大豆对SCN的抗性主要包括遗传学分析中Rhg1编码的氨基酸转运体(amino acid transporter,GmAAT)、α-可溶性N-乙基马来酰亚胺敏感因子附着蛋白(alphasoluble N-ethylmaleimide-sensitive factor attachment protein,α-SNAP)、创伤诱导蛋白(N-ethylmaleimidesensitive factor,NSF)以及编码丝氨酸羟甲基(serine hydroxymethyl-transferase,GmSHMT)的Rhg4。研究发现,过表达Rhg1、Rhg4编码的序列导致该位点对大豆孢囊线虫的抗性[22-26],此外抗性基因也包括比较基因组[4]产生的GmHs1pro-1以及转录组测序发现的线虫侵染后造成的不同代谢途径差异表达基因[27-28]等。大豆抵御大豆孢囊线虫的分子机制是一个复杂的过程,其涉及到线虫生理小种、大豆品种以及自然选择的调控。大豆孢囊线虫的这种不可控性使得轮作、生物防治和抗性品种对大豆孢囊线虫的治理都存在一定的时间局限性,其可能会随着时间的增长使得线虫产生抗性,故期望通过把线虫抗性与木质素沉积导致的细胞壁增厚联系起来,探究宿主植物的分子机制,延长植物的抗性周期[13,29]。
2 细胞壁抗性与木质素
2.1 木质素
木质素作为植物细胞壁主要组分之一,参与植物应对生物和非生物胁迫的响应。细胞壁是植物抵御病原侵染的物理障碍,也是病原与植物互作的重要场所,是一个动态的结构[30]。细胞壁主要由初生细胞壁、次生细胞壁组成[31],初生细胞壁由纤维素、果胶等组成,次生细胞壁由木质素等组成。研究表明,线虫在入侵宿主时会分泌纤维素降解酶和纤维素结合蛋白等效应因子,降解宿主细胞壁组分:纤维素,从而协助线虫建立取食位点[31]。作为植物次生细胞壁的组分之一,木质素在细胞壁分解中具有重要作用[32]。次生细胞壁上的木质素可通过阻碍纤维素酶对纤维素的结合,抑制纤维素酶对纤维素的降解作用,并且与纤维素、半纤维素相连构成细胞骨架[33],赋予细胞壁机械强度[34],可见木质素是细胞壁抗性的重要组成部分。
木质素作为细胞壁成分可以维持细胞结构、运输养分以及抵御病原物的入侵[35],是植物生长发育的重要物质[36]。木质素作为植物次生细胞壁的主要成分[37],是世界上仅次于纤维素的第二高分子聚合物[38]。木质素的基本结构单位是苯丙烷[39],是通过莽草酸途径、苯丙烷代谢途径和木质素合成特异途径产生的,其中苯丙烷代谢是植物次生物质合成的共有途径,也是由次生代谢转向木质素合成的关键代谢通路,而且病原体(包括大豆孢囊线虫在内)对细胞壁的刺激会触发苯丙烷代谢的防御反应[40]。
木质素生物合成与苯丙烷代谢是上下游的连接关系,木质素来源于植物的苯丙烷代谢,由香豆醇、松柏醇、芥子醇衍生而来[41]。而这3种醇是由香豆酸、咖啡酸、阿魏酸、芥子酸等经过一系列酶促反应产生的。2007年研究发现,在Williams82接种SCN3后,35 611个大豆转录本中的429个基因均有不同程度的响应,包括基础代谢、苯丙烷代谢和木质素合成等[32-42],可见木质素响应SCN3的胁迫。木质素与线虫的响应目前在水稻、番茄、大豆[43-45]均有涉及,研究表明SCN4处理后抗病品种灰皮支中的木质素含量高于感病品种,增加了25.27%[45-46],而Veronico和Khanam等[43-44]分别对番茄和水稻接种南方根结线虫和水稻茎线虫发现,抗病品种木质素的间苯三酚染色响应强于感病品,且抗病水稻接种后相对于感病品种其木质素含量上升,可见木质素沉积在抵御线虫胁迫中发挥了重要的作用。
2.2 4CL参与苯丙烷代谢合成木质素
由莽草酸途径起始的苯丙烷代谢途径是植物合成木质素、黄酮、生物碱、水杨酸等次生代谢产物的重要途径,主要是从苯丙氨酸起始,在苯丙氨酸解氨酶(PAL)催化下生成相应的肉桂酸及其衍生物[5],肉桂酸在肉桂酸羟化酶(C4H)作用下生成香豆酸及其衍生物,香豆酸及其衍生物在4CL催化作用下进行下一步代谢反应,其中木质素类高分子聚合物是苯丙烷代谢中重要一环[47]。
PAL与C4H、4CL是合成酚类、黄酮、木质素等次生代谢物质的关键酶[48]。其中PAL和C4H被认为是苯丙烷代谢途径的通用调控酶[49],PAL也是连接初生代谢和次生代谢的关键酶,也被称为苯丙烷类代谢的中心酶,研究最为广泛[50-51],C4H是催化反式肉桂酸向对羟基香豆酸转化的关键酶,属于细胞色素P450单加氧酶,为下游木质素合成提供反应前体[52-54]。而4CL处于苯丙烷代谢分支点,是苯丙烷代谢途径向木质素单体合成特异途径的重要催化酶,决定了木质素单体的类型,保证了下游途径的顺利进行。此外除苯丙氨酸在PAL和C4H催化作用产生木质素合成的香豆酸前体之外,酪氨酸也可以不需羟基化酶的作用直接产生合成木质素通路的香豆酸[55],也就是说不经过PAL和C4H的催化也可以进行木质素的生物合成,因此4CL是苯丙烷代谢通路的重要调控物质,也是合成木质素单体的重要催化酶。
3 4CL的研究进展
3.1 4CL的起源和分类
4CL是酰基激活酶系超基因家族成员[56-57]。其可以通过ATP活化羧酸酯的底物从而形成酰基腺苷酸的中间体,而此酰基腺苷酸中间体会与CoA形成相应的硫酯进而对木质素过程中的羧酸类底物进行催化[56](图1)。
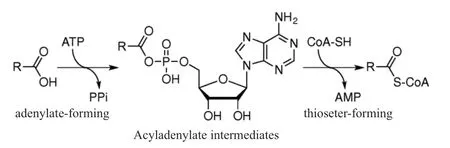
图1 4CL的催化机制[56]Fig.1 Catalytic mechanism of 4CL[56]
4CL常以基因家族的形式存在,具有广泛的催化底物[58],已在桂花[59]、拟南芥[60]、银杏[61]、大豆[62]、金银花[63]、水稻[64]、高粱[65]、毛白杨[66]等进行了克隆和功能分析,拟南芥具有At4CL1、At4CL2、At4CL3、At4CL4[60]四个基因家族成员,系统发育表明该基因家族被分为class1和class2[67-68],class1主要负责木质素的生物合成,class2主要负责黄酮的生物合成。研究发现,拟南芥中的4CL1、4CL2、4CL3、4CL4均参与木质素的沉积,但4CL1是木质素沉积的主要参与者,4CL3主要负责黄酮的生物合成,只有在4CL1不存在时4CL2、4CL3、4CL4才可能会参与木质素合成[60,69],因此4CL在植物体内具有重叠但又不同的功能[69],是黄酮和木质素单体合成过程中重要的调节物质[66],可能受逆境影响发挥不同的生物学功能,进而决定了木质素合成的走向和木质素单体的类型。
3.2 4CL参与植物响应生物和非生物逆境胁迫
4CL是木质素合成途径的限速酶[70],主要催化香豆酸(coumalic acid)、阿魏酸(ferulic acid)、咖啡酸(caffeic acid)、芥子酸(sinapic acid)等各类羟基肉桂酸生成相应的硫脂[39],然后在肉桂酰CoA还原酶(cinnamoyl CoA reductase,CCR)、肉桂酰乙醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)等酶促反应下合成相应的单体醇,最后在过氧化物酶(peroxidase,POD)和漆酶(laccase,LAC)作用下氧化合成相应的木质素聚合物沉积在细胞壁中[41,55],与纤维素、半纤维素共同形成了植物细胞壁的抗性屏障[71]。需要注意的一点是在诸如大豆孢囊线虫等逆境胁迫下,植物会产生一系列的活性氧导致氧爆发。其中POD不仅参与了植物清除活性氧的过程[72-73],而且木质素的降解也受到木质素过氧化物酶(lignin peroxidase,LiP)、通用过氧化物酶(general peroxidase,GP)、锰过氧化物酶(manganese peroxidase,MnP)的调控[74-76],由此推测,在大豆孢囊线虫入侵植物根部时产生氧爆发,这诱导了POD的表达从而降解木质素使植株感病,而合成木质素的4CL为了抑制木质素的降解或病原物的侵染可能也会参与这一过程。
4CL通过催化辅酶A硫脂的形成在植物生长发育中发挥一定的作用[77]。Chen等[77]为了分析4CL对干旱胁迫的响应以及相应的代谢变化,将水曲柳Fm4CL-like1转化烟草发现,转化植株的木质素含量相对于野生型提高了39.5%,其他指标也有相应的优势,表明4CL参与了细胞壁的发育和木质素的合成,进而抵御非生物的胁迫。同时,2015年有研究发现,在应对盐胁迫时杨树中4CL2、4CL11、4CL12发生了明显上调[78]。可见,4CL在应对非生物胁迫时产生了积极的胁迫响应。除参与非生物胁迫,Oliveira等[79]和Chen等[80]研究发现,在菌核盘菌与菜豆互作的基因表达谱也出现了4CL的响应情况,且在大豆中过表达4CL可显著提高大豆对大豆疫霉菌的抗性。此外,赵晶[81]利用生防细菌Sneb159诱导木质素抗性的研究表明,4CL响应大豆孢囊线虫的胁迫。
现有研究表明,4CL的基因表达受到LTF、PtoMYB216、PtrMYB3和PtrMYB20等MYB类转录因子的调控,在植物受到环境刺激时上述转录因子与4CL基因的启动子结合激活4CL 基因的表达和正调控木质素的合成,以响应包括蚜虫、干旱、机械损伤等在内的各类生物和非生物胁迫[69,82-88]。综上,4CL通过木质素的生物合成参与了植物的逆境调控过程。
4 小结与展望
大豆孢囊线虫严重影响了大豆的产量,除了线虫自身危害,还包含线虫所导致的其他微生物对大豆的二次危害。因此,为了降低线虫的危害,探索线虫的致病机理和大豆本身的防御反应显得刻不容缓。大豆孢囊线虫的二龄幼虫是其侵染阶段,在17-23℃较为活跃,在其识别到宿主后开始入侵,其入侵的关键是需要二龄幼虫不断移动,到达植物组织的中柱定殖建立取食位点,形成合胞体。而定殖的关键是线虫的移动,细胞壁作为细胞的保护组织具有机械保护性,线虫想要定殖就必须溶解细胞壁才可以完成其生命周期,因此细胞壁对线虫的定殖起到了限制作用。而细胞壁中的木质素是细胞壁发挥作用的重要成分,可见木质素的生物合成与线虫侵染密切相关。
4CL作为一个基因家族,是苯丙烷代谢通路中关键酶,响应病原对大豆的胁迫[89]。目前关于4CL与木质素相关性的分析主要集中在组织特异 性[59,90]、正相关、负相关[91]或相同趋势几个方面,研究发现玉米的Zm4CL1[92]和柳枝稷的Pv4CL1突变体[93]与对照相比,均表现为木质素含量下降且Pv4CL1突变体次生细胞壁相对较薄,可见该基因的确参与了木质素和次生壁厚薄形成的生物过程,进而对植物自身的防御能力有积极的作用。在大豆孢囊线虫研究领域,Itha等[94]和 Hosseini等[95]研究发现,合胞体发育过程中,木质素生物合成中的4CL在接种后的2、5、6、8、10 d响应了大豆孢囊线虫的胁迫;过表达该基因时,其对线虫的雌性指数几乎没有影响,但在抗病品种中4CL的确被诱导表达[96],同时,根结线虫处理后,4CL也响应表达[97],可见在线虫侵染过程中4CL响应线虫胁迫。此外,线虫、细菌、真菌等在入侵植物时也会分泌与苯丙烷代谢相关的分支酸变位酶等分泌物,因此线虫分泌的分支酸变位酶可能与植物本身的分支酸变位酶存在竞争性从而抑制了植物本身的苯丙烷代谢所引起的防御反应,进而利于大豆孢囊线虫的成功寄生。可见,线虫和大豆之间竞争关系可能影响线虫的抗性。根据以上特点,如若以4CL为媒介探讨木质素的合成是否会影响细胞壁抗性进而抵御大豆孢囊线虫的侵染非常必要。大豆孢囊线虫的防治非常复杂,以木质素为出发点对抗线机制进行研究不仅可以从细胞壁角度对抗线虫进行分析,而且通过4CL与木质素的研究也对木质素降解和细胞壁在逆境胁迫中的作用有一定的推动[98]。
木质素合成是一个复杂的通路,其受到多种酶的调控,而4CL作为其生物合成通路中重要转折酶,其决定了木质素单体的类型,对其研究不仅可以了解其在应对不同条件胁迫下的响应,也可以对其基因家族成员的生物学功能及对大豆孢囊线虫的抗性机制有更加清楚的认识。此外,由于线虫自身分泌的分支酸变位酶与宿主的竞争从而影响木质素的生物合成,对4CL的研究可以明确该基因对抑制线虫的竞争性互作具有积极作用。综上,对大豆孢囊线虫胁迫下4CL的潜在抗性机制进行研究具有重要的意义。