寄主对大豆孢囊线虫抗性相关基因功能研究进展
2021-08-22韩少杰郑经武
韩少杰 郑经武
(浙江大学农业与生物技术学院生物技术研究所,杭州 310058)
大豆(Glycine max)是世界范围内种植最多的豆科作物,是优质植物油料来源和食用、饲用蛋白质主要来源。中国是大豆的原产国,有丰富的大豆饮食文化和悠久的大豆消费习惯,目前大豆在我国的商用食用油、畜牧蛋白源饲料等领域需求量巨大,但我国受耕地、种植条件限制,大豆种植的效益较差,大豆种植规模不大,供需缺口主要依赖进口。大豆主要种植国家有巴西、美国、阿根廷和中国。公开数据显示,2020年度,我国大豆总进口量超过1亿t,创历史新高,同期我国大豆产量1 920万t。目前大豆作为国际重要贸易农产品,在我国国民经济、对外贸易交往中扮演重要角色。
大豆孢囊线虫病是威胁世界范围内大豆主要产区生产安全的重大病害[1-2]。其病原物大豆孢囊线虫(soybean cyst nematode,SCN,Heterodera glycinesIchinohe)系一种土传、定居性、专性寄生的病原线虫。仅美国1996-2016年期间,SCN造成的经济损失累计超过320亿美元,平均每年超过15亿美元以上[3]。SCN在美国大豆上造成的经济损失比其他所有大豆病害加起来的总和要多。
大豆孢囊线虫在我国主要分布于东北、黄淮海、长江中下游等主要的大豆产区,此外在浙江、江苏、云南、贵州等20个省份都有报道,截止到2016年研究显示该线虫已扩散到西北内蒙等偏远地区,防控形势严峻[4-5]。在我国,大豆孢囊线虫可造成显著产量损失:10%-50%减产[4];东北和黄淮海大豆产区危害土地面积大:每年危害达267万hm2以上[5];经济损失较大:大豆孢囊线虫病每年可给我国造成1.2亿美元经济损失[6]。因此,对大豆孢囊线虫的防控研究意义重大。
在对大豆孢囊线虫防控的诸多治理措施中,最绿色、经济的是作物轮作和抗性品种应用,其中抗性品种的应用是绿色防控最关键措施[1,8]。目前SCN抗性品种中的抗性相关基因,包括源于抗性大豆品种PI88788的rhg1-b以及源于PI548402/Peking的rhg1-a和Rhg4[9],和其他一系列微效数量性状抗性位点(QTL),如来源于PI468916的cqSCN-006和cqSCN-007,以及来源于PI567516C的Chr10-QTL等。通过全基因组关联分析(GWAS)和分离群体研究,目前已有报道超过300个SCN抗性相关QTLs,广泛分布于大豆20个染色体中(图1)。
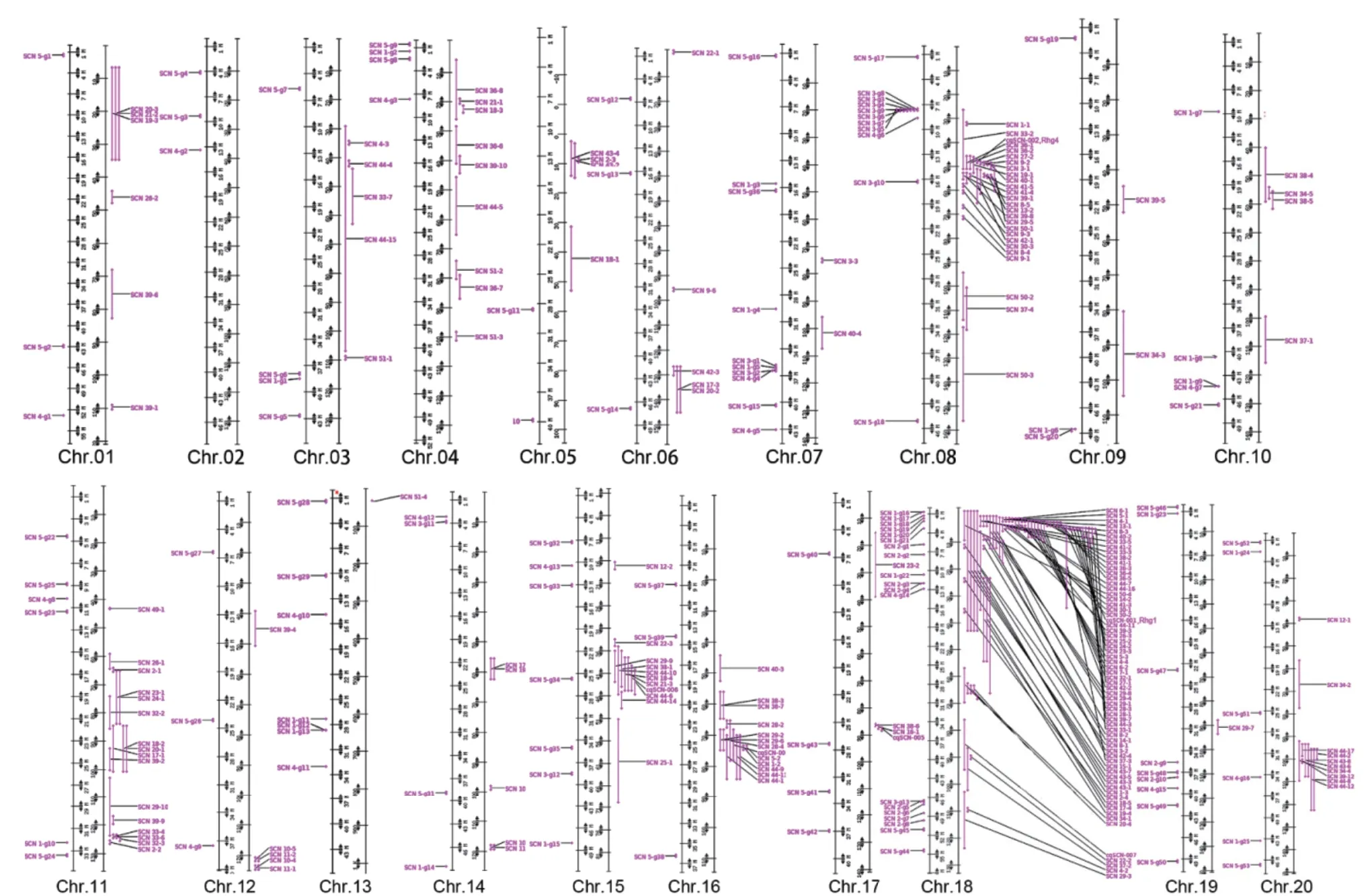
图1 已知SCN相关QTLs在大豆基因组图谱中的分布示意图Fig. 1 Distribution diagram of known SCN-related QTLs in soybean genetic map
大豆孢囊线虫作为一种专性寄生线虫,存在明显的生理分化现象,按照其对不同抗性背景寄主表现出的致病力差异可以细分为不同的生理小种[10]。国内外随着单一抗性位点在田间连年应用,SCN生理小种群体也在抗性筛选压力下随之不断进化,导致现有的天然抗性基因抗性降低[11-14]。在天然抗性原本就有限,面临失效而枯竭的大背景下,如何深入研究现有抗性位点的抗性机制、发掘转基因株系的优质抗性基因靶标,是我国乃至全世界大豆孢囊线虫绿色防控研究的难点和重点。近年来越来越多的研究者在大豆对SCN抗性相关基因的发掘、相关基因的生理生化功能以及抗性机制等方面的研究有许多突破。本文概述近年来有关大豆对SCN抗性相关基因的功能研究进展,并对未来研究的前景和发展方向进行了探讨。
1 SCN抗性相关QTL位点基因功能的研究
由于植物病原线虫的独特属性,其与已知的病原-植物寄主互作机制可能有所不同。一个明显的例子就是现知SCN抗性位点编码的抗性蛋白没有传统病原微生物表面分子模式受体蛋白(pattern recognition receptors,PRRs)或者胞内NLR受体蛋白(nucleotide-binding-leucine-rich-repeat,NLR),并且几个已知的重要QTL附近的LRR-RKLs激酶都被离体的抗性实验证明没有抗SCN的功能[15-16]。这些结果都暗示大豆孢囊线虫可能由于其动物属性,在与寄主互作过程中,更具有活力和主动性,在病原识别机制上可能有独立于传统植物微生物免疫识别激活机制的特殊机制。近年来,随着大豆基因芯片、二代转录测序和显微激光切割等技术的应用,以及全基因组测序普及大豆基因组图谱的不断精细化完善,越来越多的SCN抗性相关潜在基因和其功能被报道[17-23]。通过EMS突变经典的感病或抗性品种,得到遗传稳定的二代突变体后代,再结合传统定向诱导基因组局部突变技术(targeting-induced local lesions in genomes,TILLTING)或TILLTING加二代测序方法,进行正向或反向遗传学筛选也是一个发现和验证潜在抗性基因的有效手段[24-25]。目前,随着对一些已知重要抗性位点编码的基因和表达受SCN侵染调控的相关基因的深入研究,SCN与大豆互作的机制也逐步完善。
大豆抗性相关QTL中,研究最充分的是最重要的两个主效抗性位点Rhg1和Rhg4。下面,将分别从两个位点编码基因的功能、基因结构特征以及二者协作机制等方面做详细介绍。
1.1 Rhg1
Rhg1(Resistance to Heterodera glycines 1)是 最早源于经典品种PI88788的主效抗性位点,位于18号染色体。据统计,美国SCN主栽抗性的品种中,95%以上(共810种)品种抗性均来自于PI88788株系中Rhg1位点[26],可见该位点提供抗性的稳定性和实用性。Cook等[27-28]通过染色体荧光原位杂交(FISH)等技术手段发现,Rhg1是一段长31.2 kb的基因片段,其多拷贝化与SCN抗性产生有直接关系。该研究发现,以Williams 82为代表的野生型感病品种Rhg1只有一个拷贝,称作Rhg1单拷贝型或rhg1-c型;以PI548402/Peking为代表的抗性品种有2-3个串联多拷贝,称作Rhg1低拷贝或rhg1-a型;以PI88788为代表的抗性品种有7-10个串联多拷贝,称作Rhg1多拷贝或rhg1-b型。最近,随着大豆泛基因组测序注释成功,发现基因的多拷贝化在大豆泛基因组中广泛存在[29],该文正好是对大豆基因多拷贝化的生物学意义的一个注解。对不同Rhg1拷贝数大豆样品中Rhg1编码的4个基因转录水平分析结果发现,未侵染条件下,越多拷贝数Rhg1,有越高的转录水平[28]。不同拷贝数的Rhg1表现出各自独特的基因结构的差异,如SNP、片段插入、缺失的多态性。DNA的变异对基因表达、抗性的影响仍待研究。
Rhg1位点编码的4个基因其中有3个被证明参与了Rhg1高拷贝品种对SCN的抗性反应[27]。这3个基因分别是:Glyma.18G022400(Wm82.a1,Glyma18g02580)编码一个可能的氨基酸转运蛋 白GmAAT;Glyma.18G022500(Wm82.a1,Glyma18g02590)编码参与细胞囊泡运输过程的功能保守蛋白α-SNAP(α-soluble NSF attachment protein,也称SNAP18);以及Glyma.18G022700(Wm82.a1,Glyma18g02610)编码一个含有WI12损伤诱导结构域的蛋白WIP。拟南芥和茄科马铃薯转化大豆源Rhg1位点后,分别表现出对甜菜孢囊线虫(Heterodera schachtii)、马铃薯金线虫(Globodera rostochiensis)和马铃薯白线虫(G. pallida)相应抗性的增加[30]。
Rhg1位点编码的α-SNAP蛋白以不同机制参与到以上两种不同类型的抗性反应中,是大豆对SCN抗性互作中研究较为深入的功能蛋白[31-33]。α-SNAP是参与细胞囊泡运输过程的功能保守蛋白,与NSF(N-ethylmaleimide sensitive factor)蛋 白 互作形成复合体参与SNARE(soluble NSF attachment protein receptor)的回收。α-SNAP在SCN侵染的抗性反应中能够特异性聚集表达在SCN的取食细胞合胞体中[31,34]。不同Rhg1拷贝数大豆品种编码的α-SNAP存在氨基酸多态性差异,这些C末端变异导致了其与NSF结合能力发生差异,间接影响了细胞内囊泡运输回流机制。过表达多拷贝Rhg1编码的α-SNAP可以造成植物细胞死亡,而野生型感病品种的α-SNAP则不能[31]。而α-SNAP本身作为细胞生命活动必须的看家基因,抗性类型α-SNAP发生的突变,对植物自身生命活动也产生了威胁;研究发现,为了平衡抗性品种中突变α-SNAP对植物细胞的毒性,几乎所有已知含有抗性类型α-SNAP的大豆品种都共同进化出一个与其结合能力更强的NSFRan07,以此保持基本的细胞生命活动不受影响[33]。α-SNAP的不同突变型发挥不同生理功能,从一个角度说明Rhg1不仅拷贝数差异,也可以通过自身基因序列变异共同影响对SCN抗性[32,35]。α-SNAP在11号染色体上的同源基因SNAP11(Glyma.11G234500)被证实是参与SCN抗性的微效基因,一同参与了Peking类型抗性的大豆寄主对SCN的抗性[36-37]。
Rhg1位点编码的另外一个抗性相关基因GmAAT的抗性机制研究目前仍处于初级阶段。与α-SNAP不同,GmAAT在不同Rhg1单倍型(haplotype)中不存在氨基酸序列的差异,暗示了其两者可能存在截然不同的作用机制。沉默GmAAT可以导致大豆对SCN抗性受损[27];GmAAT含有保守的氨基酸转运结构域,但尚没有直接证据证明该蛋白在大豆中可以直接行使转运氨基酸的功能。过表达GmAAT的大豆对过量谷氨酸的耐受度增加,间接证明其有影响谷氨酸耐受度的相关功能[38]。过表达GmAAT能够激活茉莉酸信号通路,可能通过激活植物激素通路影响抗性,具体的互作机制仍未知[38]。通过GmAAT特异抗体,应用免疫电镜技术观察GmAAT在SCN侵染下的原生表达定位状态,在亚细胞结构发现:当SCN入侵根系的侵染前期,只有在被SCN穿过的细胞内会特异性增加GmAAT蛋白的聚集,并在线虫直接接触的细胞内形成含有GmAAT免疫定位的抗性囊泡。Rhg1的拷贝数与前期GmAAT在相关结构中的富集倍数正相关,这种GmAAT表达量与囊泡聚集的程度与Rhg1介导的抗性相关[39]。进一步蛋白互作筛选发现,植物先天免疫ROS产生机制中的重要起始蛋白组分RBOHC2可以与GmAAT在囊泡中发生特异性蛋白互作,二者共同表达可以在植物细胞中诱导产生ROS前体超氧阴离子O2-。这些可能产生于线虫周边囊泡的O2-可以进一步在体外被转化成过氧化氢,直接其作用于线虫或者作为二级信号因子诱发下游更强烈的抗性反应[39]。Chen等[40]也报道Rhg1不同拷贝数抗性品种间ROS积累的速度和程度有差异,且ROS的产生机制与寄主对SCN抗性直接相关。GmAAT形成的抗性囊泡的生理生化属性以及GmAAT以怎样的分子机制参与其他植物激素信号通路如SA、乙烯等仍待进一步研究。现有的研究表明GmAAT与α-SNAP虽同属一个主效抗性位点,但二者从蛋白定位和生理功能的角度看,产生抗性的机制截然不同。
Rhg1位点编码的第三个抗性相关蛋白WIP研究较少,其他物种同源蛋白的相关研究也比较缺失;由于其蛋白序列较短,难以发现更有价值的功能结构域。其含有疑似损伤诱导结构域的具体生理功能也待证实。但WIP很可能通过与其他蛋白(包括Rhg1位点编码的其他蛋白)互作而参与损伤诱导病程相关分子模式(wound-inducible DAMPs,damage associated molecular patterns)在植物与植物线虫互作中扮演SCN侵染预警的作用。
1.2 Rhg4
Rhg4位于第8号染色体,是源于Peking和PI437654的主效、显性QTL之一[41-43]。刘世名等[44]在2012年通过TILLTING经典反向遗传学方法,鉴定到了Rhg4位点基因丝氨酸羧甲基转移酶(serine hydroxymethyltransferase,SHMT,也 称SHMT08)。SHMT的突变可影响Peking抗性类型寄主的抗性反应。类似于α-SNAP,SHMT是一个行使看家功能的蛋白,是参与体内叶酸合成信号通路的生化酶。野生型和Peking类型抗性大豆中SHMT基因只有五处序列变异,但产生显著感病和抗性的生物学差异,突变位点与表型之间的关联机制仍待进一步研究。值得注意的是,类似于α-SNAP,SHMT特异表达在线虫侵染所形成的合胞体细胞中[44]。通过遗传筛选,SHMT的结构和抗性功能得到了进一步验证[45]。
与Rhg1发生多拷贝化类似,最近通过全基因组测序发现Rhg4也存在约长35.7 kb的串联重复序列,多高倍化也可导致其编码基因转录水平上调[46]。该段Rhg4位点包含了3个基因:Glyma.08g108800(Wm82.a1,Glyma08g11480),Glyma.08g108900(S H M T,Wm82.a1,Glyma08g11490)和Glyma.08g109000(Wm82.a1,Glyma08g11500)。此外,Rhg4也同样存在单倍型变异,主要分为以野生型为代表的Rhg4-b(单拷贝)和以Peking为代表的抗性Rhg4-a(1-4.3个拷贝数)[46]。SHMT08在Peking和PI88788等抗性品种中存在一个与感病品种不同的抗性类型启动子序列,该启动子变异与更广谱的SCN抗性相关[46];PI548655(Forrest,Peking类型的抗性品种)和PI88788等抗性品种中SHMT08在SCN侵染早期的转录水平也都较野生型升高约2倍[47]。说明抗性类型的启动子可能在转录水平发挥侵染早期调控作用。Rhg1、Rhg4基因组学结合SCN抗性表型的功能基因组学研究再次证明大豆普遍地通过对自身特定基因位点的多拷贝化和序列结构变异来适应外界病原物的入侵。基因变化与SCN抗性之间对关联,尤其是表达调控机制仍需进一步研究。
1.3 Rhg1和Rhg4协作
Rhg1和Rhg4同属于重要的抗性位点,虽然作用机制各不相同,但二者有着很大的关联性和相似性,主要体现在以下几个方面:首先,这两个位点编码的功能蛋白SHMT8和α-SNAP之间存在互作,共同存在于一个蛋白复合体中,行使的具体功能及作用机制仍未知[48]。其次,Rhg1拷贝数少于5.6倍时,不能独立提供足够的SCN广谱抗性,必须要与Rhg4协作,这种Rhg1低拷贝加抗性Rhg4的组合统称为Peking型抗性(Rhg1-a+Rhg4-a/Rhg4-c),具体协作机制仍需进一步深入研究[43,46,49]。第三,随着进化,抗性品种中的Rhg1与Rhg4都有多个不同抗性类型的同源基因,表现为存在丰富的导致氨基酸序列变化的单核苷酸多态性变化(non-synonymous SNPs),这些变异带来的基因产物结构功能变化仍待深入研究。第四,二者都通过多拷贝化发挥额外抗性功能。越高拷贝数的Rhg4,能产生对多种不同毒力小种的SCN更广谱的抗性;Rhg1有更多拷贝数时,可以独立提供足够的抗性。第五,对106个大豆品系的全基因组重测序结果显示,Rhg1和Rhg4基因位点启动子和基因序列中的特定突变以及拷贝数差异共同决定了对不同SCN生理小种的抗性[46],这种抗性基因与病原生物共进化的关系值得进一步研究。
2 囊泡运输与SCN抗性
囊泡运输泛指生物细胞通过细胞膜包被运输活性物质与其他细胞或者外部环境发生交流的进程,包括胞内吞和外排等复杂的过程[50]。囊泡运输对植物免疫意义重大,细胞间隙中的游离抗性蛋白分子通过该进程被分泌后而发挥作用;植物表面抗性分子受体通过该进程被内吞后发挥激活下游通路的作用,囊泡运输通路的蛋白组分往往是病原物攻击挟持抗性的靶标[51]。
外排囊泡(exocyst)作为受体蛋白行使信号转导相关生理功能。具体功能机制为:作为“桥梁”直接连接外来囊泡和受体蛋白,进而诱导SNARE蛋白复合物聚集,调节膜融合的过程。外排囊泡结构上是一个八聚物复合体,在酵母中的相关研究已鉴定出8个蛋白组分:分别为Sec3p(EXOC1)、Sec5p(EXOC2)、Sec6p(EXOC3)、Sec8p(EXOC4)、Sec10p(EXOC5)、Sec15p(EXOC6)、Exo70p(EXOC7)和Exo84p(EXOC8)。外排囊泡每个分子组分都有各自参与植物抗性的分子机制。在大豆中,外排蛋白PR-1(Glyma.15g062400)被直接证明参与对SCN抗性,暗示外排囊泡途径参与对SCN抗性[52];Sec4p可以与Sec15p(EXOC6)互作而调控外排囊泡的组装,通过类似机制,大豆中过表达Sec4直接增强对SCN抗性[53]。大豆中外排囊泡所有组分蛋白同源基因都被鉴定出,且合胞体中每个组分都有代表性的基因表达显著上调,暗示外排囊泡参与了大豆对SCN抗性。在感病品种Williams 82中过表达外排囊泡组分基因能给增强抗性,而在抗性品种Peking中沉默相关基因则能够使植物变得更感病[54]。
SNARE可以介导囊泡的融合,是囊泡运输重要一环。而膜融合完成后,SNARE的解离和再利用需要NSF和α-SNAP蛋白,这三者共同形成一个超级复合物20S,参与囊泡运输组分再利用的过程[55]。通过对SCN侵染后根系细胞的转录组分析得知,20S复合体相关组分的表达发生特异上调[52]。前文已有介绍,α-SNAP是Rhg1位点编码的重要抗SCN蛋白。综上说明囊泡融合机制组分可能是SCN侵染重要靶标,囊泡融合进程可能是抗性产生的关键。
突触融合蛋白(syntaxin,SYN)属于SNARE蛋白复合体的一部分,这意味着syntaxin与α-SNAP蛋白存在物理互作。大豆中,过表达α-SNAP可以引起SYN 31表达上调,且SYN 31在大豆与SCN抗性反应中合胞体细胞内表达上调;进一步实验证明,过表达SYN 31可使感病品种转化根系获得对SCN抗性[56]。拟南芥PEN1大豆同源蛋白SYN 121的过表达可以产生SCN抗性,SYN 121与其他SNARE复合体相关基因在被侵染的大豆细胞中转录水平上调[57]。最新研究表明,α-SNAP可与t-SNARE家族的两个syntaxin蛋白互作(SYN 12,Glyma.12g194800和SYN 16,Glyma.16g154200),这两个syntaxin蛋白均被报道位于SCN抗性QTL中。在Peking抗性品种大豆中应用CRISPR技术沉默这两个syntaxin基因,可以发现抗性受损[58]。20S粒体组分中的另一个与SNARE紧密互作的蛋白复合体COG参与调控膜融合进程,也被报道直接影响SCN抗性反应。过表达COG基因可以显著抑制SCN寄生,在Peking抗性品种中沉默COG基因可以显著影响抗性,说明COG参与到SCN抗性反应中,而具体的抗性机制待研究[59]。综上,囊泡运输对于SCN致病性和寄主抗性至关重要,但更直接的作用证据和详细的作用机制仍待需继续探究。
3 植物激素与SCN抗性
植物激素是指一类可以调控植物生长发育的小分子物质,主要包括:生长素、乙烯、细胞分裂素、赤霉素、脱落酸、油菜素内酯、茉莉酸、水杨酸、独脚金内酯等。近年来,越来越多的小肽段也被证明参与植物的特定生命进程,在本文中将其归为植物激素的大类中加以讨论。在SCN与寄主互作后的转录组学分析中,大量激素通路组分被发现受到了SCN侵染调控。植物激素通路的抗线虫功能一直是本领域研究的热点。
3.1 乙烯
乙烯信号通路对植物根系发育至关重要,其参与对SCN抗性功能尚大部分未知。Hu等[60]报道了乙烯信号通路参与根系对SCN吸引的调控:乙烯抑制剂处理的大豆根系对SCN的吸引程度明显增加。分子层面,一部分乙烯前体ACC合成酶家族基因的表达也受到SCN侵染的调控而上调[61]。此外,乙烯信号通路的下游转录因子也被证明在SCN侵染后表达上调:结合GCC-box的乙烯响应转录因子GmEREBP1在被SCN侵染的感病品种中表达下调,而在抗性品种中表达上调[62]。进一步的实验证明乙烯通路可能通过该类转录因子调控乙烯响应基因,如PR3、PDF1.2等在SCN侵染后的表达[63]。
3.2 生长素
生长素信号通路参与对SCN抗性的相关研究较少。生长素负调控基因ADR12在SCN侵染的大豆根系中表达下调[64]。SCN侵染后合胞体细胞转录图谱的测定证实了IAA和ARF等生长素信号通路相关基因在大豆与SCN互作中表达受到显著的调控[17],而具体的作用机制未知。
3.3 水杨酸
植物水杨酸在植物早期响应病原物侵染,激活下游防御信号通路中有重要作用。关于水杨酸参与大豆对SCN抗性证据来自于大豆水杨酸甲基转移酶(GmSAMT1)的相关研究[65]。直接在感病品种中过表达GmSAMT1可以显著抑制线虫发育,增强抗性。过表达GmSAMT1的大豆根系中,SA信号通路相关基因(GmNPR1、GmICS1)的表达也被显著激活[65]。因此,在抗性品种中,可能通过更快速积累SA的合成相关生化酶GmSAMT1来激活SA通路产生SCN抗性。
3.4 小肽类激素
植物顶端发育复合受体CLAVATA在茎尖和根尖分生组织发育中有重要作用。其配体是一段12氨基酸组成的小肽段激素CLV3,属于CLE(Clavat Like Elements)家族。植物寄生线虫广泛分泌一类CLE模拟物效应子,来调控植物根系发育帮助其侵染。大豆中CLV3受体蛋白被证实可以特异与SCN CLE类效应子结合,沉默该受体后导致对SCN抗性增加[66]。最新研究表明,对SCN CLE类效应子结构功能分析得知,其结构中有一个特异的功能域(motif),负责将该类效应子蛋白通过内质网转移到细胞外,线虫CLE效应子可以劫持植物细胞分泌系统进行胞外输出分子信号蛋白[67]。
此外,植物激发子肽(plant elicitor peptides,PEP)被证明参与调控SCN抗性。用PEP1、PEP2和PEP3处理大豆种子后,对SCN增殖产生明显的抑制作用。进一步实验证明,PEP处理可以通过激活ROS诱导大豆产生SCN抗性[68]。关于植物激发子肽诱导抗性的具体分子机制有很大研究潜力。
4 其他作用机制
合胞体形成的一个显著变化就是寄主细胞壁降解。很多线虫的效应子被认为有细胞壁消化酶作用。而寄主的细胞壁合成通路参与SCN抗性少有报道。最近,细胞壁合成相关调控糖支链延长的生化酶GmXTH43被发现在合胞体细胞中特异表达;在感病品种中过表达该酶,可以提高大豆抗性;推测这种酶可能通过影响细胞壁的形成而作用于合胞体[69]。这是又一例基础生化酶参与到SCN抗性反应的例子,但更深入的调控机制尚不明确。
此外,最近有研究报道通过过表达一个质膜定位的广谱抗性基因disease resistance 1(GmDR1,Glyma.10g094800)可以增加植物对SCN、蚜虫以及真菌病害的抗性,具体调控机制未知[70]。
5 总结及展望
大豆对SCN抗性基因的功能研究取得了较大进展,但仍有不足。具体体现在:首先,目前抗性新基因的发现多从转录组学、功能基因组学出发,对于更精细的基因表达调控、表观遗传学调控、线虫特异启动子响应机制等研究仍有欠缺。其次,潜在的抗性基因靶标往往都是参与生命活动必须的基因,对他们的沉默可能造成植物根系发育、生长的缺陷,从而产生间接的抗性表型。因此单一通过基因沉默实验验证相关基因的抗性功能时要注意转基因的根系发育情况对SCN增殖的影响。第三,目前尚不清楚对SCN抗性相关基因与已知植物免疫通路之间的具体互作机制。线虫侵染中损伤信号诱导的初级防御反应与现知的PTI反应通路的区别、联系以及线虫分泌到寄主细胞内的效应子是否也引起经典的ETI反应,这些问题都需要进一步研究。在大豆体系内以已知重要抗性参与蛋白为诱饵进行互作蛋白筛选有助于回答上述问题,也可以帮助更好地厘清SCN与大豆寄主之间互作通路。第四,我国作为大豆原产国,有丰富的大豆种质资源,野生型大豆Glycine soja可作为丰富的基因库来源,极有可能蕴含了丰富的与现有栽培品种不同的抗性基因,以野生型大豆为研究对象进行的抗性基因发掘工作有待进一步开展。第五,现阶段单细胞测序技术发展迅猛,可从单细胞尺度描绘生长发育关键节点的转录图谱;线虫侵染大豆的亲和和不亲和互作中也有几个关键节点,在这些抗性发生质变的关键节点选取合胞体细胞进行单细胞测序构建更精细的转录图谱有助于理解SCN对寄主的致病力和寄主的抗性防御反应进程。最后,以线虫为中心的致病性研究同样重要,尤其是线虫效应子的鉴定和功能验证相关工作,SCN分泌生化信息素如蛔甙(ascarosides)的分类和功能鉴定,以及针对植物病原线虫开发相关基因操作技术都有极大的发展和应用空间。
关于大豆孢囊线虫抗性机制的研究有助于理解植物病原线虫与寄主的互作机制,为传统育种提供参考,也为抗性转基因株系的构建提供有价值的靶标,对我国在相关育种和科研领域获得自主知识产权意义重大。随着生物技术的发展和我国对科技的不断投入,大豆孢囊线虫综合绿色防控在理论、研究和实践应用中定会取得较大突破。新的理论、理念和实践将在维护全球大豆生产安全、确保我国大豆产业安全中起重要作用。