基于磁共振弥散加权成像肝内肿块型胆管癌微血管侵犯术前预测临床价值
2021-08-21高知玲高雨佳孙文杰杨冠华邱海静
任 涛,高知玲,高雨佳,贾 晶,孙文杰,杨冠华,邱海静,邓 林,陈 勇
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院放射科,银川 750004;3.宁夏医科大学总医院放射介入科,银川 750004)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)起源于胆管上皮细胞,是仅次于肝细胞癌的第二大最常见原发肝脏恶性肿瘤,其发病率呈逐年增长趋势[1]。根据宏观形态学分为三种类型:肿块形成型、导管周围浸润型和腔内生长型,其中肝内肿块型胆管癌是最常见的类型,占所有ICC的60%[2]。手术切除是ICC主要的治疗方法,但复发率高[3-4]。研究表明[4],新辅助治疗可以改善预后,提高存活率。微血管侵犯(microvascular invasion,MVI)被认为是肿瘤复发的独立危险因素[5],但目前临床上明确MVI存在的方法是术后病理评估,且由于肿瘤具有异质性,术前穿刺活检得到的MVI结果可能存在一定的误差。因此,对于术前MVI的评估意义重大,影像学检查就显得尤为重要。以往大多数学者主要是基于影像学对肝细胞癌MVI的研究,而对于肝内胆管癌MVI的研究相对较少。本文回顾性分析肝内肿块型胆管癌(intrahepatic mass forming cholangiocarcinoma,IMCC)患者术前临床和MRI资料,分析患者临床资料及影像学特征与MVI的关联,以探索MVI发生的预测指标和诊断效能,旨在评估术前IMCC的MVI预测价值,为临床患者管理及治疗提供重要依据。
1 资料与方法
1.1 一般资料
选取2015年7月至2020年7月在宁夏医科大学总医院接受根治性部分肝切除术且符合以下纳入排除标准的IMCC患者。纳入标准:1)术前1个月内行上腹部动态增强MR检查,且术前2周内行DWI检查者;2)术后病理证实为IMCC者;3)MRI扫描前无任何ICC相关治疗史者;4)病灶最大直径1 cm以上。排除标准:1)病灶数目≥2个;2)MRI资料缺失或不完整,如外院MRI或术前2周内无DWI检查者;3)病灶最大直径<1 cm者;4)图像质量欠佳者;5)病理资料不完整者。
1.2 MRI扫描设备及方法
本组应用GE公司3.0T双梯度超导型全身MR扫描仪,上腹部扫描选择8通道体部线圈。受检者均做好检查前准备,扫描取仰卧位,头先进,均行MRI平扫、DWI、多期动态增强扫描。扫描范围自膈顶至双肾下缘(包含整个肝脏)。扫描序列及参数:1)MR平扫:横轴位T1WI:双回波序列成像,TR 220 ms,TE 2.5~3.0 ms;横轴位T2WI:TR 1000 ms,TE 86 ms;2)DWI:使用单次激发自旋-回波平面成像序列,取b值为0、800 s·mm-2,TR 1500 ms,TE 56 ms,层厚6 mm,层间距0.6~1.5 mm,FOV 380 mm×380 mm;3)增强扫描:使用MR专用高压注射器,将0.1 mmol·kg-1的对比剂钆喷替酸葡甲胺,以2.5 mL·s-1的速度经肘前静脉静推,注射完立即用20 mL生理盐水冲洗,分别于注药后采集动脉期、门静脉期、平衡期和延迟期的图像。
1.3 磁共振影像学特征分析
本研究所有病例由2名从事腹部影像诊断5年以上工作经验的医师共同对病灶图像进行观察分析,作出诊断,如果存在分歧时,则由另外一位高年资医师进行诊断。主要分析以下影像特征,1)肿瘤大小:延迟期病灶最大层面测量的最大直径(cm);2)病灶边缘:规则/不规则;3)坏死:存在/不存在;4)腹腔积液征:存在/不存在;5)肿瘤信号:与相邻的肝实质相比,记录T1WI、T2WI相对信号强度(分别为高、等、低信号);6)瘤周胆管是否扩张;7)肝脏包膜是否回缩;8)动态增强模式:持续性强化(三期均保持强化)、渐进性强化(强化范围从肿瘤的外围向中心扩大或是强化程度随时间延长逐渐增加)、延迟性强化(随时间延长,强化程度逐渐递减,门脉期及延迟期信号相对于周围肝实质的信号高)、快进快出性强化(动脉期呈高信号,门静脉或延迟期出现相对低信号);9)病灶DWI信号:高信号、低信号、等信号及靶征(靶征是指病灶中心呈等或低信号,外周弥散限制呈高信号);10)表观弥散系数(apparent diffusion coefficient,ADC)值:由第三位放射诊断医师测量肿瘤最大横截面的ADC值,手动划定感兴趣区(面积50 mm2),取两个部位测量,取平均值,应尽可能避免大血管、坏死及存在伪影的区域。
1.4 临床及病理学资料
记录所有病例的临床数据,包括年龄、性别、肿瘤标志物[正常值范围:甲胎蛋白(AFP)0~20 ng·mL-1、癌胚抗原(CEA)0~5 U·mL-1、糖类抗原199(CA19-9)0~37 U·mL-1、总胆红素(TBIL)1~20 μmoL·L-1及背景肝脏疾病(是否存在肝硬化或肝炎)。通过病理报道评估是否存在MVI,并记录胆管侵犯,神经周围侵犯以及肿瘤分级(分为高、中、低分化,若同时存在不同的分化程度,则以最低分化作为最终肿瘤分级)。MVI定义为:影像学或术中标本均不能发现肉眼癌栓,在显微镜下可见细小静脉(如中央静脉、门静脉或包膜外小静脉)被肿瘤细胞浸润。
1.5 统计学方法
数据采用SPSS 22.0统计学软件进行分析。计量资料采用均数±标准差(±s)表示,采用两独立样本t检验;计数资料采用例或率(%)表示,采用χ2检验或Fisher精确概率法。通过单因素二元Logistic回归模型中筛选有统计学意义的危险因素输入多因素二元Logistic回归模型中得出独立危险因素。采用ROC工作特征曲线评估其诊断效能。P≤0.05为差异有统计学意义。
2 结果
2.1 IMCC患者一般资料比较
56例IMCC患者中,其中男性25例,女性31例,平均年龄(60.36±10.32)岁。根据病理报道结果分为MVI(+)组(14例)与MVI(-)组(42例);周围神经侵犯:存在9(16.07%)例、不存在47(83.93%)例;胆管侵犯:存在12(21.43%)例、不存在44(78.6%)例;肿瘤分级:高+中等分化22(39.29%)例、低分化34(60.71%)例。两组患者在年龄、性别、肿瘤标志物(AFP、CEA、CA19-9)、总胆红素(TBIL)以及背景肝脏疾病方面差异均无统计学意义(P均>0.05),见表1。

表1 IMCC患者一般资料比较
2.2 IMCC患者MRI特征比较
MVI(+)组和MVI(-)组患者肿瘤MRI特征(包括肿瘤大小、边缘、坏死、腹腔积液、T1WI信号、T2WI信号、动态增强模式、包膜回缩、胆管扩张、DWI信号、ADC值)比较,结果显示,两组间在肿瘤大小、ADC值差异均有统计学意义(P均<0.05),而在肿瘤边缘、腹腔积液、坏死、T1WI信号、T2WI信号、DWI信号、动态增强模式、包膜回缩及胆管扩张两组间差异均无统计学意义(P均>0.05),见表2、图1、图2。
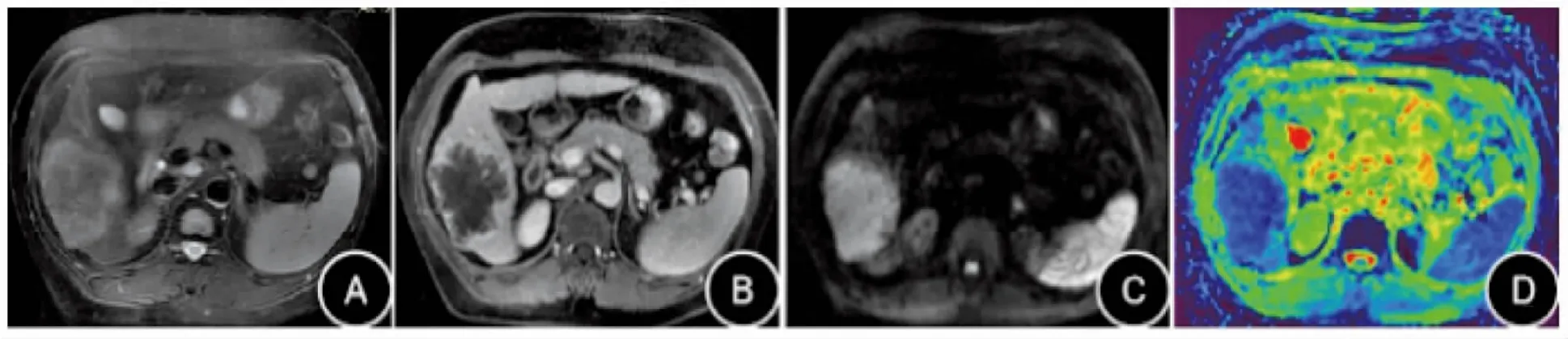
图1 中—低分化IMCC患者MVI(-)MRI特征
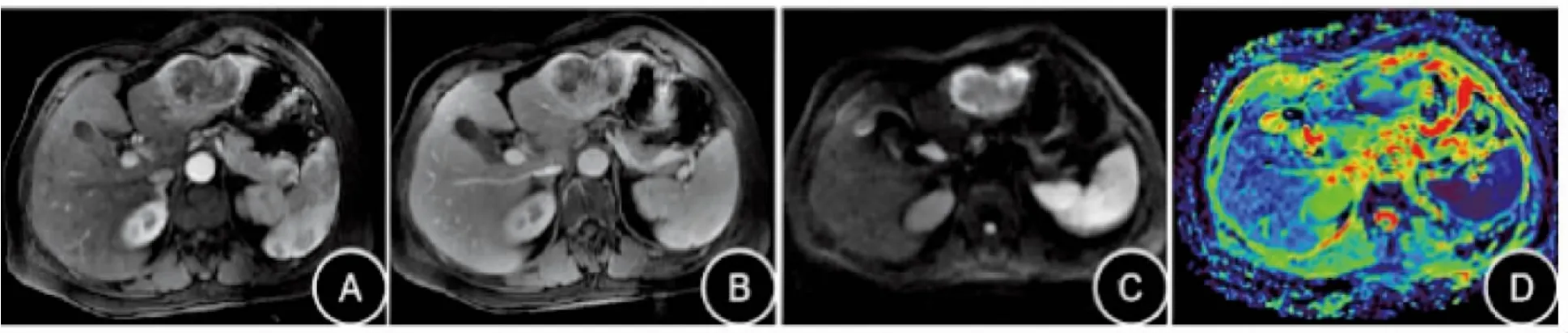
图2 中—低分化IMCC患者MVI(+)MRI特征
2.3 影响IMCC患者MVI危险因素分析
将56例IMCC患者的一般资料、MRI特征参数中可能与MVI相关的变量进行赋值,见表3。再将结果纳入二元Logistic回归分析中,进行单因素二元Logistic回归分析,然后对肿瘤大小、ADC值进行多因素二元Logistic回归分析,其中肿瘤大小OR(95%CI)为1.250(0.918~1.703)(P>0.05),ADC值OR(95%CI)为81.145(2.504~2629.673)(P<0.05),结果表明ADC值(P=0.013)是发生MVI的独立预测指标,见表4。

表3 变量赋值表
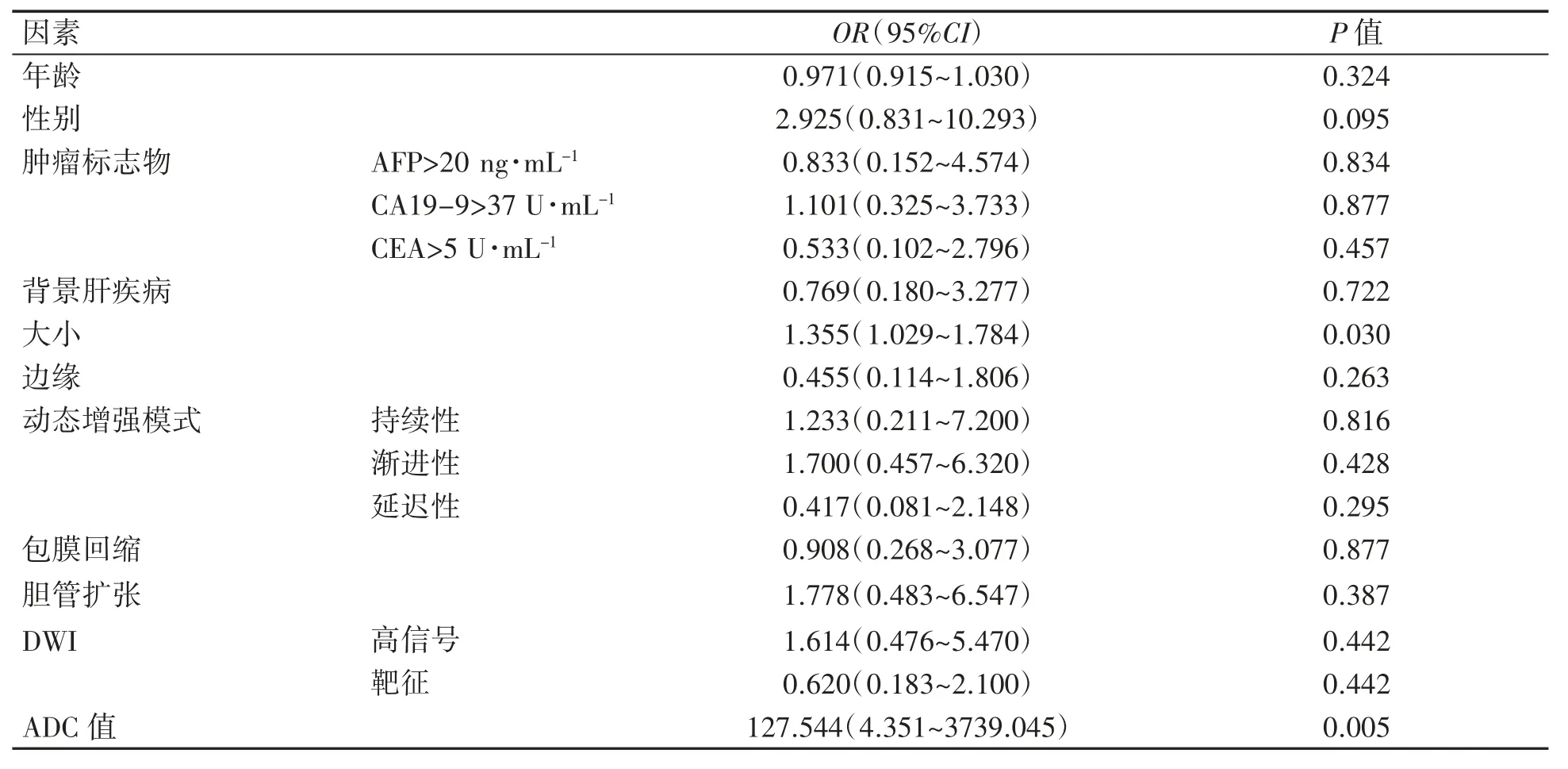
表4 影响IMCC的MVI单因素分析
2.4 ADC值预测MVI的效能
本组采用ROC曲线分析ADC值预测MVI的效能评估。ADC值:曲线下面积(AUC)为0.827(P<0.001),约登指数为0.595,最佳临界值1.46×10-3mm2·s-1,敏感度为85.7%,特异度为73.8%,见图3。
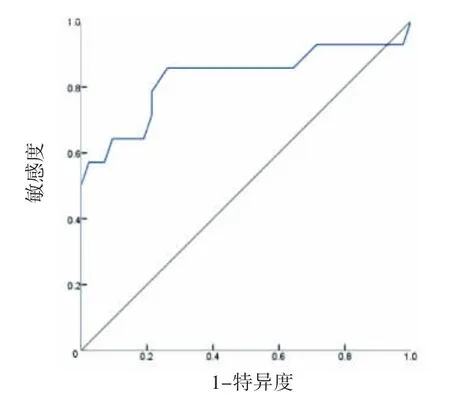
图3 ROC曲线分析ADC值预测MVI的效能
3 讨论
根据原发性肝癌规范化病理诊断指南(2015版)[6],将MVI定义为“在显微镜下内皮细胞覆盖的血管腔内见到成团的癌细胞”。本研究56例IMCC患者中,14例(25%)患者的病理结果为MVI阳性,表明IMCC患者MVI的发生率比较高。以往研究[4,7]表明,没有MVI或淋巴结转移等危险因素存在的ICC患者在RO肝切除后无需辅助治疗,但对于切缘阳性的高危患者,术后辅助治疗是必要的,可以改善患者的预后。对于ICC术后切缘阳性或者淋巴结转移的辅助治疗应考虑用吉西他滨或5-氟尿嘧啶或基于5-氟尿嘧啶为基础的放射治疗,且必须行区域淋巴结清扫,另外对存在卫星灶、多发病灶或者低分化等高危特征的ICC患者也应考虑辅助治疗[8]。
DWI作为一种无创的功能成像方法,可通过检测活体组织内水分子扩散运动受限程度来区分不同的组织结构,从而对疾病进行诊断与鉴别诊断,ADC值是反映水分子扩散的定量指标。ICC患者通常T1WI呈低信号,T2WI呈高信号,有时也表现中心低信号,最常见的动态增强模式为渐进性强化(29/45),即动脉期边缘强化,随后呈渐进性和向心性造影剂充填,与文献[9]报道基本相符。ICC患者DWI征象主要为弥漫高信号和靶征,本研究56例IMCC患者中,DWI呈弥漫高信号27例、靶征29例,其中靶征表现为病灶中心呈等或低信号,周边呈弥散受限的高信号,主要是由于肿瘤组织学成分不同导致的,瘤灶周边和中心分别由肿瘤细胞和纤维组织组成。Park等[9]发现DWI靶征是区分小肿块型ICC与小肝细胞癌(直径3 cm以下)的最可靠的影像学特征。
Fattach等[10]发现,28例肝内和肝门部肿块型胆管癌的平均ADC值为(1.04±0.22)×10-3mm2·s-1,采用1.5 T MR成像,b值分别为0、400和800 s·mm-2。Cui等[11]采用1.5 T MR,b值取800 s·mm-2时平均ADC值为(1.19±0.28)×10-3mm2·s-1,发现29例胆管癌(肝门部胆管癌13例,主胆管胆管癌16例)。本研究采用3.0 T MR,b值取0和800 s·mm-2,平均ADC值约(1.38±0.31)×10-3mm2·s-1,ADC值较高,分析原因可能由于磁共振技术的差异、研究对象选择偏倚,或者瘤灶中央丰富纤维间质因缺血而引起不同程度坏死所致。
本研究发现较高的ADC值是发生MVI的独立预测指标。Lee等[12]通过DWI作为术前评估91例IMCC患者预后指标价值的研究发现,弥散受限程度较低的组较弥散程度较高的组TNM分期更高,淋巴浸润、淋巴结转移更多,总生存率更低,预后更差,因前者含有丰富的纤维间质成分。Kajiyama等[13]通过ICC患者纤维间质与预后因素关系的研究中发现,与非硬化型ICC患者相比,硬化型ICC患者预后较差。Sirica等[14]也发现促结缔组织增生基质在促进胆管癌患者生物学行为和治疗抵抗方面起着关键作用。本研究结果显示较高的ADC值与MVI发生有关,可能与ICC组织病理中含有大量的纤维间质有关,不同程度的纤维间质对弥散受限影响不同,含有大量纤维间质的ICC弥散受限程度较低,相对应的ADC值越高,更易发生MVI影响预后,这与之前研究基本一致[12-14]。
本研究发现瘤体大小也是MVI发生的危险因素。虽然瘤体增大已被证明与MVI有关[15],但该研究尚未明确ICC肿瘤直径和血管侵犯之间是否存在相关性。Pawlik等[15]指出,与>5 cm肝癌相比,瘤直径较小的肝癌(<5 cm)患者MVI发生率较低。Spolverato等[16]也发现3~5 cm肿瘤MVI发生率是<3 cm的6倍,表明ICC患者MVI发生率会随着瘤体增大而增大。本研究通过分析肿瘤直径大小与MVI的关系,发现较大的肿瘤直径与MVI发生有关,与Spolverato等[16]报道基本相符。
综上所述,在IMCC患者中,瘤体直径较大、ADC值较高与IMCC合并MVI存在一定的关联性,其中ADC值较高可作为MVI的独立预测指标,术前IMCC的MRI影像学特征对于预测MVI具有重要价值。
