积雪草酸对糖尿病大鼠血—视网膜屏障的保护作用
2021-08-20方梦园李秋明杨鑫万伟伟龙洋刘宏卓万文萃
方梦园 李秋明 杨鑫 万伟伟 龙洋 刘宏卓 万文萃
郑州大学第一附属医院眼科 450052
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症,是目前导致中老年视力损害和不可逆盲的主要原因[1-2]。早期干预DR可延缓疾病的发展,并有效提高患者的视力预后和改善患者的生活质量[3]。因此研究控制或者改善早期DR病理变化的药物对于DR患者具有重要意义[4]。积雪草酸(asiatic acid,AA)是从热带药用植物积雪草中提取的一种五环三萜类化合物,作为抗氧化剂和抗炎药物被广泛应用[5]。研究表明,AA具有改善糖尿病动物模型的组织应激及并发症的作用,控制糖尿病的进展[6-9]。有研究报道,在青光眼大鼠模型中,AA通过改善视网膜屏障功能障碍发挥视神经保护作用[10]。此外,AA还可通过改善小鼠血—脑屏障通透性来发挥神经保护特性[11]。血—视网膜屏障(blood-retinal barrier,BRB)在维持内眼稳态中发挥重要作用,是包括DR在内的许多致盲视网膜疾病的病理生理学基础[12-13]。目前,尚未有文献报道AA是否对DR中BRB的破坏有改善作用。同时,研究表明Notch1信号通路在DR患者BRB变化中发挥着重要作用,持续高糖环境会刺激Jagged典型Notch配体1(Jagged canonical Notch ligand 1,JAG1)、Delta样典型Notch配体4(Delta like canonical Notch ligand 4,DLL4)的产生,通过激活Notch1信号通路增加病理性血管通透性,参与BRB的破坏过程[14]。本研究拟探讨AA与Notch1信号通路的关系,探讨AA能否通过抑制Notch1通路发挥对糖尿病大鼠BRB的保护作用。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级8周龄SD健康雄性大鼠96只,体质量170~200 g(辽宁长生生物科技股份有限公司),将大鼠置于12 h光照黑暗交替、温度(25±1)℃、湿度45%~55%的环境下,自由进食饮水,适应性喂养1周。本研究获得郑州大学第一附属医院科研和临床试验伦理委员会批准(批文号:2020-KY-228)。实验动物的使用遵守美国国立卫生研究院颁布的实验动物使用和护理原则以及3R原则。
1.1.2主要试剂与仪器 积雪草酸(F126912)、伊文思蓝[E104208,阿拉丁试剂(上海)有限公司];链脲佐菌素(streptozotocin,STZ)(S17049,上海源叶生物科技有限公司);BCA蛋白浓度测定试剂盒(PC0020)、羊抗兔IgG-HRP(SE134)、羊抗小鼠IgG-HRP(SE131)、SYBR Green(SY1020)(北京索莱宝科技有限公司);兔抗大鼠Occludin一抗(A2601,武汉爱博泰克生物科技有限公司);兔抗大鼠Notch1一抗(#4380,美国CST实业有限公司);兔抗大鼠JAG1一抗(DF8269,江苏亲科生物研究中心有限公司);兔抗大鼠DLL4一抗(WL02214,沈阳万类生物科技有限公司);Cy3标记山羊抗兔IgG(A0516,上海碧云天生物技术有限公司);小鼠抗大鼠GAPDH一抗(60004-1-Ig,武汉三鹰生物技术有限公司);Super M-MLV反转录酶(PR6502,北京百泰克生物技术有限公司)。酶标仪(ELX-800,美国伯腾仪器有限公司);光学显微镜(BX53,日本Olumpus公司);紫外分光光度计(NANO 2000,美国赛默飞世尔科技公司);荧光定量PCR仪(Exicycler 96,韩国Bioneer公司);凝胶成像仪(WD-9413B,北京六一生物科技有限公司)。
1.2 方法
1.2.1大鼠糖尿病模型建立及分组处理 采用随机数字表法将96只大鼠随机均分为正常对照组、糖尿病模型组、低剂量AA组和高剂量AA组,每组24只。除正常对照组外,其余各组按照60 mg/kg剂量给予大鼠腹腔内注射STZ(以pH=4.5的0.1 mmol/L枸橼酸盐缓冲液稀释),正常对照组注射等量枸橼酸盐缓冲液。于注射后4 d测量大鼠尾静脉血糖浓度,血糖>16.7 mmol/L即认定为糖尿病大鼠模型建立成功。注射STZ后1个月采用AA来干预大鼠,干预方法参照文献[11]的方法并加以改进,具体方法为以质量分数0.5%羧甲基纤维素钠溶解AA,低剂量组和高剂量组分别使用37.5 mg/kg或75.0 mg/kg的AA给予大鼠灌胃,每日1次。正常对照组及糖尿病模型组给予等量0.5%羧甲基纤维素钠。分别记录各组给药第0周、1周、2周、3周和4周体质量及血糖浓度。给药1个月时,取大鼠视网膜组织进行后续检测。
1.2.2苏木精—伊红染色观察大鼠视网膜组织病理变化 给药1个月时,于各组中任意选取6只大鼠,腹腔内注射200 mg/kg戊巴比妥钠全身麻醉,以质量分数1%多聚甲醛进行心内灌注固定;摘取右侧眼球,使用4%多聚甲醛溶液固定24 h,然后使用自来水冲洗4 h并进行梯度乙醇脱水,使用二甲苯透明30 min并透蜡2 h后包埋;沿矢状面垂直视神经进行石蜡切片,切片厚度为5 μm,使用二甲苯及梯度乙醇脱蜡至水,再行苏木素染色5 min,盐酸乙醇分化3 s,自来水返蓝20 min,伊红染色3 min,梯度乙醇脱水,二甲苯透明,最后使用中性树胶封片,400倍光学显微镜下观察并拍照。
1.2.3伊文思蓝定量法检测BRB破坏程度 给药1个月时,于各组中任意选取6只大鼠,将新鲜配制的30 mg/ml伊文思蓝生理盐水过滤后在10 s内以45 mg/kg剂量经大鼠尾静脉注射,待染料循环2 h后,使用戊巴比妥钠腹腔内注射麻醉大鼠后打开胸腔,并使用柠檬酸和1%多聚甲醛通过左心室行心脏灌注,分离出大鼠视网膜组织,并将其置于4 ℃条件下完全风干,加入适量质量分数10%甲酰胺,在70 ℃条件下孵育18 h,然后于4 ℃、10 000×g条件下离心1 h,吸取上清液100 μl,于620 nm波长下检测吸光度(A)值。同一样本重复检测3次,取平均值。以A值为横坐标,标准品浓度为纵坐标,建立伊文思蓝的标准曲线,根据标准曲线计算出各样本含量。
1.2.4免疫荧光染色法检测视网膜组织中Notch1、Occludin、JAG1和DLL4蛋白的分布 参照1.2.2部分获取各组眼球5 μm厚石蜡切片进行二甲苯及梯度乙醇脱蜡至水,在高温低火条件下进行抗原修复10 min,并使用血清封闭15 min,滴加Notch1、Occludin、JAG1或DLL4一抗(1∶ 100)4 ℃条件下孵育过夜,滴加相应荧光标记二抗(1∶ 200)室温条件下避光孵育60 min,最后使用DAPI染核,抗荧光猝灭剂封片,400倍荧光显微镜下观察并拍照。
1.2.5Western blot法检测Occludin、Notch1、JAG1、DLL4蛋白的表达 各组选取6只大鼠,腹腔内注射200 mg/kg戊巴比妥钠过量麻醉处死,摘出双侧眼球,分离视网膜组织,使用组织总蛋白提取试剂盒提取视网膜组织总蛋白,采用BCA蛋白定量试剂盒检测总蛋白含量,然后将提取的蛋白按照每孔40 μg上样量行SDS-聚丙烯酰胺凝胶电泳,转印至PVDF膜;取PVDF膜行质量分数5%脱脂奶粉封闭,并于DLL4抗体(1∶ 400)、Occludin抗体(1∶ 500)、JAG1抗体(1∶ 500)和Notch1抗体(1∶ 1 000)中4 ℃条件下孵育过夜,PBST漂洗3次,每次10 min,于相应二抗(1∶ 5 000)中37 ℃条件下孵育45 min,使用ECL底物发光显影后在凝胶成像仪中扫描胶片。以GAPDH为内参照,分析目标条带的灰度值以计算目的蛋白的相对表达量,以正常对照组蛋白表达进行归一化处理。
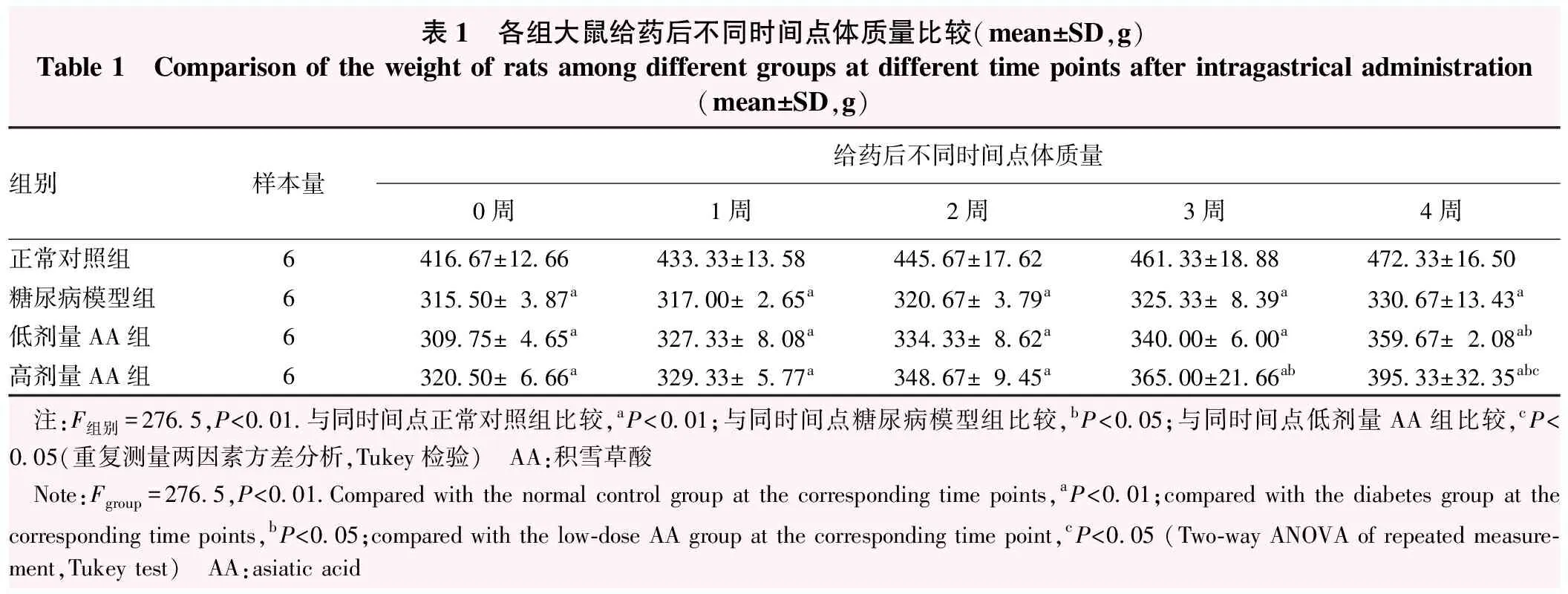
表1 各组大鼠给药后不同时间点体质量比较(mean±SD,g)Table 1 Comparison of the weight of rats among different groups at different time points after intragastrical administration(mean±SD,g)组别样本量给药后不同时间点体质量0周1周2周3周4周正常对照组6416.67±12.66433.33±13.58445.67±17.62461.33±18.88472.33±16.50糖尿病模型组6315.50±3.87a317.00±2.65a320.67±3.79a325.33±8.39a330.67±13.43a低剂量AA组6309.75±4.65a327.33±8.08a334.33±8.62a340.00±6.00a359.67±2.08ab高剂量AA组6320.50±6.66a329.33±5.77a348.67±9.45a365.00±21.66ab395.33±32.35abc 注:F组别=276.5,P<0.01.与同时间点正常对照组比较,aP<0.01;与同时间点糖尿病模型组比较,bP<0.05;与同时间点低剂量AA组比较,cP<0.05(重复测量两因素方差分析,Tukey检验) AA:积雪草酸 Note:Fgroup=276.5,P<0.01.Compared with the normal control group at the corresponding time points,aP<0.01;compared with the diabetes group at the corresponding time points,bP<0.05;compared with the low-dose AA group at the corresponding time point, cP<0.05 (Two-way ANOVA of repeated measure-ment,Tukey test) AA:asiatic acid
1.2.6Real-time PCR法检测Occludin、Notch1、JAG1、DLL4 mRNA的表达 各组选取6只大鼠,参照1.2.5方法分离双侧眼球视网膜组织,使用总RNA提取试剂盒提取视网膜组织总RNA,采用NANO 2000仪检测RNA浓度及纯度。将提取的总RNA使用Super M-MLV逆转录酶进行逆转录反应。以cDNA为模板,按照cDNA 1.0 μl、正反向引物(10 μmol/L)各0.5 μl、SYBR GREEN Mastermix 10.0 μl、双蒸水补足至20.0 μl反应体系上机进行检测。Occludin正向引物为5’-CAGAGCCTATGGAACGG-3’,反向引物为5’-CAAGGAAGCGATGAAGC-3’;Notch1正向引物为5’-TGGCTCCATCGTCTACCTG-3’,反向引物为5’-GGCTCCACCGTCTCACTCT-3’;JAG1正向引物为5’-GATTTCCTGGTTCCTCTGC-3’,反向引物为5’-TGG CTCCGTGTTTCTCG-3’;DLL4正向引物为5’-GCGGAT AACCAACGACG-3’,反向引物为5’-CAAGCCCACG GGAAACT-3’;GAPDH正向引物为5’-CGGCAAGTT CAACGGCACAG-3’,反向引物为5’-CGCCAGTAGAC TCCACGACAT-3’。反应条件:94 ℃预变性5 min;94 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,进行40个循环。以GAPDH为内参照,采用2-△△Ct方法计算各目的基因mRNA的相对表达量。
1.3 统计学方法
采用GraphPad Prism 7软件进行统计分析。本研究中计量资料经S-W检验符合正态分布,以mean±SD表示。各组间大鼠视网膜中伊文思蓝含量和Occludin、Notch1、JAG1、DLL4蛋白及mRNA相对表达量的总体差异比较采用单因素方差分析,各组大鼠不同时间点体质量、血糖浓度的总体比较采用重复测量两因素方差分析,多重比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠给药后不同时间点体质量变化比较
给药后不同时间点糖尿病模型组、低剂量AA组和高剂量AA组大鼠体质量低于正常对照组,差异均有统计学意义(均P<0.01);给药后第0、1、2、3周低剂量AA组与高剂量AA组体质量比较,差异均无统计学意义(均P>0.05);给药后第4周,与低剂量AA组相比,高剂量AA组体质量显著升高,差异有统计学意义(P<0.05)(表1)。
2.2 各组大鼠给药后不同时间点血糖浓度变化比较
给药后不同时间点糖尿病模型组、低剂量AA组和高剂量AA组大鼠血糖浓度明显高于正常对照组,差异均有统计学意义(均P<0.01);除第3周外,其余各给药时间点内低剂量AA组与高剂量AA组血糖浓度比较,差异均无统计学意义(均P>0.05);给药后第3周,高剂量AA组血糖浓度明显低于糖尿病模型组和低剂量AA组,差异有统计学意义(P<0.05);给药后第4周,低剂量AA组和高剂量AA组血糖浓度均低于糖尿病模型组,差异均有统计学意义(均P<0.01)(表2)。

表2 各组大鼠给药后不同时间点血糖浓度比较(mean±SD,mmol/L)Table 2 Comparison of blood glucose value among different groups at different time points after intragastrical administration(mean±SD,mmol/L)组别样本量给药后不同时间点血糖浓度0周1周2周3周4周正常对照组64.50±0.404.60±0.304.70±0.464.37±0.384.73±0.15糖尿病模型组623.70±2.16a23.93±1.40a25.07±1.15a25.43±1.40a25.33±0.68a低剂量AA组623.98±2.54ad23.80±1.65ad23.33±1.66ad22.17±1.63ad17.43±1.96ab高剂量AA组621.70±1.31ad24.47±1.65ade22.37±2.80ade18.03±3.16abc15.73±3.15ab 注:F组别=407.18,P<0.01;F时间=7.36,P<0.01.与同时间点正常对照组比较,aP<0.01;与同时间点糖尿病模型组比较,bP<0.01;与同时间点低剂量AA组比较,cP<0.05;与组内第4周比较,dP<0.05;与组内第3周比较,eP<0.05(重复测量两因素方差分析,Tukey检验) AA:积雪草酸 Note:F组别=407.18,P<0.01;F时间=7.36,P<0.01.Compared with the control group at corresponding time point,aP<0.01;compared with the diabetes group at corresponding time point, bP<0.01;compared with the low-dose AA group at corresponding time point, cP<0.05;compared with week 4 within group, dP<0.05;compared with week 3 within group, eP<0.05 (Two-way ANOVA of repeated measurement,Tukey test) AA:asiatic acid
2.3 各组大鼠视网膜组织病理变化情况
糖尿病模型组大鼠视网膜较正常对照组明显增厚,外核层(outer nuclear layer,ONL)明显增厚,细胞排列紊乱,结构层次不清晰。低剂量AA组和高剂量AA组视网膜表面光滑,各层结构较为清晰完整,细胞排列整齐,视网膜总厚度、ONL、外丛状层(outer plexiform layer,OPL)、内核层(inner nuclear layer,INL)、内丛状层(inner plexiform layer,IPL)及神经节细胞层(ganglion cell layer,GCL)均较糖尿病模型组变薄(图1)。
2.4 各组大鼠视网膜中伊文思蓝含量比较
正常对照组、糖尿病模型组、低剂量AA组和高剂量AA组视网膜中伊文思蓝含量分别为(3.07±1.30)、(13.73±3.88)、(9.57±2.69)和(6.55±1.61)ng/mg,总体比较差异有统计学意义(F=18.50,P<0.01),其中糖尿病模型组和低剂量AA组视网膜中伊文思蓝质量浓度明显高于正常对照组,高剂量AA组视网膜中伊文思蓝质量浓度明显低于糖尿病模型组,差异均有统计学意义(均P<0.01)(图2)。

图1 各组大鼠视网膜组织病理变化情况(HE ×400,标尺=50 μm) A:正常对照组大鼠视网膜细胞排列整齐,结构层次清晰 B:糖尿病模型组大鼠视网膜增厚明显,ONL增厚,细胞排列紊乱,结构层次不清晰 C:低剂量AA组视网膜总厚度及各层厚度均较糖尿病模型组变薄 D:高剂量AA组视网膜表面光滑,各层结构清晰完整,细胞排列整齐,视网膜总厚度及各层厚度均较糖尿病模型组变薄 黑色箭头示ONL;红色箭头示OPL;绿色箭头示INL;黄色箭头示IPL;蓝色箭头示GCL 图2 各组大鼠视网膜中伊文思蓝含量比较 F=18.50,P<0.01.与正常对照组比较,aP<0.01;与糖尿病模型组比较,bP<0.01(单因素方差分析,Tukey检验,n=6) 1:正常对照组;2:糖尿病模型组;3:低剂量AA组;4:高剂量AA组Figure 1 Pathological changes of rat retina tissue in each group (HE ×400,bar=50 μm) A:The cells in the normal control group were arranged neatly and the layered structure was clear B:In the diabetes group,the retina was thickened obviously with thicker ONL as well as disorderly arranged cells and the layers of retina were unclear C:The total retinal thickness and single layer thickness in the low-dose AA group were thinner than those in the diabetes group D:Compared with the diabetes group,the retina surface was smoother in the high-dose AA group,and the structure of each layer was much more clear,and cells were in better arrangement and the thickness of full retina and single layer thickness were thinner Black arrow indicated ONL;red arrow indicated OPL;green arrow indicated INL;yellow arrow indicated IPL;blue arrow indicated GCL Figure 2 Comparison of Evan's blue content in rat retina among four groups F=18.50,P<0.01 Compared with the normal control group,aP<0.01;compared with the diabetes group,bP<0.01 (One-way ANOVA,Tukey test,n=6) 1:normal control group;2:diabetes group;3:low-dose AA group;4:high-dose AA group
2.5 各组大鼠视网膜中Occludin、Notch1、JAG1及DLL4表达分布情况比较
在正常对照组视网膜中,Occludin主要分布于GCL、IPL和OPL,Notch1及JAG1均主要分布于GCL和OPL,并少量表达于IPL,DLL4主要分布于OPL和ONL。与正常对照组相比,糖尿病模型组视网膜中Occludin分布明显减少,Notch1、JAG1及DLL4的分布明显增加。与糖尿病模型组相比,低剂量AA组和高剂量AA组视网膜中Occludin分布增加,Notch1、JAG1和DLL4分布减少。高剂量AA组视网膜中各蛋白表达分布情况与正常对照组无明显差异(图3)。
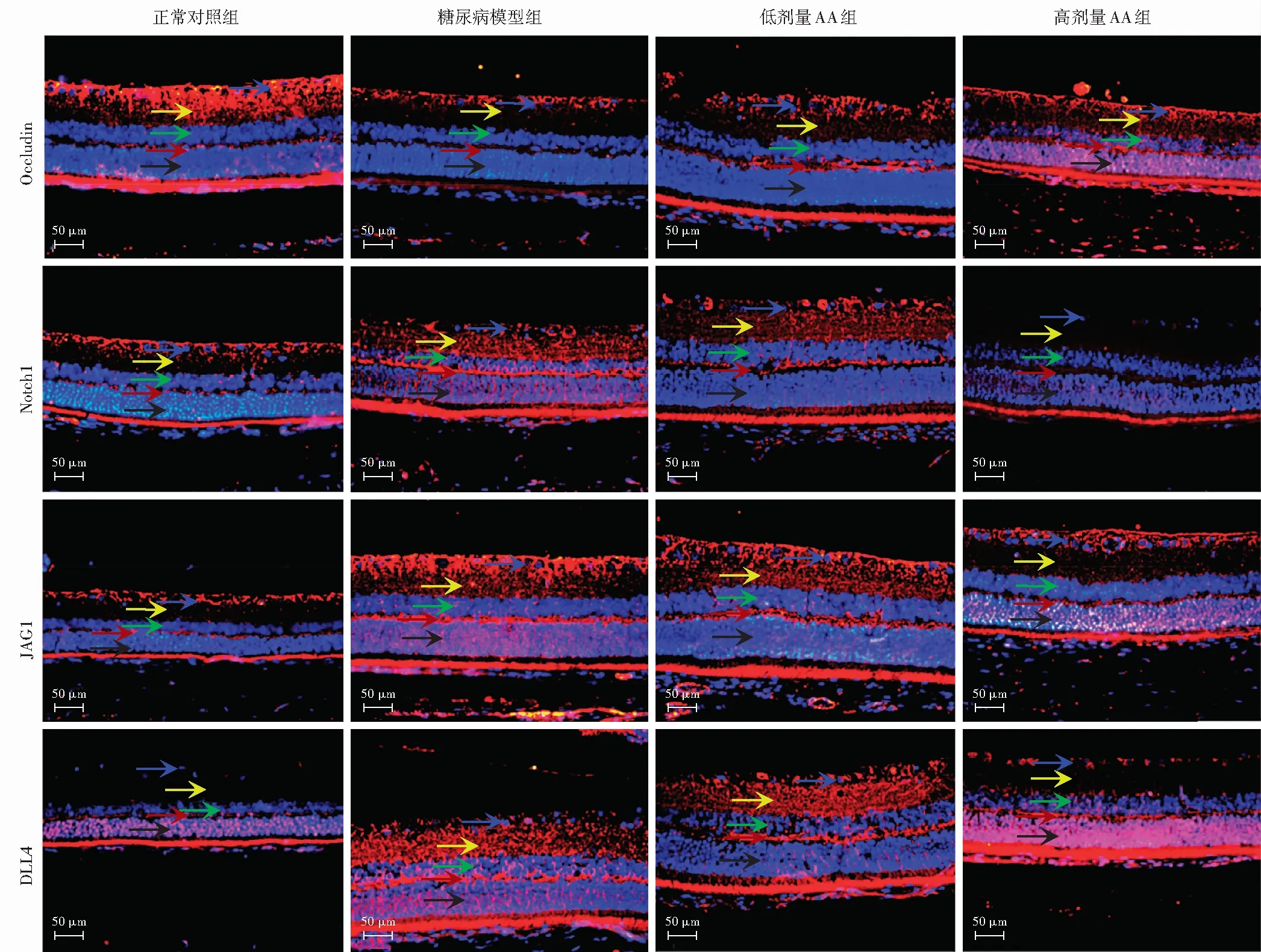
图3 各组大鼠视网膜Occludin、Notch1、JAG1和DLL4免疫荧光染色情况(×400,标尺=50 μm) Occludin、Notch1、JAG1、DLL4的表达均呈红色荧光(Cy3),细胞核呈蓝色荧光(DAPI)。正常对照组Occludin主要分布于GCL、IPL和OPL,Notch1和JAG1主要分布于GCL和OPL,少量表达于IPL,DLL4主要分布于OPL和ONL。糖尿病模型组Occludin表达明显减少,仅表达于GCL,Notch1、JAG1和DLL4表达明显增多,均主要表达于GCL、IPL、OPL和ONL。低剂量AA组及高剂量AA组Occludin表达较糖尿病模型组增加,主要分布于GCL、IPL、OPL和ONL;Notch1、JAG1和DLL4表达较糖尿病模型组减少,主要分布于GCL、IPL和OPL 黑色箭头示ONL;红色箭头示OPL;绿色箭头示INL;黄色箭头示IPL;蓝色箭头示GCL AA:积雪草酸;JAG1:Jagged典型Notch配体1;DLL4:Delta样典型Notch配体4Figure 3 Distribution of Occludin,Notch1,JAG1 and DLL4 in rat retina in each group by immunofluorescence staining (×400,bar=50 μm) The expression of Occludin,Notch1,JAG1 and DLL4 in rat retina showed red fluorescence (Cy3),and the nucleus presented blue fluorescence (DAPI).In the normal control group,Occludin was mainly distributed in GCL,IPL and OPL;Notch1 and JAG1 were mainly in GCL and OPL,with a little expression in IPL;DLL4 was mainly distributed in OPL and ONL.In the diabetes group,decreased Occludin was only expressed in GCL;increased Notch1,JAG1 and DLL4 were mainly expressed in GCL,IPL,OPL and ONL.In the low-dose AA group and high-dose AA group,Occludin was increased in comparison with the diabetes group and was mainly distributed in GCL,IPL,OPL and ONL;Notch1,JAG1 and DLL4 were mainly distributed in GCL,IPL and OPL,which were decreased in comparison with the diabetes group Black arrow indicated ONL;red arrow indicated OPL;green arrow indicated INL;yellow arrow indicated IPL;blue arrow indicated GCL AA:asiatic acid;JAG1:Jagged canonical Notch ligand 1;DLL4:Delta like canonical Notch ligand 4
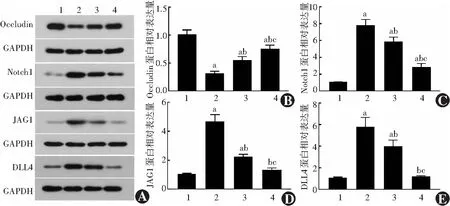
图4 各组大鼠视网膜中Occludin、Notch1、JAG1、DLL4蛋白相对表达量比较 A:各组蛋白电泳图 B:各组视网膜中Occludin蛋白相对表达量比较 F=39.13,P<0.01 C:各组视网膜中Notch1蛋白相对表达量比较 F=92.57,P<0.01 D:各组视网膜中JAG1蛋白相对表达量比较 F=94.24,P<0.01 E:各组视网膜中DLL4蛋白相对表达量比较 F=49.47,P<0.01 与正常对照组比较,aP<0.05;与糖尿病模型组比较,bP<0.01;与低剂量AA组比较,cP<0.05(单因素方差分析,Tukey检验,n=6) 1:正常对照组;2:糖尿病模型组;3:低剂量AA组;4:高剂量AA组 GAPDH:磷酸甘油醛脱氢酶;JAG1:Jagged典型Notch配体1;DLL4:Delta样典型Notch配体4Figure 4 Comparison of Occludin,Notch1,JAG1 and DLL4 protein expression in rat retina among four groups A:Electrophoretogram of different proteins in each group B:The relative expression of Occludin protein in retina of each group F=39.13,P<0.01 C:The relative expression of Notch1 protein in retina of each group F=92.57,P<0.01 D:The relative expression of JAG1 protein in retina of each group F=94.24,P<0.01 E:The relative expression of DLL4 protein in retina of each group F=49.47,P<0.01 Compared with the normal control group,aP<0.05;Compared with the diabetes group,bP<0.01;Compared with the low-dose AA group,cP<0.05 (One-way ANOVA,Tukey test,n=6) 1:normal control group;2:diabetes group;3:low-dose AA group;4:high-dose AA group GAPDH:glyceraldehyde phosphate dehydrogenase;JAG1:Jagged canonical Notch ligand 1;DLL4:Delta like canonical Notch ligand 4

表3 各组大鼠视网膜中Occludin、Notch1、JAG1和DLL4 mRNA相对表达量比较(mean±SD)Table 3 Comparison of the relative expressions of Occludin,Notch1,JAG1 andDLL4 mRNA in rat retina among four groups (mean±SD)组别样本量OccludinNotch1JAG1DLL4正常对照组61.00±0.121.00±0.051.00±0.081.00±0.15糖尿病模型组60.29±0.06a3.53±0.71a3.01±0.55a2.79±0.54a低剂量AA组60.56±0.09ab2.81±0.54a2.21±0.41a2.02±0.36a高剂量AA组60.84±0.14bc1.52±0.29bc1.39±0.22b1.22±0.21bF值37.3618.3118.7617.21P值<0.01<0.01<0.01<0.01 注:与正常对照组比较,aP<0.01;与糖尿病模型组比较,bP<0.05;与低剂量AA组比较,cP<0.05(单因素方差分析,Tukey检验) JAG1:Jagged典型Notch配体1;DLL4:Delta样典型Notch配体4;AA:积雪草酸 Note:Compared with the normal control group, aP<0.01;compared with the diabetes group,bP<0.05;compared with low-dose AA group, cP<0.05 (One-way ANOVA,Tukey test) JAG1:Jagged ca-nonical Notch ligand 1;DLL4:Delta like canonical Notch ligand 4;AA:asiatic acid
2.6 各组大鼠视网膜中Occludin、Notch1、JAG1和DLL4蛋白表达情况比较
正常对照组、糖尿病模型组、低剂量AA组和高剂量AA组Occludin蛋白相对表达量分别为1.00±0.12、0.30±0.05、0.54±0.07和0.74±0.07,Notch1蛋白相对表达量分别为1.00±0.05、7.75±0.74、5.80±0.62和2.75±0.51,JAG1蛋白相对表达量分别为1.00±0.08、4.64±0.51、2.20±0.22和1.28±0.18,DLL4蛋白相对表达量分别为1.00±0.15、5.77±0.93、3.96±0.62和1.13±0.13,总体比较差异均有统计学意义(F=39.13、92.57、94.24、49.47,均P<0.01)。糖尿病模型组Occludin蛋白相对表达量明显低于其余3个组,Notch1、JAG1和DLL4蛋白相对表达量明显高于其余3个组,差异均有统计学意义(均P<0.05);高剂量AA组Occludin蛋白相对表达量明显高于低剂量AA组,Notch1、JAG1和DLL4蛋白相对表达量明显低于低剂量AA组,差异均有统计学意义(均P<0.05)(图4)。
2.7 各组大鼠视网膜中Occludin、Notch1、JAG1和DLL4 mRNA相对表达量比较
各组大鼠视网膜中Occludin、Notch1、JAG1、DLL4 mRNA相对表达量总体比较差异均有统计学意义(F=37.36、18.31、18.76、17.21,均P<0.01)。与正常对照组比较,糖尿病模型组及低剂量AA组Occludin mRNA相对表达量明显下调,Notch1、JAG1和DLL4 mRNA相对表达量明显上调,差异均有统计学意义(均P<0.01);高剂量AA组Occludin mRNA相对表达量明显高于糖尿病模型组和低剂量AA组,Notch1 mRNA相对表达量明显低于糖尿病模型组和低剂量AA组,JAG1和DLL4 mRNA相对表达量明显低于糖尿病模型组,差异均有统计学意义(均P<0.05)(表3)。
3 讨论
DR是糖尿病常见且严重的微血管并发症之一,研究发现,对DR进行早期及时合理治疗可有效控制其发展,延缓其致盲程度[15]。DR的经典病理学特征包括微动脉瘤的形成、火焰状和斑点状出血、硬性渗出、静脉扩张和视网膜内微血管异常[16]。这些病变均与BRB完整性的丧失有关,而且BRB的破坏可进一步导致视网膜发生缺血性变化,从而加重疾病进展[17]。因此探索DR中保护BRB屏障的药物对于控制DR早期病变具有重要意义。
AA具有很强的抗氧化作用,兼具抗炎、改善血管的特性,常用于疾病的抗氧化及抗炎治疗[18]。研究发现,AA对于改善糖尿病的各种并发症有一定的作用[8-9,19]。近些年,AA的神经保护作用逐渐受到国内外学者的广泛关注,其发挥神经保护作用的途径包括改善视网膜屏障功能障碍及血—脑屏障通透性等[10-11]。Liu等[20]研究发现,AA可能通过保护STZ诱导的糖尿病模型大鼠胰岛β细胞改善其高血糖状态。本研究采用AA干预糖尿病模型大鼠,结果发现37.5 mg/kg及75.0 mg/kg剂量的AA均能够在一定程度上增加糖尿病大鼠的体质量并降低血糖值,AA治疗后4周均能够使糖尿病大鼠的血糖值显著降低。本研究中还发现AA能够抑制糖尿病大鼠的视网膜增生,稳定视网膜结构,改善视网膜病变程度。因此推测AA可能对糖尿病大鼠的视网膜病变有一定的改善作用。
在发生DR时,BRB受到破坏并使视网膜的渗透性增强,导致外周血液中伊文思蓝染料在视网膜中大量积累。本实验结果显示,在糖尿病模型大鼠视网膜中伊文思蓝浓度明显增加,而各AA干预组视网膜中伊文思蓝浓度有所降低,表明AA可能具有保护DR中BRB的作用。
Notch通路是调节发育性血管生成的关键通路,并且能够调控成人血管稳态[21]。其中,Notch1信号通路的畸变已被证明可引起血管紊乱,影响BRB的完整性[22]。据报道,Notch1信号除了激活典型的转录途径外,还可以通过非典型机制引起内皮连接的破坏,且抑制Notch1的配体JAG1和DLL4的表达能够降低糖尿病视网膜中病理性血管的通透性,维持BRB的正常屏障功能[14]。目前对Notch的研究主要在血管发育的背景下进行,其在病理学中的研究相对较少,在驱动疾病发病机制中的潜在作用仍不明确[12,23]。本研究结果显示,糖尿病模型大鼠视网膜Notch1、JAG1和DLL4表达增多,主要分布于GCL、IPL和OPL,推测高血糖刺激了JAG1和DLL4的产生,从而可能通过Notch1影响BRB的完整性;采用AA干预糖尿病大鼠发现,AA能够抑制Notch1及其配体JAG1和DLL4的表达,推测AA可能通过抑制Notch1信号通路发挥改善糖尿病大鼠BRB通透性的作用。
内皮细胞之间的紧密连接是维持BRB功能的重要结构基础,Occludin是紧密连接蛋白中的主要成分之一,能够改变细胞的通透性,在维持BRB正常功能中发挥至关重要的作用[24-26]。有研究显示,Notch1可通过调控Occludin介导癌症进展,过表达Notch1后可显著抑制Occludin的表达[27]。本研究结果显示,在糖尿病模型大鼠视网膜组织中Occludin蛋白及mRNA表达量较正常对照组明显减少,仅有较少量的Occludin蛋白分布于GCL;而经AA干预后,Occludin蛋白及mRNA表达量有所增加,且与Notch1的表达趋势相反,推测AA可能通过Notch1影响Occludin的表达及分布,从而维持BRB的完整性,但AA与Notch1/Occludin通路确切的靶向关系尚待进一步研究证明。
综上所述,AA可能通过抑制JAG1、DLL4和Notch1表达及增强Occludin的表达改善糖尿病大鼠视网膜的血管通透性,保护BRB的完整性。本研究结果为糖尿病诱导BRB屏障破坏相关疾病的治疗提供了实验基础和新的方向,后续可在动物模型内进一步证实其安全性和有效性。
利益冲突所有作者均声明不存在利益冲突
