Cx3cr1抗体玻璃体腔注射对视网膜缺血—再灌注损伤模型小鼠视网膜微循环的保护作用及其机制
2021-08-20李娟娟陈晨李妍张利伟
李娟娟 陈晨 李妍 张利伟
云南大学附属医院眼科 云南省眼科疾病防治研究重点实验室,昆明 650021
视网膜缺血—再灌注损伤(retinal ischemia-reperfusion,RIR)是多种视网膜血管性疾病的共同病理过程。以往RIR的研究多集中于神经细胞保护,而微循环作为神经血管单元的重要组成部分,其损伤也是该类疾病的重要病理改变。神经组织缺血研究发现,活化的小胶质细胞可直接吞噬血管内皮细胞造成血管结构崩解,也可诱导过度的炎症反应造成血管屏障功能破坏,从而导致微循环损伤[1-2]。本课题组前期研究已证实,活化的小胶质细胞在RIR中对微循环产生破坏作用,抑制小胶质细胞活化可减少视网膜中炎性因子的释放[3]。因此,抑制小胶质细胞的活化可能是保护缺血组织微循环的重要途径。C-X3-C基序趋化因子受体1(C-X3-C motif chemokine receptor 1,cx3cr1)是主要表达于小胶质细胞的一种趋化因子受体,cx3cr1抗体与cx3cr1结合后,可以抑制小胶质细胞的活性[4]。本研究拟探讨cx3cr1抗体对RIR过程中视网膜微循环的保护作用,以期为临床上相关疾病的治疗提供新的思路和方法。
1 材料与方法
1.1 材料
1.1.1实验动物及分组 选择SPF级4~5周龄健康C57BL/6小鼠150只,雌雄不限,体质量25~28 g。实验动物由昆明医科大学动物科提供,实验动物的喂养及使用均遵循《实验动物管理条例》,本实验方案经昆明医科大学伦理委员会审核批准(批文号:20180106)。实验前经检查实验鼠双眼前节和眼底均正常。采用随机数字表法将实验动物随机分为空白对照组、模型组和cx3cr1抗体注射组,每组50只。空白对照组小鼠仅玻璃体腔注射无菌注射用水,模型组小鼠采用前房灌注升高眼压法建立RIR模型,cx3cr1抗体注射组小鼠采用cx3cr1抗体玻璃体腔注射后4 h建立RIR模型,均以右眼为实验眼。
1.1.2主要试剂及仪器 多聚甲醛(美国Sigma公司);氯胺酮、盐酸赛拉嗪(广州深安科技有限公司);抗兔Iba-1抗体(013-26471,日本Wako公司);抗鼠cx3cr1抗体(377227,美国Santa Cruze公司);羊抗兔荧光二抗(AP510)、羊抗鼠荧光二抗(AP300P)、兔抗羊荧光二抗(AP106R)、驴血清(美国Millipore公司);Trizol试剂(美国Life Technologies公司);SYBR®Green Master Mix试剂(美国Roche公司);Prime Script RT reagent试剂盒(日本Takara公司);FITC-dextran、GS-Isolectin B4(美国Invitrogen公司)。Quant Studio 6 Flex Q-PCR仪(美国Life Technologies公司);显微手术器械(美国WPI公司);激光扫描共焦显微镜(LSM710,德国Zeiss公司)。
1.2 方法
1.2.1实验鼠cx3cr1抗体玻璃体腔注射 小鼠腹腔内注射氯胺酮和盐酸赛拉嗪行全身麻醉,复方托吡卡胺滴眼液扩瞳后采用奥布卡因滴眼液点眼行表面麻醉,稍用力压迫上下眼睑使眼球突出眼眶,用微量注射器由角膜缘后1 mm进针至玻璃体腔,空白对照组小鼠注射无菌注射用水2 μl;cx3cr1抗体注射组注射用无菌注射用水稀释的0.2 μg/μl cx3cr1抗体2 μl。如有角膜水肿等高眼压表现行前房穿刺,并用妥布霉素滴眼液点眼,注射后放回饲养笼中。
1.2.2RIR动物模型建立 参照文献[5-7]中的方法建立RIR模型。将全身麻醉的小鼠采取俯卧位,四肢固定于自制的固定器上,使用复方托吡卡胺滴眼液点眼扩瞳,将30G针头与生理盐水瓶连接,将针头刺入前房并固定,缓慢升高生理盐水瓶使液面提高150 cm,眼压升高至110 mmHg(1 mmHg=0.133 kPa),持续60 min后逐渐降低输液瓶高度至动物眼球水平,拔出前房灌注针头,恢复视网膜血供。眼压升高后可见小鼠角膜逐渐水肿、角膜缘血管闭锁、虹膜颜色变浅;眼底观察可见视网膜血供减少,视网膜血管阻断。针头拔出后可见小鼠角膜水肿逐渐消失并恢复透明,角膜缘血管重新充血,虹膜颜色逐渐恢复,视网膜逐渐恢复红润,实现血液再灌注。实验动物苏醒后,回笼饲养,模型诱导后72 h进行相应指标检测。
1.2.3免疫荧光染色法观察视网膜冰冻切片小胶质细胞活化情况 每组任意选取10只小鼠过量麻醉法处死,剖取眼球,并进行OCT包埋,沿平行于晶状体前后表面经线方向行冰冻切片,切片厚4~5 μm。将切好备用的眼球冰冻切片从-80 ℃冰箱中取出,室温条件下自然风干30 min;将切片浸入新鲜配制的质量分数4%多聚甲醛中固定20 min;磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗,室温下浸入体积分数0.1% TritonX-100溶液中破膜15 min;PBS漂洗3次,每次10 min,滴加体积分数5%驴血清室温封闭1 h;滴加Iba-1抗体(1∶ 200)于湿盒中4 ℃孵育24 h;PBS漂洗3次,每次10 min,滴加相应荧光二抗(1∶ 1 000)常温下避光孵育1 h;PBS漂洗3次,每次10 min;用含DAPI的抗荧光淬灭油性封片剂封片;滴入少许指甲油增加盖玻片和载玻片之间的稳固性,待指甲油干后于荧光显微镜下计数每个视野(400倍视野下)视网膜各层中Iba-1阳性细胞数。
1.2.4免疫荧光染色法观察视网膜铺片活化小胶质细胞 每组任意选取10只小鼠,过量麻醉法处死后摘出眼球,4%多聚甲醛固定2 h。手术显微镜下去除角膜、虹膜、晶状体,仔细清理玻璃体以防止玻璃体残留影响染色效果,剥离巩膜及脉络膜,将视网膜朝视神经方向剪成4瓣,可铺平为原则。甲醇固定视网膜后15 min,使用含体积分数20%胎牛血清和体积分数0.5% Triton的100倍PBS进行封闭打孔1 h;抗Iba-1抗体(1∶ 200)4 ℃冰箱中孵育24 h,滴加相应荧光二抗(1∶ 1 000)常温下避光孵育1 h;用含DAPI的抗荧光淬灭油性封片剂封片。荧光显微镜200倍视野下计数任意3个区域每个视野范围内的呈阿米巴样活化小胶质细胞数。
1.2.5免疫荧光染色法观察视网膜铺片血管和活化小胶质细胞共染色 每组任意选取10只小鼠过量麻醉处死后取出眼球,参照1.2.4部分步骤进行视网膜铺片,使用含体积分数20%胎牛血清和0.5% Triton的100倍PBS进行封闭打孔1 h;加入血管染色剂GS-Isolectin B4(1∶ 200)4 ℃孵育过夜,加入抗Iba-1抗体(1∶ 200)4 ℃冰箱中孵育24 h,分别滴加相应荧光二抗(1∶ 1 000)常温下避光孵育1 h后封片。荧光显微镜下观察血管结构损伤情况,采用multi-gauge软件计算浅层及深层毛细血管密度,观察小胶质细胞活化与血管的关系。
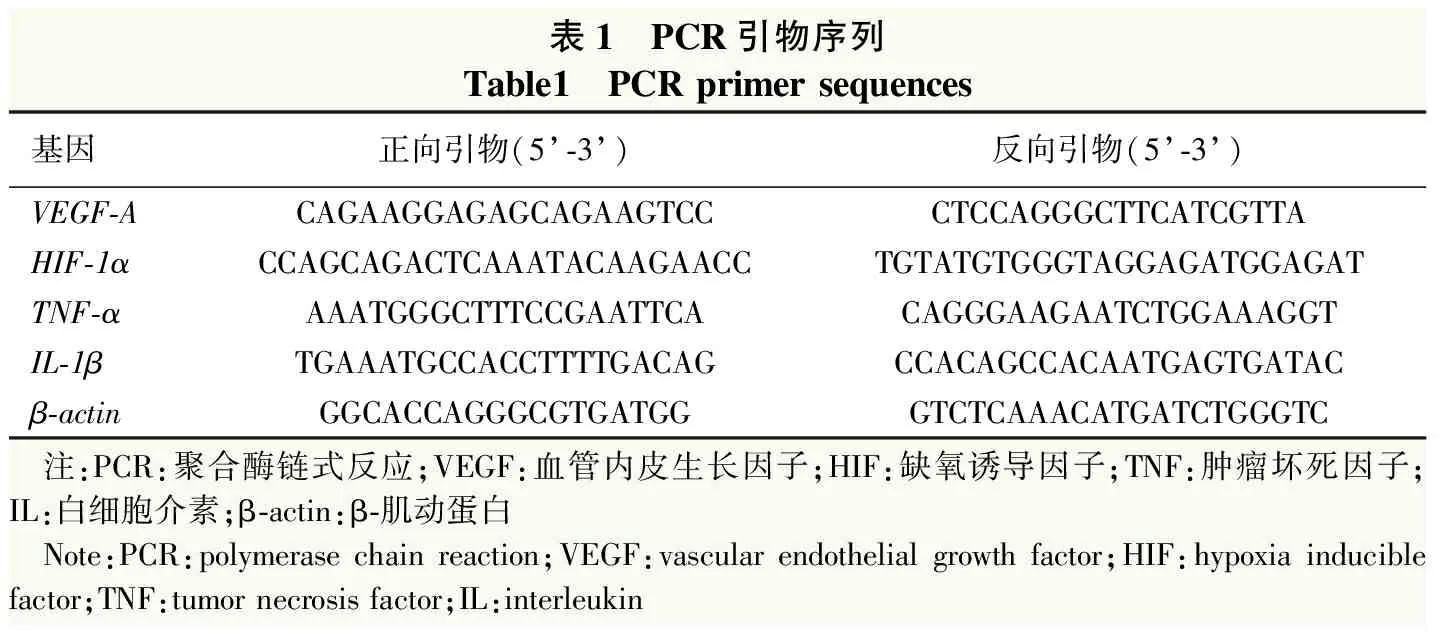
表1 PCR引物序列Table1 PCR primer sequences基因正向引物(5’-3’)反向引物(5’-3’)VEGF-ACAGAAGGAGAGCAGAAGTCCCTCCAGGGCTTCATCGTTAHIF-1αCCAGCAGACTCAAATACAAGAACCTGTATGTGGGTAGGAGATGGAGATTNF-αAAATGGGCTTTCCGAATTCACAGGGAAGAATCTGGAAAGGTIL-1βTGAAATGCCACCTTTTGACAGCCACAGCCACAATGAGTGATACβ-actinGGCACCAGGGCGTGATGGGTCTCAAACATGATCTGGGTC 注:PCR:聚合酶链式反应;VEGF:血管内皮生长因子;HIF:缺氧诱导因子;TNF:肿瘤坏死因子;IL:白细胞介素;β-actin:β-肌动蛋白 Note:PCR:polymerase chain reaction;VEGF:vascular endothelial growth factor;HIF:hypoxia inducible factor;TNF:tumor necrosis factor;IL:interleukin
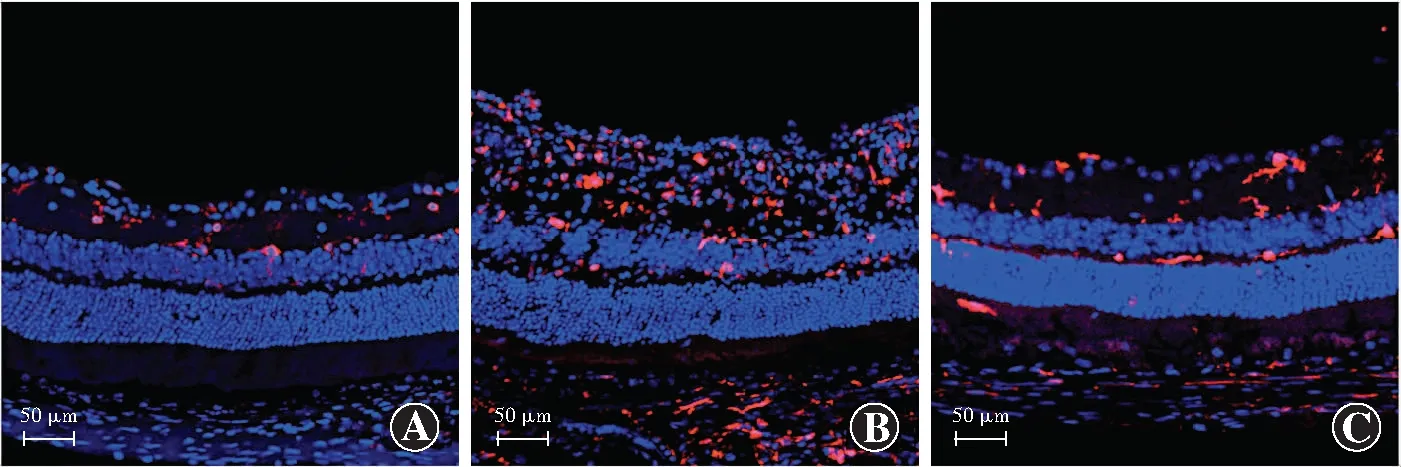
图1 各组小鼠视网膜冰冻切片Iba-1阳性小胶质细胞表达分布(×200,标尺=50 μm) Iba-1阳性小胶质细胞呈红色荧光(TRITC),细胞核呈蓝色荧光(DAPI) A:空白对照组视网膜IPL内可见极少量Iba-1阳性小胶质细胞 B:模型组IPL、INL及OPL可见较多Iba-1阳性小胶质细胞 C:cx3cr1抗体注射组视网膜各层Iba-1阳性小胶质细胞数较模型组明显减少Figure 1 The distribution of Iba-1 positive microglia in different layers of mice retina (×200,bar=50 μm) Iba-1 positive microglia showed red fluorescence (TRITC),and nucleus presented blue fluorescence (DAPI) A:A small amount of Iba-1 positive microglia were seen in the IPL of retina in the blank control group B:In the model group,more Iba-1 positive microglia were seen in the IPL,INL and OPL C:The number of Iba-1 positive cells was reduced in the cx3cr1 injection group in comparison with the model group
1.2.6左心室FITC-dextran造影检查视网膜血管渗漏情况 FITC-dextran溶于无菌生理盐水中,质量浓度为50 mg/ml,离心半径15 cm,3 000 r/min离心10 min后取上清备用。将每组10只小鼠常规麻醉固定,剪开胸骨,打开胸腔,将1 ml FITC-dextran溶液注入左心室,观察小鼠的口、鼻、耳廓变黄为灌注成功。摘取小鼠眼球并标记方向,于4%多聚甲醛中固定1 h;然后在手术显微镜下沿角膜缘剪开球壁,去除晶状体、玻璃体,用虹膜恢复器将视网膜神经感觉层与色素上皮层分离,取视网膜感觉层在PBS中漂洗,清除残存玻璃体,最后将视网膜平铺在玻片上,穿刺刀以视盘为中心放射状切开,甘油封片,荧光显微镜下观察并照像。采用ImageJ软件测量渗漏面积,计算相对渗漏率。相对渗漏率=cx3cr1抗体注射组渗漏面积/空白对照组渗漏面积×100%。
1.2.7实时荧光定量PCR法检测视网膜中缺氧相关因子和炎性因子mRNA表达 每组任意选取10只小鼠过量麻醉处死后摘除眼球,分离出视网膜神经上皮层,在PBS液中漂洗,加入Trizol 1 ml,剧烈振荡,溶解离心提取总RNA;逆转录生成模板cDNA。设计并合成缺氧相关因子血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)及炎性因子表达肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β),各目的基因引物序列见表1。反应体系为:PCR Buffer 5 μl,MgCl25 μl,dNTP 1 μl,目的基因正反向引物各2 μl,Taq探针1 μl。实时荧光定量PCR反应条件:95 ℃预变性3 min;95 ℃变性50 s,55 ℃退火及延伸30 s,共45次循环。采用2-ΔΔCt法计算各目的基因相对表达量。
1.3 统计学方法
采用SPSS 18.0统计学软件(10034432,美国IBM SPSS公司)进行统计分析。本研究中计量资料经Shapiro-Wilk检验证实呈正态分布,以mean±SD表示。采用随机分组单因素干预多水平研究设计,3个组各检测指标总体差异比较均采用单因素方差分析,组间多重比较采用LSD-t检验。采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠视网膜中Iba-1阳性细胞表达分布比较
空白对照组小鼠视网膜中Iba-1阳性小胶质细胞稀少,分布于视网膜神经节细胞层和内丛状层,视网膜外层未见Iba-1阳性小胶质细胞。模型组小鼠视网膜神经节细胞层和内丛状层Iba-1阳性小胶质细胞数明显增多,并向外丛状层、外核层移动。Cx3cr1抗体注射组小鼠视网膜各层Iba-1阳性小胶质细胞数较模型组明显减少(图1)。3个组小鼠视网膜神经节细胞层、内丛状层、内核层、外丛状层活化小胶质细胞数总体比较差异均有统计学意义(F=92.98、125.22、33.51、28.18,均P<0.01),模型组小鼠视网膜各层活化小胶质细胞数明显多于空白对照组和cx3cr1抗体注射组,差异均有统计学意义(均P<0.05)(表2)。
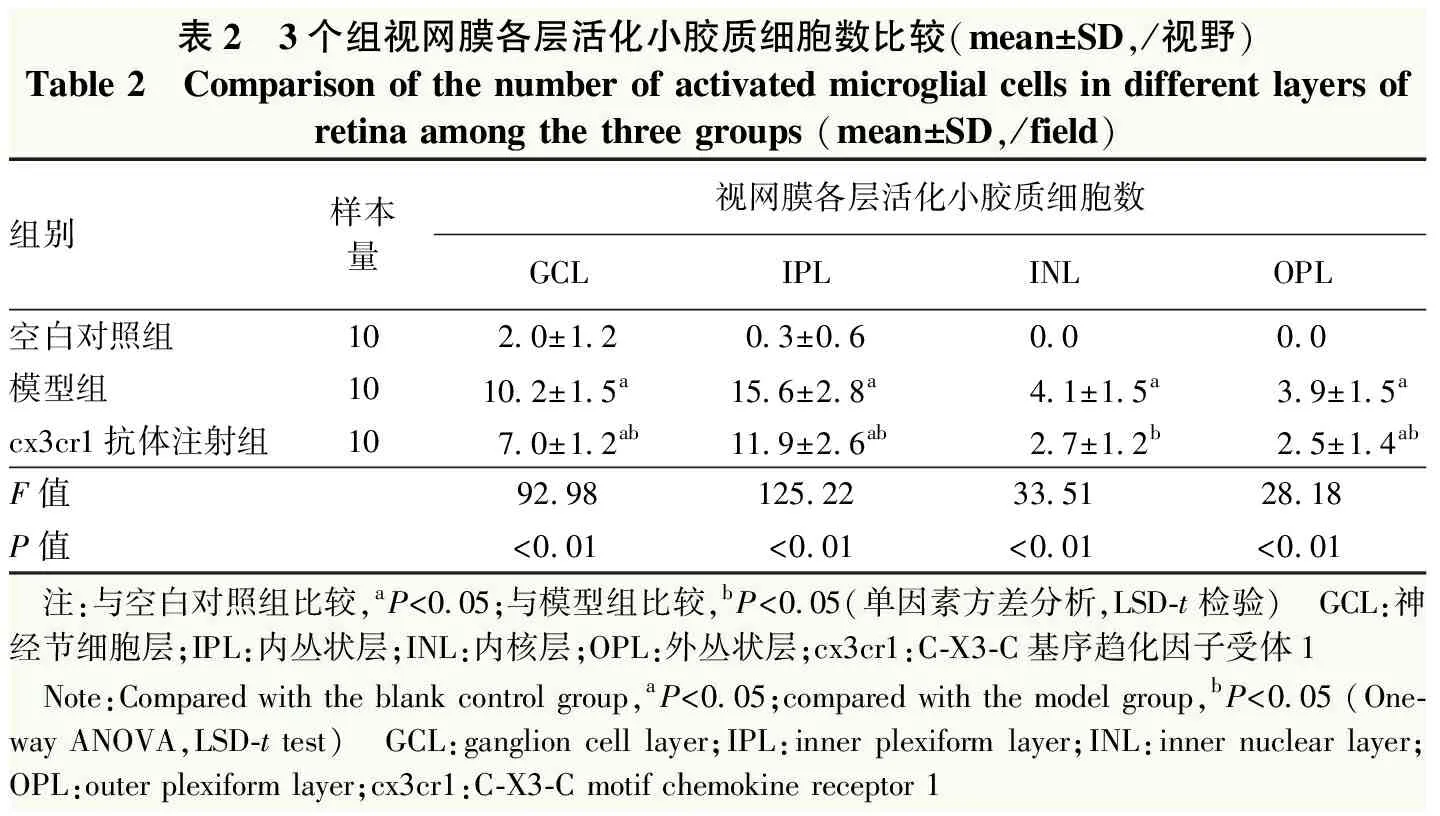
表2 3个组视网膜各层活化小胶质细胞数比较(mean±SD,/视野)Table 2 Comparison of the number of activated microglial cells in different layers ofretina among the three groups (mean±SD,/field)组别样本量视网膜各层活化小胶质细胞数GCLIPLINLOPL空白对照组102.0±1.20.3±0.60.00.0模型组1010.2±1.5a15.6±2.8a4.1±1.5a3.9±1.5acx3cr1抗体注射组107.0±1.2ab11.9±2.6ab2.7±1.2b2.5±1.4abF值92.98125.2233.5128.18P值<0.01<0.01<0.01<0.01 注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验) GCL:神经节细胞层;IPL:内丛状层;INL:内核层;OPL:外丛状层;cx3cr1:C-X3-C基序趋化因子受体1 Note:Compared with the blank control group,aP<0.05;compared with the model group,bP<0.05 (One-way ANOVA,LSD-t test) GCL:ganglion cell layer;IPL:inner plexiform layer;INL:inner nuclear layer;OPL:outer plexiform layer;cx3cr1:C-X3-C motif chemokine receptor 1
2.2 各组小鼠视网膜活化小胶质细胞数量及形态变化
Iba-1染色结果显示,空白对照组小鼠视网膜中Iba-1阳性细胞数量稀少,且细胞体小,呈长分枝状。模型组小鼠视网膜中Iba-1阳性细胞数量最多,且细胞体明显膨大,分枝缩短呈阿米巴样,甚至球形。Cx3cr1抗体注射组较模型组Iba-1阳性细胞和变形细胞数量减少。空白对照组、模型组和cx3cr1抗体注射组视网膜中Iba-1阳性细胞数分别为(13.8±3.6)、(62.2±4.8)和(34.8±2.6)/视野,组间总体比较差异有统计学意义(F=413.32,P<0.01);其中cx3cr1抗体注射组Iba-1阳性细胞数明显少于模型组,差异有统计学意义(P<0.05)(图2)。
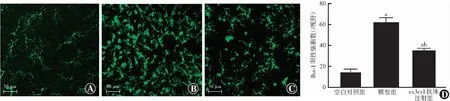
图2 各组小鼠视网膜铺片Iba-1阳性细胞数量和形态变化 A:空白对照组视网膜中Iba-1阳性细胞数量稀少,且细胞体小,呈长分枝状(FITC ×200,标尺=50 μm) B:模型组视网膜中可见大量Iba-1阳性细胞,且细胞体明显膨大,呈阿米巴样或球形(FITC ×200,标尺=50 μm) C:cx3cr1抗体注射组较模型组细胞数量减少(FITC ×200,标尺=50 μm) D:各组小鼠视网膜铺片Iba-1阳性细胞量化比较 F=413.32,P<0.01与空白对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验,n=10)Figure 2 Quantitative and morphological changes of Iba-1 positive cells in mice retinal preparation of each group A:The Iba-1 positive cells in the blank control group were scarce,and the cell bodies were small,showing long branches (FITC ×200,bar=50 μm) B:A large number of Iba-1 positive cells were seen in the model group,and the cell bodies were obviously enlarged,presenting amoeba-like or spherical (FITC ×200,bar=50 μm) C:The number of Iba-1 positive cells in the cx3cr1 injection group was reduced in comparison with the model group (FITC ×200,bar=50 μm) D:Quantitative comparison of Iba-1 positive cells among the three groups F=413.32,P<0.01.Compared with the blank control group,aP<0.05;compared with the model group,bP<0.05 (One-way ANOVA,LSD-t test,n=10)
2.3 各组小鼠视网膜小胶质细胞与视网膜血管共同染色情况比较
空白对照组可见视网膜血管管径及走行正常,血管网间及各级血管附近仅见少量活化小胶质细胞。模型组视网膜血管明显扩张,血管周围及血管表面可见大量阿米巴样或球形小胶质细胞。Cx3cr1抗体注射组血管周围及血管壁表面变形小胶质细胞数量明显减少。各组视网膜深层血管网表现与浅层血管网接近(图3)。3个组视网膜浅层血管密度总体比较差异无统计学意义(F=0.01,P=0.99),深层血管密度总体比较差异有统计学意义(F=9.53,P<0.01);其中模型组视网膜深层血管密度明显低于空白对照组和cx3cr1抗体注射组,差异均有统计学意义(均P<0.05)(表3)。3个组间浅层、深层视网膜血管周围活化小胶质细胞数总体比较差异均有统计学意义(F=134.02、84.88,均P<0.01);其中模型组视网膜血管周围活化小胶质细胞数明显高于cx3cr1抗体注射组和空白对照组,差异均有统计学意义(均P<0.05)(表4)。
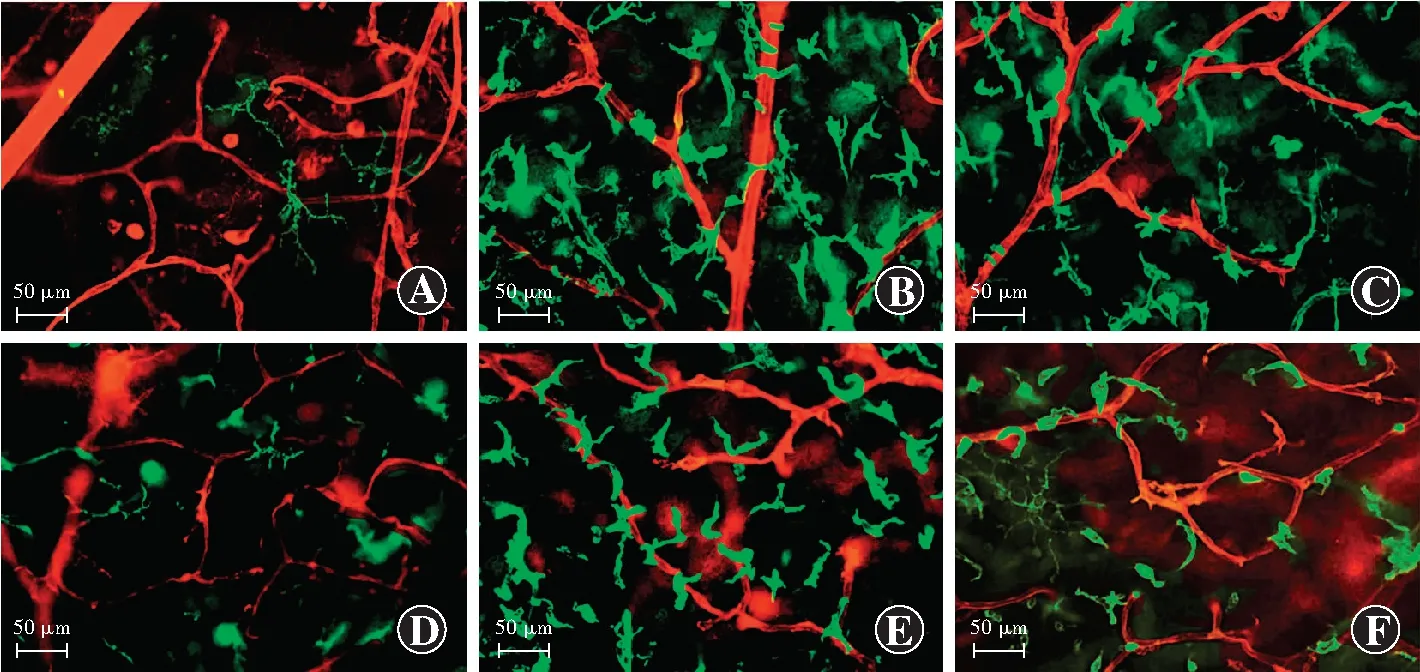
图3 各组小鼠视网膜铺片血管与活化小胶质细胞共染色(×200,标尺=50 μm) 小鼠视网膜血管呈红色荧光(GS-IB4),活化小胶质细胞呈绿色荧光(FITC) A:空白对照组浅层毛细血管网管径和血管走行正常,血管周围仅有少量活化小胶质细胞 B:模型组浅层视网膜血管扩张,血管附近可见大量阿米巴样或球形活化小胶质细胞 C:cx3cr1抗体注射组浅层视网膜血管附近活化的小胶质细胞数量较模型组明显减少 D:空白对照组深层视网膜血管网走行正常,仅见少量活化小胶质细胞 E:模型组深层视网膜血管网周围可见大量活化小胶质细胞 F:cx3cr1抗体注射组深层视网膜血管网周围活化小胶质细胞数明显少于模型组Figure 3 Co-staining of blood vessels and active microglia in retinal whole mounts of each group (×200,bar=50 μm) Mice retinal blood vessels showed red fluorescence (GS-IB4),and activated microglia presented green fluorescence (FITC) A:The diameter of the superficial capillary network and the running of the blood vessel were normal in the blank control group,and there were only a small amount of activated microglia around blood vessel B:The superficial blood vessels in the model group were significantly dilated,and a large number of amoebic or spherical activated microglia cells were present near the blood vessels C:The number of activated microglia near the superficial blood vessels in the cx3cr1 injection group was significantly reduced in comparison with the model group D:The deep retinal vascular network ran normally,and only a few activated microglia were seen in the blank control group E:A large number of activated microglia could be seen around the deep retinal network in the model groupF:The number of activated microglial cells around the deep retinal vascular network was significantly less in the cx3cr1 injection group than that in the model group
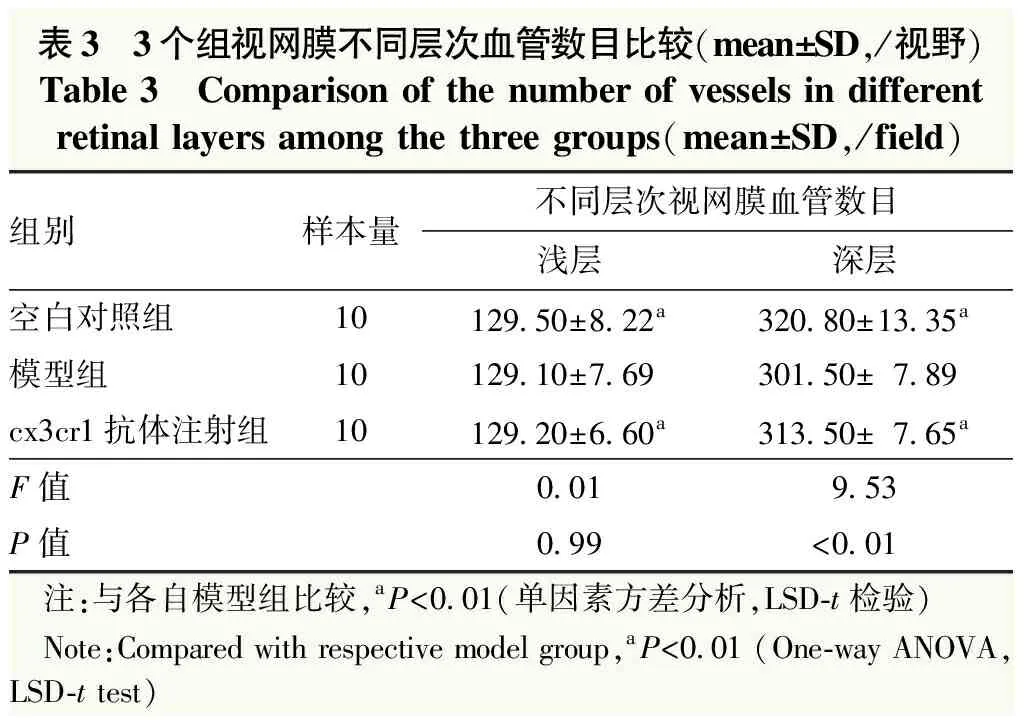
表3 3个组视网膜不同层次血管数目比较(mean±SD,/视野)Table 3 Comparison of the number of vessels in differentretinal layers among the three groups(mean±SD,/field)组别样本量不同层次视网膜血管数目浅层深层空白对照组10129.50±8.22a320.80±13.35a模型组10129.10±7.69301.50±7.89cx3cr1抗体注射组10129.20±6.60a313.50±7.65aF值0.019.53P值0.99<0.01 注:与各自模型组比较,aP<0.01(单因素方差分析,LSD-t检验) Note:Compared with respective model group,aP<0.01 (One-way ANOVA,LSD-t test)
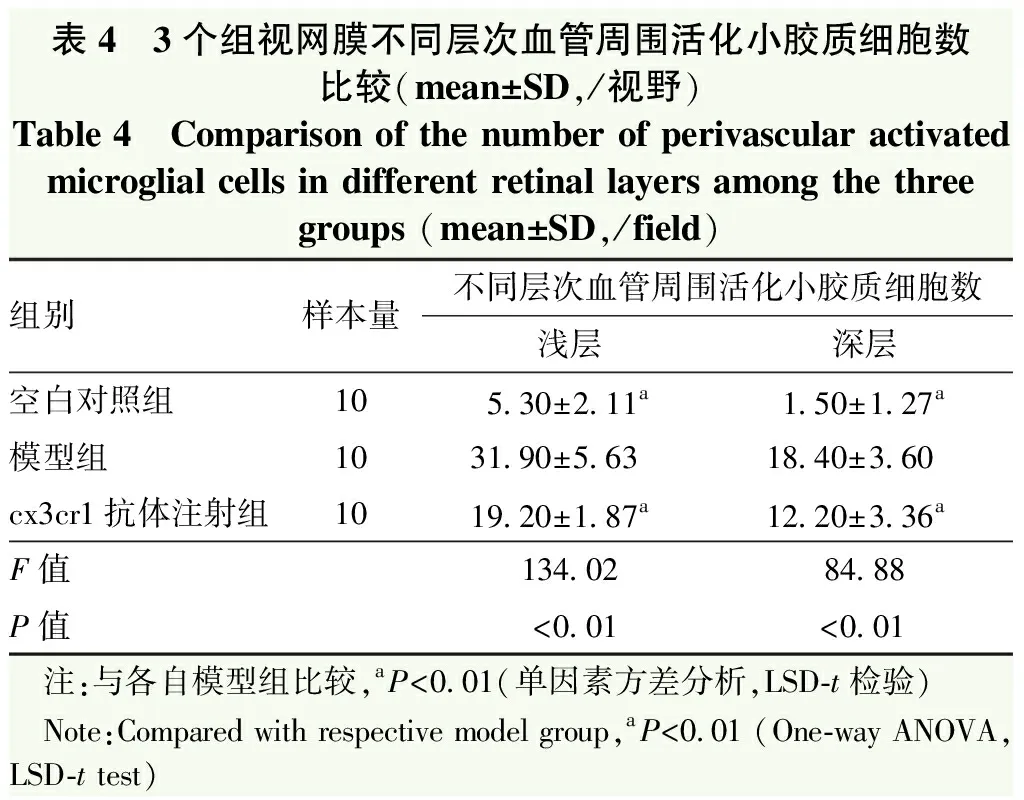
表4 3个组视网膜不同层次血管周围活化小胶质细胞数比较(mean±SD,/视野)Table 4 Comparison of the number of perivascular activatedmicroglial cells in different retinal layers among the threegroups (mean±SD,/field)组别样本量不同层次血管周围活化小胶质细胞数浅层深层空白对照组105.30±2.11a1.50±1.27a模型组1031.90±5.6318.40±3.60cx3cr1抗体注射组1019.20±1.87a12.20±3.36aF值134.0284.88P值<0.01<0.01 注:与各自模型组比较,aP<0.01(单因素方差分析,LSD-t检验) Note:Compared with respective model group,aP<0.01 (One-way ANOVA,LSD-t test)
2.4 各组小鼠视网膜血管渗漏面积比较
空白对照组小鼠视网膜毛细血管呈网状结构,走行和排列规则,未见荧光素渗漏(图4A);模型组毛细血管结构紊乱,部分毛细血管形成异常吻合,可见明显的荧光素渗漏,部分毛细血管闭塞,可见无灌注区(图4B);cx3cr1抗体注射组毛细血管闭塞减少,血管渗漏减轻(图4C)。空白对照组、模型组和cx3cr1抗体注射组视网膜血管相对渗漏率分别为(100.0±4.7)%、(162.1±10.6)%和(130.5±9.5)%,总体比较差异有统计学意义(F=128.66,P<0.01);模型组小鼠视网膜血管相对渗漏率明显高于空白对照组和cx3cr1抗体注射组,差异均有统计学意义(均P<0.05)(图4D)。
2.5 各组小鼠视网膜中缺氧相关因子及炎性因子mRNA表达
各组小鼠视网膜中VEGF-A、TNF-α、HIF-1α和IL-1β mRNA相对表达量总体比较,差异均有统计学意义(F=154.26、206.39、140.68、175.12,均P<0.01);模型组视网膜中VEGF-A、TNF-α、HIF-1α和IL-1β mRNA相对表达量明显高于空白对照组和cx3cr1抗体注射组,差异均有统计学意义(均P<0.05)(表5)。
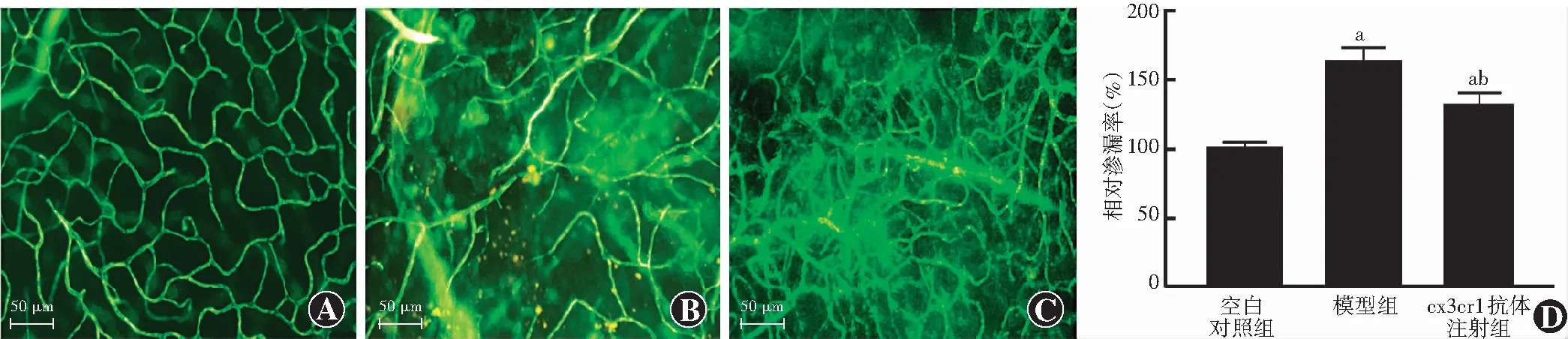
图4 各组小鼠视网膜血管渗漏情况比较 A:空白对照组小鼠视网膜毛细血管网未见荧光素渗漏(FITC-dextran ×200,标尺=50 μm) B:模型组小鼠毛细血管结构紊乱,可见毛细血管形成异常吻合及渗漏(FITC-dextran ×200,标尺=50 μm) C:cx3cr1抗体注射组小鼠血管渗漏有所减轻(FITC-dextran ×200,标尺=50 μm) D:各组视网膜血管相对渗漏率比较 F=128.66,P<0.01.与空白对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验,n=10)Figure 4 Comparision of mice retinal vascular leakage in each group A:No fluorescein leakage was observed in retinal capillary network of the blank control group (FITC-dextran ×200,bar=50 μm) B:The capillary structure in the model group was disordered,and abnormal capillary formation and vascular leakage was observed (FITC-dextran ×200,bar=50 μm) C:The mice retinal vascular leakage in the cx3cr1 injection group was reduced in comparison with the model group (FITC-dextran ×200,bar=50 μm) D:Comparison of relative retinal vascular leakage rate among the three groups F=128.66,P<0.01.Compared with the blank control group,aP<0.05;compared with the model group,bP <0.05 (One-way ANOVA,LSD-t test,n=10)
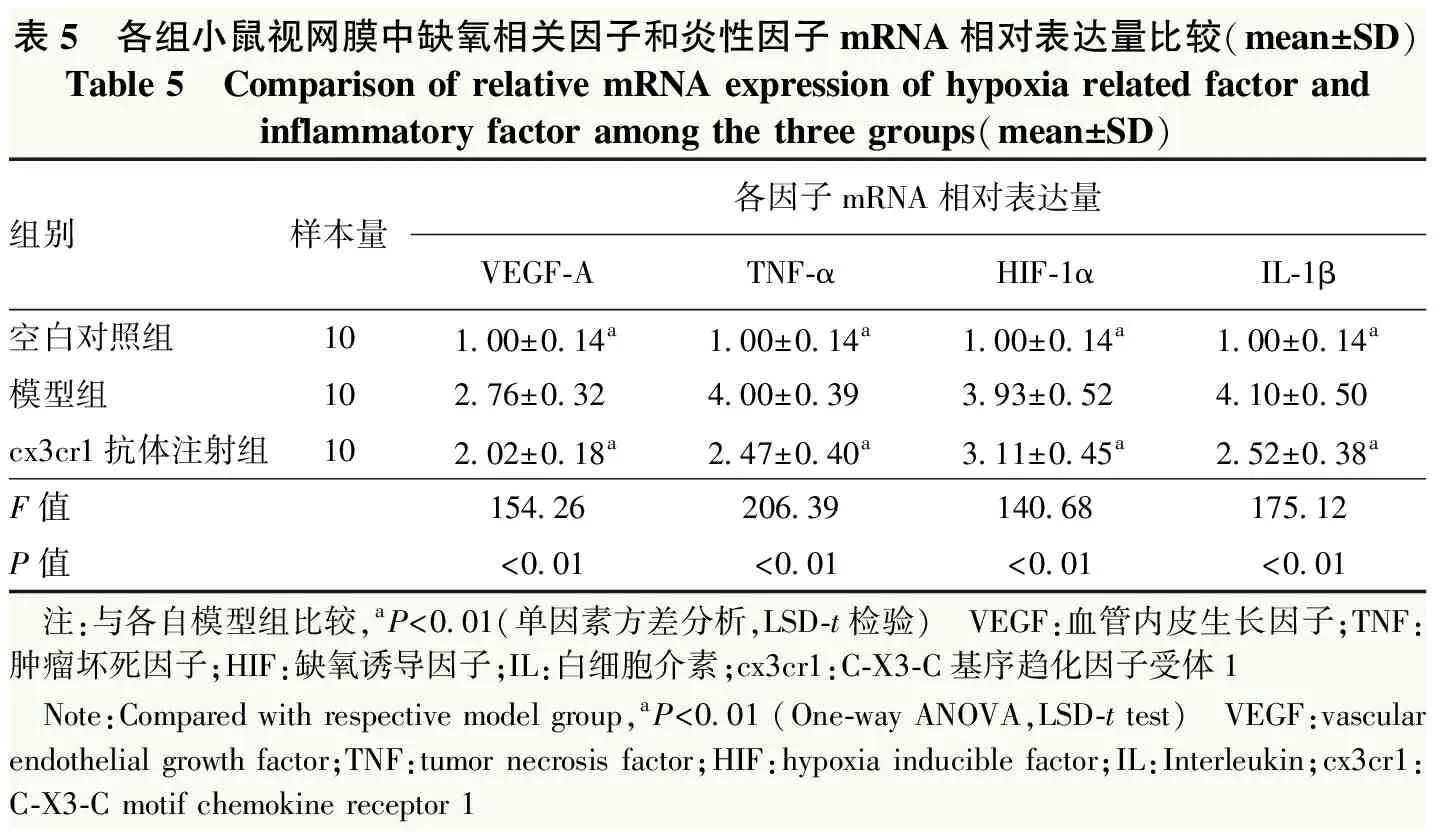
表5 各组小鼠视网膜中缺氧相关因子和炎性因子mRNA相对表达量比较(mean±SD)Table 5 Comparison of relative mRNA expression of hypoxia related factor andinflammatory factor among the three groups(mean±SD)组别样本量各因子mRNA相对表达量VEGF-ATNF-αHIF-1αIL-1β空白对照组101.00±0.14a1.00±0.14a1.00±0.14a1.00±0.14a模型组102.76±0.324.00±0.393.93±0.524.10±0.50cx3cr1抗体注射组102.02±0.18a2.47±0.40a3.11±0.45a2.52±0.38aF值154.26206.39140.68175.12P值<0.01<0.01<0.01<0.01 注:与各自模型组比较,aP<0.01(单因素方差分析,LSD-t检验) VEGF:血管内皮生长因子;TNF:肿瘤坏死因子;HIF:缺氧诱导因子;IL:白细胞介素;cx3cr1:C-X3-C基序趋化因子受体1 Note:Compared with respective model group,aP<0.01 (One-way ANOVA,LSD-t test) VEGF:vascular endothelial growth factor;TNF:tumor necrosis factor;HIF:hypoxia inducible factor;IL:Interleukin;cx3cr1:C-X3-C motif chemokine receptor 1
3 讨论
近年来,对于RIR损伤中微循环保护或治疗的研究大多聚焦于VEGF的表达。抗VEGF药物在治疗RIR损伤性疾病过程中对于血管通透性损伤、组织水肿等微循环有一定的改善作用,但其仍未能从根本上解决微循环损伤,存在治疗效果有限、治疗时限性短等问题[8-9],因此,仍需研究RIR微循环损伤发生的具体机制,以探索更为有效而持久的治疗方法。
Cx3cr1是小胶质细胞核神经元之间的信号传递者,在小胶质细胞的活化中发挥着调控作用,小胶质细胞中丰富表达cx3cr1[10-11]。本课题组前期实验结果及大量的文献报道均证明,当RIR时,视网膜细胞及组织内的cx3cr1表达升高,进而激活小胶质细胞,因此推测阻断cx3cr1与其配体结合,从而抑制小胶质细胞活化,减少其对微循环的损伤作用。本研究发现,玻璃体腔注射cx3cr1抗体能够抑制RIR模型小鼠视网膜中小胶质细胞活化为阿米巴样的形态,且活化细胞数量和迁移至视网膜深层的细胞数量均明显减少。
Ebneter等[12]在激光诱导视网膜静脉阻塞的动物模型中发现,阻塞的血管周围活化小胶质细胞密度明显增加。Jolivel等[1]在脑部缺血—再灌注损伤模型中观察到,活化的小胶质细胞内存在血管内皮细胞的标志物,证实小胶质细胞可以直接吞噬血管内皮细胞而造成血管结构的直接损伤。以上研究表明,抑制小胶质细胞活化可能对缺血损伤中的微循环具有保护作用。Iba-1高度特异性表达于活化小胶质细胞中,因此将其作为活化小胶质细胞的标志物[12]。本研究还发现,视网膜小胶质细胞活化被抑制后RIR模型小鼠微循环的损伤有所减少,视网膜深层血管密度有所增加,闭锁的血管减少,血管渗漏率明显下降,从结构和功能2个方面研究证实了抑制小胶质细胞活化可以保护RIR中的微循环。以往文献报道,活化小胶质细胞可对血管壁造成直接损伤,并通过调控炎症反应破坏视网膜—血管屏障[13-14]。本研究结果显示,抑制小胶质细胞的活性后小胶质细胞向血管迁移的能力明显下降,黏附于血管壁的细胞数量明显减少;另一方面,小胶质细胞活化受到抑制后,视网膜组织中与血管损伤密切相关的因子VEGF、HIF、TNF-α mRNA表达均明显下调;其中VEGF和HIF的表达下调证明组织缺血缺氧的情况得到缓解,微循环功能得到改善[15-16];炎性因子TNF-α表达下调,推测组织炎症反应得到控制,从而保护了微循环的结构和功能。
综上所述,本研究证实了活化小胶质细胞对RIR中微循环的破坏作用,采用抗体中和的方法抑制小胶质细胞活化可有效保护视网膜微循环的结构和功能,为视网膜和其他组织缺血再灌注损伤的治疗提供了新思路。本研究仍存在一些不足,如仅探讨了抑制小胶质细胞活化对视网膜微循环的影响,而缺血—再灌注损伤对组织微循环的损伤是一个复杂的过程,其中涉及许多细胞因子和信号通路[17-18];此外,本研究仅检测了缺氧反应因子和炎性因子基因表达水平,各因子的蛋白表达水平及其在RIR中的作用还需要进一步验证,RIR过程中神经血管单元与胶质细胞的互作具体机制等问题仍有待进一步研究。
利益冲突所有作者均声明不存在利益冲突
