黄芪多糖对腹主动脉缩窄大鼠心肌肥厚及自噬的影响*
2021-08-20陈广琴白法文洪钰杰
陈广琴,白法文,洪钰杰
(广西中医药大学附属瑞康医院心内科,南宁 530000)
自噬(autophagy)是普遍存在于真核细胞中高度保守的代谢过程,生理条件下自噬通过选择性降解胞内蛋白和受损细胞器,对维持细胞内环境稳态至关重要,但过度自噬将导致自我消化而加重损伤[1]。研究表明,在心肌肥厚的发展过程中,ATP合成减少可促进自噬活性升高,自噬的激活有助于改善心肌肥厚,但是持续的自噬激活进一步加重线粒体损伤,从而导致心脏结构和功能异常[2]。黄芪多糖(astragalus polysaccharide,APS)是从豆科植物膜荚黄芪或蒙古黄芪的干燥根中提取的水溶性多糖成分。最近的离体研究及在体动物实验均显示,APS 具有抑制心肌肥厚的保护作用[3-4]。本课题组前期研究也证实,APS对主动脉缩窄所致的大鼠心肌肥厚有保护作用,其抑制心肌肥厚的机制与激活AMPK,改善心肌能量代谢有关[5]。APS是否可通过调控自噬,发挥抑制心肌肥厚的保护作用,目前尚未见有报道。本研究建立腹主动脉缩窄(AAC)术致心肌肥厚大鼠模型,观察APS 对模型大鼠术后LC3Ⅱ/GAPDH、beclin-1 表达及自噬小体数量的影响,初步探讨APS对压力超负荷大鼠心肌肥厚及心肌细胞自噬的影响。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠60 只,体质量200~300 g,购自广东省实验动物中心(动物许可证批号:SYXK(粤2017014),饲养于广东省实验动物中心。
1.2 药物、试剂与仪器
1.2.1 主要药物和试剂 APS(上海麦克林生物技术有限公司),批号:C10062382,纯度>70%。兔LC3BⅠ抗(CST,货号:#43566),兔beclin-1Ⅰ抗(CST,货号:#3495),IgG-HRP 标记的抗兔Ⅱ抗(SANTA CRUZ,货号:sc-2004),GAPDH(abcam,货号:Ab181602)。组织细胞总蛋白抽提试剂盒P1250(考马斯亮蓝法)(北京普利莱基因技术有限公司)。
1.2.2 主要仪器 LG2000 型数码凝胶图像分析系统(杭州朗基科学仪器有限公司)。Mini型蛋白电泳系统(美国Bio-rad 公司)。Hitachi H7500 型电子显微镜。
1.3 实验方法
1.3.1 实验动物及造模 24 只健康SD 大鼠,结扎大鼠腹主动脉制备心肌肥厚模型,随机分为模型(AAC)组、APS 组,具体方法参照文献[6]。假手术(Sham)组:12 只SD 大鼠,仅分离腹主动脉不结扎。手术后1周开始灌胃给药,APS组给予APS 400 mg/kg·d-1。以灭菌蒸馏水溶解APS,调整浓度,使每次灌胃容量在2 mL 左右;其余两组均每天给予2 mL灭菌蒸馏水。共8周。
1.3.2 心肌肥厚指数的测定 8 周后,空腹大鼠称重后处死,取出心脏称重,再分离出左心室称重。计算心脏质量指数(heart mass index,HMI)=心脏重量(mg)/大鼠总体重(g),左心室质量指数(left ventricular mass index,LVMI)=左心室的体重(mg)/大鼠总体重(g)。
1.3.3 苏木精-伊红(HE)染色及测量心肌细胞直径和表面积 左室心肌组织以4%甲醛固定后石蜡包埋。按5 μm 厚度连续切片5~6 片,常规脱蜡脱水后行HE染色15 min,中性树胶1~2滴封片。显微镜下拍照(×400),观察心肌细胞形态及纤维排列;每个切片随机选取80~100 个横切的左心室心肌细胞(要求尽量呈圆形),测量其直径及横截面积,取平均值。
1.3.4 Western blotting 检测心肌组织LC3Ⅱ/GAPDH、beclin-1 的蛋白表达量 冰上取心肌组织,每100 mg心肌加入500 μL裂解液(RIPA裂解液),提取心肌组织总蛋白。BCA法蛋白定量、变性,制胶,上样,电泳分离及冰上转膜。洗膜后孵Ⅰ抗:LC3B(1∶1 000)、beclin-1(1∶1 000),4 ℃冰箱过夜。孵HRP标记的抗兔Ⅱ抗(1∶2 000),室温,1 h。ECL发光,X-光胶片曝光检测。以GADPH 作为内参,用IPP6.0图像分析软件分析蛋白灰度。
1.3.5 电镜标本制备及检测 剪取1~2 cm2心肌组织,以2.5%多聚甲醛和戊二醛固定;4 ℃冰箱过夜,取出后予0.1 mol/L 磷酸漂洗液漂洗数次;2%锇酸后固定30 min,脱水;此后于50%、70%、80%、90%、100%乙醇中依次漂洗,时间为10~15 min;100%丙酮浸透和包埋;Epon812 环氧树脂再次包埋于多孔橡胶包埋模板中,烘干;超薄切片后予柠檬酸铅染色。于电镜下摄片,观察自噬体数量。
1.4 统计学方法
采用SPSS 17.0 统计学软件对数据进行统计学什么,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 HMI、LVMI及心肌细胞直径、表面积结果
与Sham组比较,AAC组大鼠HMI、LVMI、心肌细胞直径和心肌细胞表面积明显增加(P<0.01),表明大鼠已出现心肌肥大。与AAC组比较,APS组大鼠HMI、LVMI、心肌细胞直径和心肌细胞表面积明显降低(P<0.01),见表1。
表1 各组大鼠HMI、LVMI、心肌细胞直径和心肌细胞表面积的比较 ,n=12

表1 各组大鼠HMI、LVMI、心肌细胞直径和心肌细胞表面积的比较 ,n=12
与Sham组比较,aP<0.01;与AAC组比较,bP<0.01。
2.2 心肌组织HE染色结果
与Sham组比较,AAC组心肌纤维束增宽,肌纤维间隙变宽,疏松水肿,心肌纤维肥大,排列紊乱,组织中可见炎症细胞浸润间质增大;与AAC 组比较,APS组病理变化明显改善,心肌纤维束缩小,间隙变窄,心肌细胞排列较整齐,组织中炎症细胞浸润间质变小,见图1。
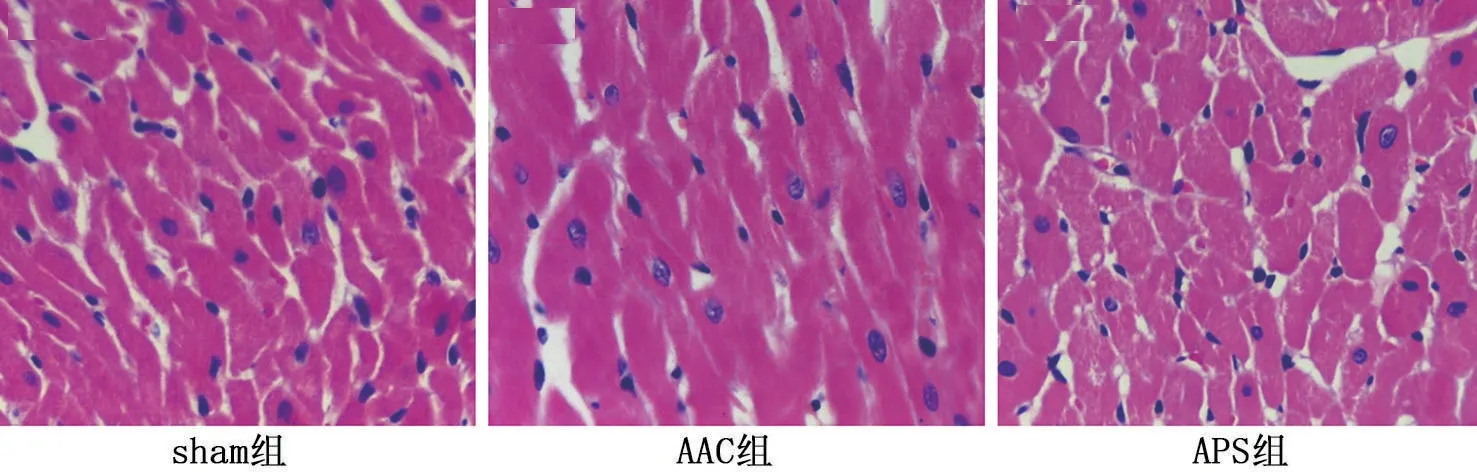
图1 HE染色观察APS对大鼠心肌细胞形态的影响(HE,×400)
2.3 心肌组织LC3Ⅱ/GAPDH、Beclin-1的蛋白表达水平
与Sham 组比较,AAC 组心肌组织中LC3Ⅱ/GAPDH 及beclin-1 水平明显升高(P<0.05);与AAC 组比较,APS 组LC3Ⅱ/GAPDH 及beclin-1 水平明显下降(P<0.05),见图2。
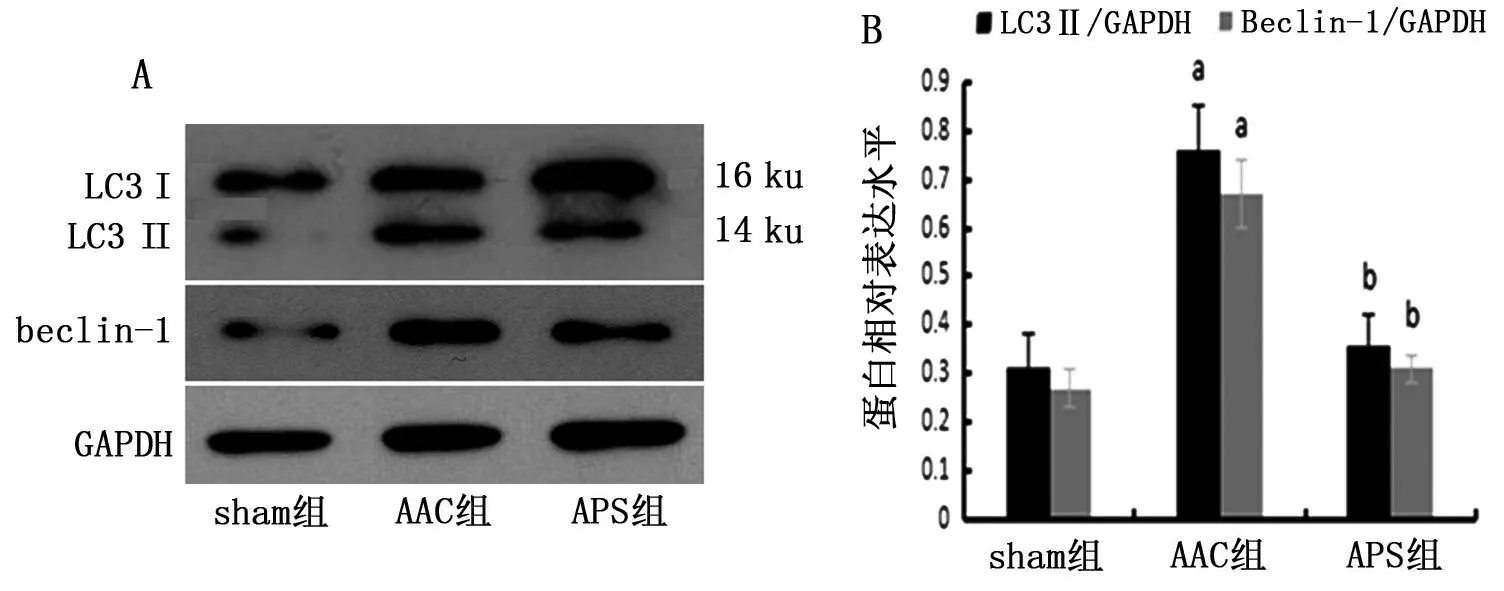
图2 蛋白免疫印迹检测各组大鼠心肌组织中LC3Ⅱ/GAPDH、beclin-1蛋白表达
2.4 电镜检测心脏组织中自噬小体
在电子显微镜下观测自噬小体数量,图中呈新月状或杯状,外为双层或多层膜,内有包绕胞浆成分如线粒体、溶酶体等的囊泡即为自噬小体,AAC组自噬小体明显增加,而APS 组自噬小体数量较AAC组明显减少,见图3。
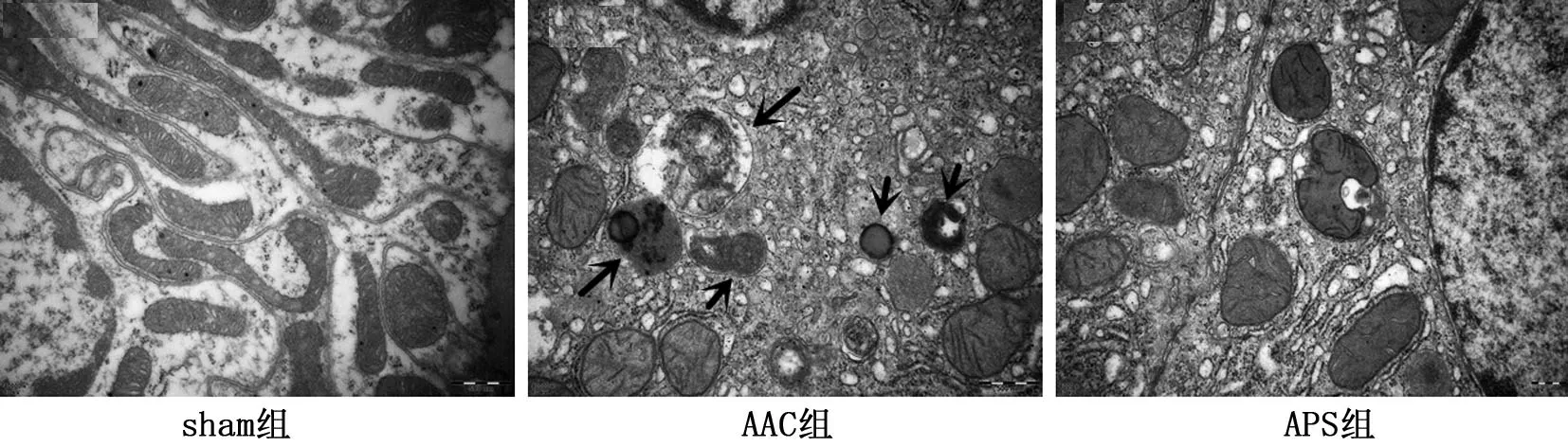
图3 电镜下各组大鼠心肌组织自噬小体的数量,箭头指自噬小体
3 讨论
APS 是从膜荚黄芪或蒙古黄芪的根部中提取的水溶性多糖成分,由APSⅠ和Ⅱ组成;具有调节免疫、降糖降脂、抗炎、抗氧化和抗病毒的药理活性[7]。在心血管系统中,APS 在心肌再灌注损伤及糖尿病心肌病变中的心肌保护作用已被大量研究证实,其机制与抗氧化应激、减少心肌细胞凋亡等有关,涉及多个信号转导通路[8-9]。近年来,离体及在体研究均有报道APS 抑制心肌肥厚的保护作用。如章樱[3]培养离体心肌细胞,异丙肾上腺素诱导其肥大,并使用APS 干预,结果显示APS 可抑制心肌细胞肥大,其机制可能与抑制TLR4活性、阻断NF-KB 及CaMK Ⅱ信号通路,减少炎症反应有关。另有研究报道,APS通过改善心肌能量代谢紊乱和提高线粒体的活力抑制腹主动脉缩窄所致大鼠心肌肥厚[6],本课题组前期研究也证实,APS对腹主动脉缩窄所致大鼠心肌肥厚具有保护作用,其机制可能与APS 激活AMP/p38 MAPK 信号通路有关[5];为进一步探究APS抑制心肌肥厚的机制,进行了如下研究。
本实验结果显示,AAC 组大鼠HMI、LVMI、心肌细胞直径和心肌细胞表面积均显著增加;HE 染色提示心肌结构异常,呈心肌肥厚病理改变。而给予APS 治疗后,大鼠HMI、LVMI、心肌细胞直径和心肌细胞表面积均较AAC组明显降低,APS组心肌肥厚程度明显减轻(P<0.01)。提示APS 可以有效抑制腹主动脉缩窄诱导的大鼠心肌肥厚。
自噬是一种具有高度保守性的生命过程,适当的自噬活性对于维持细胞的能量代谢稳态是必不可少。然而,过度激活的自噬会通过非选择性降解正常的线粒体和线粒体相关蛋白,加重线粒体损伤和能量代谢障碍,形成能量紊乱的恶性循环,导致细胞死亡[1]。心肌细胞中的自噬活性与心肌肥厚和心衰的发生密切相关,适当的自噬有利于抑制心肌肥厚的进展,但自噬的过度激活最终导致心力衰竭[10]。小鼠行胸主动脉缩窄术(TAC)后,自噬相关基因ATG5、LC3-Ⅱ和beclinl 等自噬标志物的表达增加,提示在TAC 诱导的心肌肥厚中,自噬被激活[11]。恢复自噬的正常表达有助于抑制心肌肥厚及改善心功能,如芪苈强心胶囊可通过激活AKT/mTOR通路抑制过量自噬减轻异丙肾上腺素所致心肌细胞损伤[12],大蒜素则可通过激活PI3K/Akt/mTOR 控制过度自噬,减轻AngⅡ诱导的心肌细胞肥大及腹主动脉缩窄诱导的大鼠心肌肥厚[13]。本研究发现随着心肌肥厚的出现,AAC组大鼠心肌组织中LC3Ⅱ/GAPDH、beclin-1 表达明显升高,心肌细胞中的自噬小体显著增加(P<0.05),提示自噬的过度激活可能在病理性心肌肥厚的进展中发挥作用。
近年来,相关研究表明,APS 可通过调控心肌组织中的自噬水平发挥保护作用,黄芪预处理可恢复阿霉素抑制的自噬从而减轻心肌损伤,改善心功能[14]。另有研究报道,APS 可能通过上调心肌细胞内自噬水平而抑制糖尿病心肌病大鼠心肌细胞凋亡,发挥心脏保护作用[9]。在压力超负荷诱导的心肌肥厚中,APS 对自噬的调控尚未明确。LC3/Atg8和Beclin-1/Atg6 是用于检测自噬水平的最常见两种标志物。本研究结果显示,APS 处理后,LC3Ⅱ/GAPDH、beclin-1 表达明显下降,自噬体数量减少(P<0.05),表明自噬活性受到了有效抑制,同时,心肌肥厚得到明显改善,提示APS对自噬的抑制可能是其保护心肌肥厚的重要机制之一。
综上所述,APS 能抑制压力超负荷大鼠心肌肥厚,其分子机制可能与APS 抑制自噬的表达有关。然而,涉及的具体信号通路仍未明确。尤其是我们的前期研究提示APS 可激活AMPK,而有趣的是,在心肌肥厚中,AMPK 对自噬的调控仍存在争议,大量研究表明AMPK 可促进自噬反应改善心肌肥厚[15];但也有报道表明,在心肌肥厚向心衰的过渡阶段,AMPK 可通过抑制自噬的表达而改善心功能[16]。在本研究中,APS 对自噬的调控是否与AMPK有关尚未明确,具体机制有待进一步实验探讨。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
