一种新型光催化制氢系统设计
2021-08-19展树中
展树中, 杨 浩
(华南理工大学化学化工学院,广州510640)
0 引 言
氢是一种理想的能源,是未来化石燃料的替代品[1]。光化学驱动水分解产氢是获得大量的和高纯度氢能的理想途径。为了降低能耗,提高氢气的产生效率,引入催化剂是必要的[2-4]。基于由过渡金属配合物组成的氢酶能够有效催化氢气的生成和氢气的氧化[5],包括我们在内的许多课题组把研究精力集中在过渡金属基催化剂的设计与研究上,并且取得了丰硕的成果,一些具有催化制氢功能的过渡金属配合物基催化剂已经被设计和发展起来[6-13]。然而,这些学术发现似乎远离学生们的学习过程,很少出现在学生的实验教学中,尤其是本科学生的化学实验课中。为了使学生能了解和亲身体验最新的研究成果,本文介绍一种能用于本科实验教学的新型光催化制氢方法。这一实验课也为学生提供了一次了解过渡金属配合物的合成、表征和用于催化制氢应用的机会。
1 实验原理与实验材料
1.1 光催化水还原制氢系统的组装
无论是均相还是多相的光催化制氢系统一般是由光敏剂(P)、电子给体(D,牺牲剂)和催化剂构成。
(1)电子给体(D)的选择。根据催化剂性能的不同,选择适应于酸性或碱性介质的电子给体(D),例如抗坏血酸、乙醇胺或亚硫酸盐等。
(2)光敏剂(P)的筛选。①以研究光催化机理为主,可见光为光源的均相系统,水溶性的钌配合物,例如,[Ru(bpy)3]Cl3(bpy:2,2′-联吡啶)等常常作为光敏剂的候选;②以紫外光为光源的多相系统,常选择TiO2等作为光敏剂;③ 以催化应用为主,以可见光为光源的多相系统,根据催化剂不同的性能,选择不同的光敏剂,比如,CdS、ZnS和CdSe等。
(3)催化剂的设计。催化剂种类很多,本实验选取金属配合物作为催化剂。具有催化性能配合物设计的前提条件是:金属配合物具有不饱和性或催化过程中具有不饱和性,以便使金属中心有空位置发生水的还原反应。
1.2 仪器、试剂和材料
仪器:烧杯(100、250 mL)、量筒(100 mL)、蒸馏烧瓶(50 mL)、布氏漏斗、吸滤瓶、pH计、分析天平、试管、LED灯(λ=469 nm)光照箱、注射针、旋转蒸发仪、烘箱、不锈钢反应釜、聚四氟乙烯衬套。
测试仪器:扫描电子显微镜(SEM)、检测氢气的气相色谱仪。
试剂:CdCl2(分析纯,AR)、Na2S2O3(分析纯,AR)、[Ru(bpy)3]Cl3(分析纯,AR)、2,2′-联吡啶(bpy,分析纯,AR)、Co(NO3)2·6H2O(分析纯,AR)、KH2PO4(分析纯,AR)、抗坏血酸(分析纯,AR)。
2 实验步骤
2.1 钴基催化剂[(bpy)2 Co(NO3)]·NO3的制备
把10 mL含有0.291 g(1.0 mmol)Co(NO3)2·6H2O的甲醇溶液加入含有0.312 g(2.0 mmol)2,2′-联吡啶的10 mL甲醇溶液的烧杯中,搅拌0.5 h后得到一种红色溶液。接下来,利用旋转蒸发仪对该红色溶液进行蒸发,浓缩至饱和。冷却至室温后便析出玫瑰红晶体,产率为76%。
2.2 CdS纳米棒(Cd S NRs,光敏剂)的制备
把2.2 g(0.012 mol)的CdCl2溶解在35 mL蒸馏水中,在搅拌条件下加入12 mmol的硫代硫酸钠,并继续搅拌1 h。然后,将此混合溶液装入50 mL的聚四氟乙烯的衬套里。接下来,将此衬套放入不锈钢反应釜中,并将反应釜放入烘箱升温至160℃,保持6 h进行水热反应。反应结束后取出,自然冷却至室温,衬套里便析出黄色晶体。过滤、蒸馏水和乙醇洗涤几次得到黄色产物。然后,把黄色产物放入烘箱里80℃下烘烤3 h,取出、冷却,并利用扫描电子显微镜(SEM)对其进行形貌表征。最后,把表征好的CdS纳米棒装入样品管以备使用。
2.3 光催化产氢系统组装
实验的光催化产氢系统由CdS纳米棒(CdSNRs,光敏剂)、抗坏血酸(H2A,牺牲剂)和[(bpy)2Co(NO3)]·NO3(催化剂)三组分构成(见图1)。
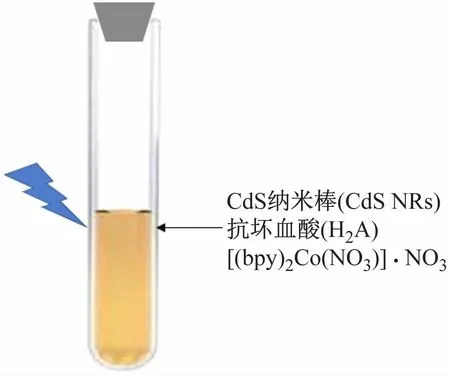
图1 光催化反应制氢装置示意图
2.4 氢气的检测、定量及效率分析
把3种组分转移至试管中,用KH2PO4溶液调节介质的pH,并用橡皮塞密封试管(见图1)。接下来把这一催化反应装置放入LED灯(λ=469 nm)光照箱中,开启光催化反应。一定时间光照后,用注射针抽取催化反应装置上部的气体,利用气相色谱仪的检测和下式定氢气产生量,
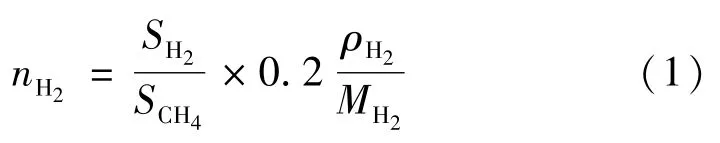

式中:TON为氢气的转化数;nH2为氢气的量;ncatalyst为加入光催化反应的催化剂量。
2.5 影响光催化系统制氢效率的因素
2.5.1 酸碱性
在CdS纳米棒(60 mg/L)、抗坏血酸(0.10 mol/L)和[(bpy)2Co(NO3)]·NO3(0.01 mmol/L)三组分用量确定的情况下,通过改变介质的pH测量介质的酸碱性对光催化制氢效率的影响。蓝光照射后,测定系列光催化系统的产氢量。从图2看出,介质的最优条件是pH=5。
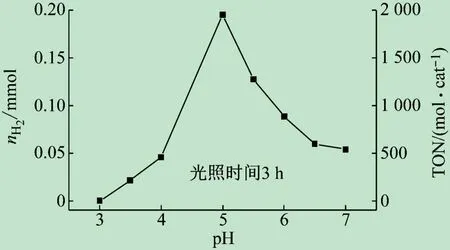
图2 光催化系统pH对制氢效率的影响
式中:nH2为氢气的量;SH2为氢气峰面积百分比;SCH4为注入的内标气体甲烷峰面积百分比;0.2是注入内标气体甲烷的体积,mL;ρH2为氢气的密度;MH2为氢气的相对分子质量。
根据测得氢气的量可以计算出某一光催化系统的制氢效率,
2.5.2 牺牲剂用量
在CdS纳米棒(50 mg/L),[(bpy)2Co(NO3)]·NO3量(0.01 mmol/L)和介质pH确定的基础上,通过改变抗坏血酸的用量测试其对光催化产氢效率的影响。蓝光照射后,测定系列光催化系统的产氢量。从图3看出,牺牲剂的最佳用量为0.10 mol/L。
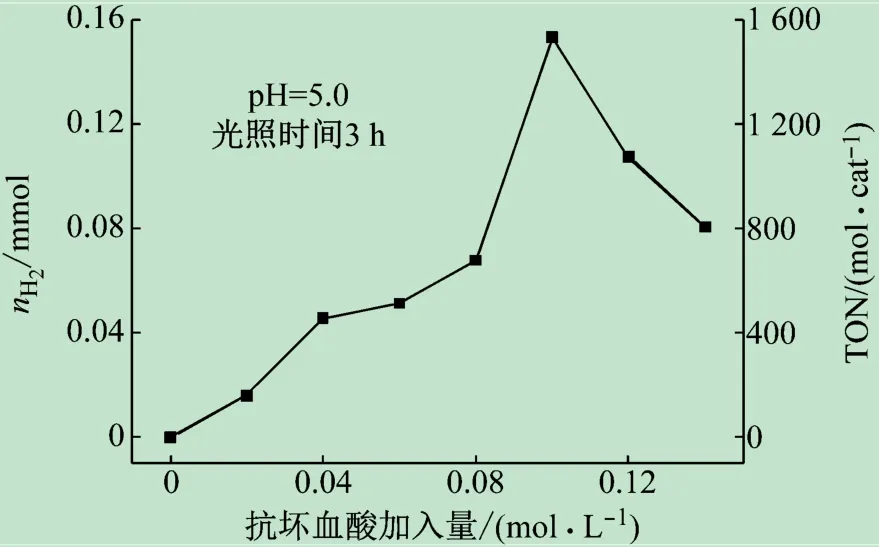
图3 光催化系统抗坏血酸的加入量对制氢效率的影响
2.5.3 光敏剂用量
在抗坏血酸(0.10 mol/L),[(bpy)2Co(NO3)]·NO3用量(0.01 mmol/L)和介质pH确定的基础上,通过改变CdS纳米棒的量调查光敏剂的用量对光催化制氢效率的影响。蓝光照射后,测定系列光催化系统的产氢量。从图4看出,光敏剂的最佳用量为70 mg/L。

图4 光催化系统CdSNRs的加入量对制氢效率的影响
3 实验结果与分析
3.1 钴基光催化剂的制备与表征
Co(NO3)2与2,2′-联吡啶反应得到一种钴配合物,产率为76%。晶体结构分析证明[14],其结构组成为[(bpy)2Co(NO3)]·NO3。该钴配合物能很好地溶解于水和大多数有机溶剂中。

3.2 Cd S纳米棒(Cd S NRs)的制备与表征
采用水热法,160℃下,CdCl2与硫代硫酸钠反应得到CdS纳米棒。
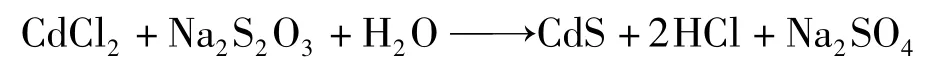
其形貌可由扫描电子显微镜(SEM)表征,结果见图5。

图5 CdS纳米棒(CdSNRs)的SEM图
3.3 最佳组成光催化系统的制氢效率
基于一系列的控制实验与分析,优化出最佳组成,70 mg/L CdS NRs,0.10 mol/L H2A和0.01 mmol/L的[(bpy)2Co(NO3)]·NO3,介质的pH为5.0。该条件下,对系列光催化制氢系统进行蓝光照射。定时检测氢气的产出量,结果见图6。例如,3 h的蓝光照射能产生0.155 mmol的氢气,光催化制氢效率为2 105(mol/cat)。

图6 光催化系统的氢气产生量及制氢效率
3.4 光催化制氢机理的调查
基于大量的研究结论[14-16],给出了上述光催化系统的光催化制氢机理。如图7所示,在光照的条件下,作为光敏剂的CdS释放出电子(e-),同时留下空穴(h+)。吸纳CdS释放出的电子后,[CoII(bpy)2]2+被还原为Co(I)物种,[CoI(bpy)2]+,而留下的空穴

图7 光催化系统的氢气产生机理
(h+)由抗坏血酸(H2A)补充。接下来,氢质子(H+)的引入便产生了一种钴(III)-氢中间体,[H-I-CoIII-(bpy)2]。进一步氢质子的引入导致氢气的生成和[CoII(bpy)2]2+的复原,完成一个光催化周期。
4 结 语
一种钴基光催化剂很容易通过Co(NO3)2与2,2′-联吡啶反应得到,且产率高。这种催化剂与抗坏血酸(H2A)和CdS纳米棒组成的光催化系统能高效地制备氢气,5 h蓝光照射的制氢效率达到4 202(H2per mol of catalyst(mol of cat-1))。这一实验教学科目包括:① 催化剂([(bpy)2Co(NO3)]·NO3)和光敏剂(CdSNRs)的合成与表征。② 光催化制氢系统的组装与制氢效率的调查。③ 光催化制氢机理的调查与分析。通过5个学期的实验教学实践,该实验科目的实践非常成功,学生参与实验的热情非常高涨。原因归于:把新的学术研究成果引入学生的实验教学中,进一步激发其学习积极性;相关合成、表征与测试技术的引入也能全面提升学生的知识水平;催化剂和光敏剂等材料很容易合成且稳定。
