基于Notch信号通路探讨银屑平丸对银屑病模型小鼠皮损及血清炎性因子的调节作用
2021-08-19鲍秋羽席建元
鲍秋羽,席建元,刘 梨
(湖南中医药大学第一附属医院,湖南 长沙 410208)
银屑病(Psoriasis,PS)是一种免疫介导的炎症性、瘙痒性皮肤病,影响全球约2%~3%的人口[1]。PS有多种特征表现,如表皮棘皮症、角化过度或角化不全、炎症浸润物或者免疫细胞广泛存在于真皮与表皮而形成的脓疱或微小脓疱等[2-3]。根据PS发病时的临床表现,可分为关节病型、脓疱型、红皮病型、寻常型等4种类型[4]。其中寻常型PS患者占总数的90%以上,主要表现为红色炎性丘疹,表面附着多层干燥的白色鳞屑,刮除可见筛状出血,及“阿氏征”,遍布头皮、四肢,甚至泛发全身[5-6]。中医因其皮疹“色白而痒,瘙起而皮”而称之为“白疕”,或因其“状如苍松之皮,红白点相连”而称之为“松皮癣”。《医宗金鉴》中叙述本病“皆是风邪客肌肤,亦有血燥难外荣”,即是内外合邪,外感六淫,不能宣泄,内失疏导,肌表阻滞。PS发病原因不明,现代研究显示其发病可能与环境、感染[7]、精神、遗传[8]、病毒[9]及胆固醇[10]等相关,但具体机制仍未完全明确。在前期研究中,临床中广泛应用银屑平丸治疗PS取得了显著、稳定的疗效,同时不良反应较小[11-12]。本实验研究以前期研究为基础,通过用咪喹莫特乳膏制造BALB/c小鼠PS样模型,进一步探讨银屑平丸治疗PS的作用机制。
1 材料与方法
1.1 实验动物 SPF清洁级BALB/cByJ(BALB/c)小鼠(雌雄各半)购自湖南斯莱克景达实验动物有限公司[动物许可证号:SCXK(湘)2019-0004)],体重18~20 g,周龄为8~12周,共50只。将小鼠置于中南大学湘雅医学院动物实验中心[温度保持在(21±3)℃、相对湿度保持在40%~70%]饲养,小鼠饲料及可用饮水均由中南大学湘雅医学院实验动物中心提供。每组每只小鼠在实验前予以5 d的适应性喂养。实验全程按照动物伦理学标准进行。
1.2 实验药物 银屑平丸为湖南中医药大学第一附属医院院内制剂,主要药物为生地黄、牡丹皮、紫草、丹参、白花蛇舌草、半枝莲、大青叶、赤芍、防风、女贞子、旱莲草、甘草等。由我院制剂室提供(批号:20201204);阿维A胶囊(国药准字H20010126);5%咪喹莫特乳膏(国药准字H20030129);白凡士林(赣食药准字F20050006)。
1.3 主要试剂与仪器 Notch受体1(Notch1)一抗(美国Proteintech,货号:20687-1-AP)、JAGGED1蛋白(Jagged-1)1一抗(美国Proteintech,货号:66890-1-Ig)、Hes1转录因子(Hes-1)一抗(美国Proteintech,货号:66890-1-Ig)、IL-32一抗一抗(美国Proteintech,货号:11079-1-AP);PBS(美国Hyclone,货号:80334412);酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)白细胞介素-32(IL-32)、白细胞介素-33(IL-33)、白细胞介素-36(IL-36)试剂盒(武汉博士德生物,货号分别为:EK1599、EK0930、EK1247);总RNA提取试剂盒、实时荧光定量(RT-PCR)Notch1、Jagged-1、Hes-1试剂盒(购于武汉博士德生物,货号分别为:A00033-2、MK3569、MK2837、M03286);摇床(其林贝尔,型号:TS-92)、荧光定量RCP仪(美国Thermo,型号:PIKOREAL96)、电泳仪(北京六一,型号:DYY-2C),转膜仪(北京六一,型号:DYCZ-40D)。
1.4 动物分组 选用随机分组法将50只健康小鼠分为五组,包括空白对照组、模型组、阿维A胶囊组、银屑平丸组、阿维A胶囊+银屑平丸组(联合用药组),每组各10只小鼠。
1.5 PS小鼠模型的建立 实验前首先将50只健康小鼠使用戊巴比妥钠通过腹腔注射的方式进行药物麻醉(80 mg/kg),随后使用动物专用剃毛仪给麻醉后的实验小鼠清除背部白毛,充分暴露背部皮肤以外涂药物造模,面积约3 cm×4 cm大小,其中空白对照组小鼠使用凡士林造模,其他各组小鼠则使用5%咪喹莫特乳膏造模,1次/d,连续外用8 d。
1.6 动物给药 银屑平丸的临床使用剂量标准为0.75 g/kg,根据人与实验小鼠体重比例计算,本研究中用量与临床等效剂量相当,设定为6.49 g/(kg·d)。同样公式换算可以得出阿维A胶囊组的临床等效剂量为6 mg/(kg·d)。使用0.9 %氯化钠溶液加热充分溶解银屑平丸粉剂及阿维A胶囊粉剂制备实验所用药液。外用药物造模同时,空白对照组以及模型组小鼠通过灌胃针灌胃0.9 %氯化钠溶液0.4 ml;阿维A胶囊组小鼠通过灌胃针灌胃阿维A药液0.4 ml;银屑平丸组小鼠以上述制备的银屑平丸药液通过灌胃针灌胃0.4 ml;每组小鼠每天均灌胃1次,连续用药8 d。
1.7 动物取材 第8日24 h后,每只小鼠通过在眼球处取血1.0 ml左右,随即将血液置于4 ℃的低温下离心1500 r/min共5 min,并立即抽吸上层血清,置于-20 ℃的环境下保存,用于检测本次实验的炎性细胞因子IL-32、IL-33、IL-36。后续断颈处死每只小鼠,使用无菌仪器在小鼠造模处留取皮肤组织,面积约1 cm×1 cm左右,分组固定保存于已经序号标记的福尔马林溶液中,脱水后石蜡包埋,然后切片,进行HE染色,用于研究组织病理、免疫荧光、Western blot及RT-PCR。
1.8 观察指标 观察每组小鼠皮损变化并予以PS皮损面积及严重程度指数(Psoriasis Area and Severity Index,PASI)评分,ELISA法检测各组小鼠血清IL-32、IL-33、IL-36等炎性因子的表达水平,Western blot检测皮损组织中Notch1、Jagged-1、Hes-1等蛋白水平的表达。实时定量PCR检测皮损组织中Notch1、Jagged-1、Hes-1等的mRNA的表达。
1.9 统计学方法 采用SPSS 20.0统计学软件进行分析。实验结果采用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 各组小鼠形态学观察及PASI评分情况 见表1。对照组、阿维A胶囊组、银屑平丸组、联合用药组小鼠均以咪喹莫特乳膏进行处理,选取造模第1天及第8天的皮损情况进行观察,模型组小鼠可见其皮损处出现成片红斑、大量鳞屑,且皮疹较为肥厚,表现为银屑样改变,阿维A胶囊组、银屑平丸组、联合用药组小鼠皮损均有不同程度的缓解,其中联合用药组小鼠皮损改善最明显(图1)。与空白对照组相对比,模型组、阿维A胶囊组、银屑平丸组、联合用药组小鼠背部皮损的严重程度通过计算PASI评分均有显著升高(P<0.05);与模型组相对比,阿维A胶囊组、银屑平丸组、联合用药组小鼠背部皮损的严重程度通过计算PASI评分均有显著降低(P<0.05),其中联合用药组效果最佳(P<0.05)。

表1 各组小鼠PASI评分情况(分)

A:空白对照组;B:模型组;C:阿维A胶囊组;D:银屑平丸组;E:联合用药组
2.2 各组小鼠组织病理学情况 见图2。可见空白对照组HE染色皮肤组织有完整的结构,分别为分界清晰的角质层和颗粒层,由多角细胞组成的外棘层以及有较多的单层柱状细胞组成的基底层。相较于模型组中的HE染色结果,视野中出现角质层断裂,角质层层数变少、变薄,呈现较不规则的角质不全,以及大量的乳头水肿。阿维A胶囊组、银屑平丸组、联合用药组视野下可见角质层断裂存在不同程度的改善,其中联合用药组改善程度较为明显。
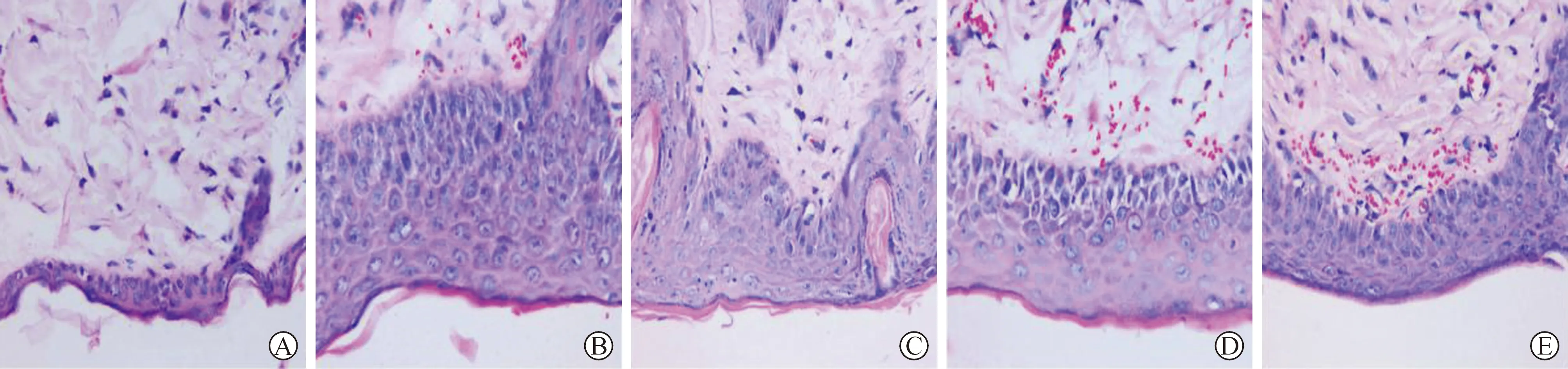
A:空白对照组;B:模型组;C:阿维A胶囊组;D:银屑平丸组;E:联合用药组
2.3 各组小鼠血清炎性因子情况比较 见表2。ELISA结果显示,阿维A胶囊组、银屑平丸组、联合用药组均可显著降低小鼠血清IL-32、IL-33、IL-36水平,其中联合用药组效果最佳(P<0.05),提示银屑平丸能够有效降低PS小鼠模型的血清炎性因子水平,同时与阿维A胶囊联合使用效果更佳。
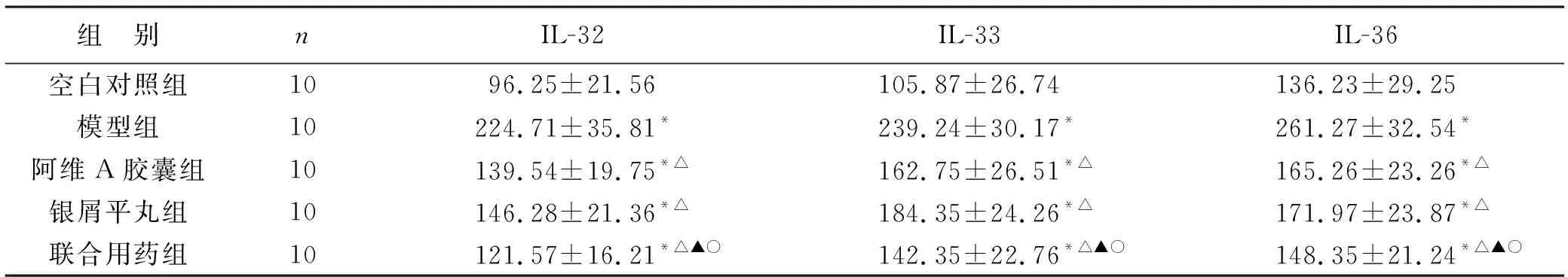
表2 各组小鼠血清炎性因子情况比较(ng/ml)
2.4 各组小鼠皮损组织Notch1、Jagged-1、Hes-1蛋白及mRNA表达情况 见表3、4(图3)。Western blot及RT-PCR结果显示,阿维A胶囊组、银屑平丸组、联合用药组均可降低小鼠皮损组织的Notch1、Jagged-1、Hes-1蛋白表达及mRNA表达,且联合用药组效果最优,差异具有统计学意义(P<0.05),提示银屑平丸能够通过抑制小鼠皮损组织Notch信号通路降低Notch1、Jagged-1、Hes-1等蛋白表达及mRNA表达。
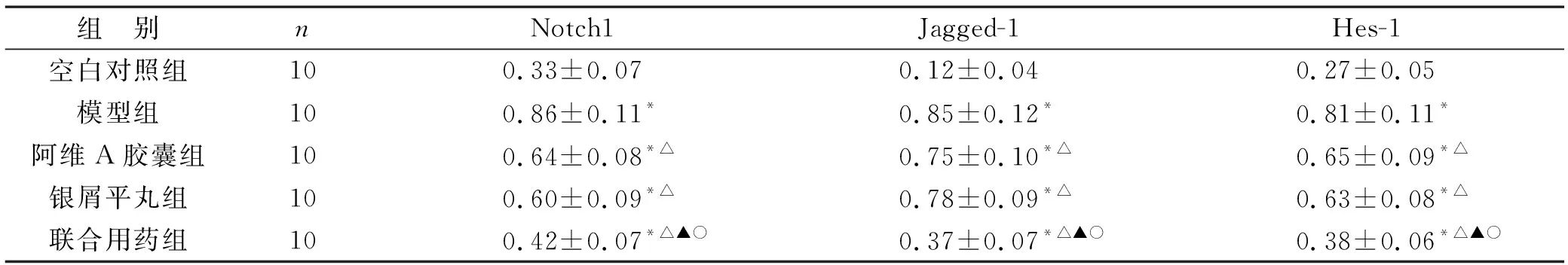
表3 各组小鼠皮损组织Notch1、Jagged-1、Hes-1蛋白表达情况比较(/β-actin )

表4 各组小鼠皮损组织Notch1、Jagged-1、Hes-1 mRNA表达情况比较(/β-actin)

A:空白对照组;B:模型组;C:阿维A胶囊组;
3 讨 论
PS是一种由免疫所介导的以红色斑块并覆有鳞屑为主要临床表现的慢性、炎症性皮肤病[13]。Puig等[14]的流行病学研究显示近年来我国PS患病率呈现出持续增长的趋势。PS除发生皮肤部位的临床表现外,存在部分患者发生关节疼痛不利,或伴随有心脑血管疾病以及糖尿病等代谢性疾病,严重影响了PS患者的身心健康及生活质量[15]。长期以来,PS被单纯认为是一种典型的基底细胞过度增殖性角质形成细胞疾病,随着T淋巴细胞在真皮层的浸润这一重要病理特征的发现,PS是一种由多种细胞参与的慢性炎症性皮肤病已经成为一种共识[16]。角质形成细胞和T细胞之间的交互作用是PS发生发展关键机制之一,并且这种交互作用需要细胞-细胞间的直接接触诱发炎症因子和趋化因子的大量释放。目前多项研究表明,Notch信号通路与角质形成细胞增殖、分化及免疫系统关系密切,可能是PS发病机制的重要组成部分,而角质形成细胞和T细胞及其他免疫细胞的交互作用在PS发生、发展中对于角质形成细胞的增殖和皮肤局部炎症发生至关重要,但关于T细胞和角质形成细胞之间如何进行交互作用来引发PS仍未被很好地阐述[17]。
Notch信号途径家族是一个在进化上十分保守的跨膜受体蛋白家族,在多种组织和器官的早期发育过程中,其家族成员对细胞的发育、生长、增殖及凋亡都起着重要的调控作用[18]。有学者发现PS患者皮损中Notch受体、配体表达异常,如Sondhi等[19]发现PS患者表皮内的Notch1、Jagged-1、Hes-1等分子的表达显著高于健康人群,提示Notch信号通路与PS的发生关系密切,是近年来PS的研究热点之一。此外,Notch信号还参与了T细胞的发育、活化与增殖、细胞因子的分泌等,同时亦参与了调节性T细胞的产生、扩增及功能发挥。Edigin等[20]报道当致敏的CD4+T细胞受到异性抗原刺激后,Notch中的关键蛋白Notch1、Jagged-1、Hes-1等受体的mRNA表达水平均显著升高,同时血清中IL-32、IL-33、IL-36等炎性因子显著上升,提示Notch信号在T细胞活化中起到重要作用,促进了T细胞的增殖。以上证据都表明,Notch信号不仅是表皮角质异常增殖的关键,同时也是T细胞活化的重要阀门,导致角质生成细胞-T细胞功能失衡,进而出现皮肤炎症应答级联放大,可能是PS发病关键分子机制之一。
从古至今,PS顽固难愈,给广大医者及患者都带来严重困扰。古今各医家根据自身临床经验已开创多种关于PS的治疗办法,在继承前人经验的基础上,并结合多年的临床实践,认为PS是内外邪相因而为病,外邪总因风、湿、热、燥、毒蕴积肌腠,内邪多因素体血分热盛,又因饮食辛辣厚腻,情志不舒而化热入里,血热毒邪久蕴阴损津耗,化生血燥;或邪热久蕴血分,致使营阴燔灼而营血亏耗,化为血虚;或血热煎熬津液,日久凝生血瘀,瘀热胶结;内外因相合,化为热、虚、燥、瘀,气血失于条畅,肌肤失于荣养而致红斑、鳞屑迭生,以生疕。导师根据该病的病因病机,结合多年临床经验创立“凉血养阴,清热解毒”这一治疗原则,并研发出“银屑平丸”,该丸剂由生地黄、牡丹皮、紫草、丹参、白花蛇舌草、半枝莲、大青叶、赤芍、防风、女贞子、旱莲草、甘草组成。方中生地黄味甘而苦寒,以寒之性凉解血热,以其养阴之效顾护津液,使邪气祛除同时不损正气,重用为君药。赤芍、丹皮、丹参味苦性微寒,均以血治,达肝经清疏郁滞之火毒,入血分清散蕴结之瘀热,凉解血热之时又能消散瘀血,防止内热与血相结;紫草甘寒同入血分,清解血分热毒,活血透泄斑疹;白花蛇舌草酸凉,半枝莲、大青叶苦寒,三药相合,清泄血热,凉解火毒,功专火热毒盛,共为臣药。血热内蕴,煎熬津液,津伤不能濡润肌肤,女贞子、墨旱莲互为佐药入肝肾以滋养肝肾之阴,益下荣上,养阴润燥以生津化液荣养肌肤。防风辛散驱邪外出,且为治风润药,功善疏风止痒,风祛则痒止;甘草功善清热解毒并能调和诸药,与防风共为使药,诸药相合,共奏凉血养阴,清热解毒之效。
本研究结果表明,相对于单独使用阿维A胶囊或银屑平丸,联合用药的效果最佳,亦显示出中西医结合治疗本病的独特优势。本次实验通过银屑平丸干预PS小鼠模型,结果显示银屑平丸能有效改善PS小鼠模型的皮损及病理损害,有效降低血清炎性因子水平,同时抑制Notch信号通路Notch1、Jagged-1、Hes-1等关键蛋白及mRNA的表达,同时与阿维A胶囊联合使用起到协同增效作用。说明银屑平丸可通过抑制Notch信号通路相关蛋白表达,缓解PS角质形成细胞的过度增殖分化以及炎性反应,加速皮肤病理损害的愈合,最终起到治疗PS的临床效果。
