银杏内酯B通过Nrf2/HO-1通路抑制糖尿病大鼠肝损伤机制研究
2021-08-19侯书鹏
侯书鹏
(河北省涿州市医院,河北 保定 072750)
国际糖尿病联盟(IDF)研究显示,2019年全球糖尿病患者超过4.6亿,并预计到2045年将超过7亿,其中约90%属于2型糖尿病(Type 2 diabetes mellitus,T2DM)患者[1]。持续高血糖能够诱发100多种并发症,其中肝损伤是其最常见的并发症之一,是导致糖尿病患者死亡的重要原因[2]。
糖尿病性肝损伤病理机制复杂,其中氧化应激在糖尿病性肝损伤的发生及其进展过程中发挥着重要作用,因此,抗氧化应激被视为重要的治疗靶点[3-4]。核因子E2相关因子2/血红素加氧酶1(Nuclear factor E2 related factor 2/Heme oxygenase 1,Nrf2/HO-1)是机体非常重要的抗氧化信号通路,有研究显示,激活Nrf2/HO-1通路能够对糖尿病性肝损伤具有抑制作用[5]。银杏内酯B(Ginkgolide B,GB)是银杏叶的主要活性成分之一,具有良好的抗氧化作用[6]。本实验旨在探讨GB对糖尿病大鼠肝脏的保护作用及其机制,为临床应用GB防治糖尿病肝损伤提供理论依据,现报告如下。
1 材料与方法
1.1 实验动物 85只清洁级雄性SD大鼠,体重200 g~240 g,购自河北省实验动物中心提供,许可证号:SYXK(冀)2018-004。清洁环境分笼饲养(室温23 ℃~25 ℃、相对湿度50%~60%、光照黑暗12 h∶12 h)1周后开展实验。本实验经涿州市医院伦理委员会审查批准,伦理批件号[ZZYY(K)2020-013]。
1.2 药物与试剂 GB购自上海诗丹德生物技术有限公司(纯度≥95%,批号:201907);二甲双胍(Metformin,MET)购自齐鲁制药有限公司(批号:20200114);链尿佐菌素(Streptozotocin,STZ)购自美国Sigma公司(批号:S0130);谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活性、丙二醛(Malondialdehyde,MDA)试剂盒和HE、TUNEL染色试剂盒购自北京索莱宝科技有限公司(批号:BC1550、BC1560、BC0170、BC1170、BC0020、G1120、T2190);二喹啉甲酸(Quinolinic acid,BCA)检测试剂盒购自上海圆创生物科技有限公司(批号:1912027);Nrf2、HO-1、核因子-κB(Nuclear factor-κB,NF-κB)、β-肌动蛋白(β-actin)抗体和IgG二抗购自北京博奥森生物技术有限公司(批号:bs-1074R、bs-23397R、bs-20160R、bs-0061R、bs-0295G);3,3二氨基联苯胺(3,3-Diaminobenzidine,DAB)显色试剂盒购自武汉博士得生物工程有限公司(批号:20191124)。高糖高脂饲料配置:基础饲料67.5%、20%蔗糖、10%猪油、2.5%胆固醇。
1.3 模型制备与给药 随机取65只大鼠参照文献[7]报道制备T2DM大鼠模型:给予高脂高糖饮食4周后腹腔注射浓度1%的STZ溶液(45 mg/kg),造模成功判断标准:注射STZ 72 h后通过血糖仪(One Touch Ⅱ型,美国强生公司)检测空腹血糖(Fasting blood glucose,FBG)水平≥16.7 mmol/L。共造模成功62只大鼠(造模成功率95.38%),剔除FBG最高和最低各1只后,将剩余60只T2DM模型大鼠按血糖值分层随机分为模型组、GB组和MET组,各20只;取剩余20只大鼠设为正常对照组(常规饲料喂养)。GB组1次/d灌胃给予浓度0.5 mg/ml的GB溶液(10 ml/kg)[8],MET组1次/d灌胃给予浓度30 mg/ml的MET溶液(10 ml/kg)[9],正常对照组和模型组1次/d灌胃给予等体积(10 ml/kg)的0.9%氯化钠溶液,疗程8周。
1.4 FBG水平和血清ALT、AST水平检测 每组随机取10只大鼠,经尾静脉采空腹血,通过血糖仪(One Touch Ⅱ型,美国强生公司)检测各组大鼠FBG水平。腹腔注射10%水合氯醛(4 ml/kg)实施麻醉,经腹主动脉采血并3500 r/min离心(r=10 cm)5 min取血清,通过全自动生化分析仪(LX-20型,美国贝克曼库尔特有限公司)检测各组大鼠血清ALT、AST水平。
1.5 HE染色法行肝组织病理学检查与非酒精性肝脏损伤评分(NAS) 颈椎脱臼处死后取肝脏,于肝脏右叶相同部位取各只大鼠部分肝组织,置10%中性甲醛溶液中固定3 d,行石蜡包埋、石蜡切片机(RM2245型,德国Leica公司)切片(4 μm厚度)和梯度乙醇水化处理后,取部分切片行HE染色,通过光学显微镜(DS-5M-L1型,日本尼康仪器有限公司)观察肝组织病理学改变。
1.6 TUNEL法观察肝细胞凋亡状况并计算凋亡指数(AI) 取剩余肝脏组织切片行TUNEL染色后通过光学显微镜(DS-5M-L1型,日本尼康仪器有限公司)观察肝细胞凋亡状况(细胞核黄褐色为凋亡细胞),每张染色切片选取5个不重叠的视野计数细胞总数和凋亡细胞数,AI=(凋亡细胞数/细胞总数)×100%。
1.7 生化分析法检测肝组织SOD、GSH-Px活性和MDA含量 取每组剩余的10只大鼠,腹腔注射10%水合氯醛(4 ml/kg)麻醉后颈椎脱臼处死后,于肝脏右叶相同部位取各只大鼠部分肝组织,称重后按1∶8质量体积比加入4 ℃裂解液,研磨匀浆后4 ℃、3500 r/min离心(r=10 cm)10 min取上清液,采用黄嘌呤氧化法检测SOD活性,钼酸铵法检测CAT活性,硫代巴比妥酸法检测MDA含量。
1.8 Western blot法检测肝组织Nrf2、HO-1、NF-κB蛋白表达 于肝脏右叶相同部位取各只大鼠约100 g肝组织,加入适量4 ℃ RIPA裂解液、冰上静置15 min后,4 ℃、12000 r/min离心(r=10 cm)20 min取上清液,BCA法检测蛋白浓度后上样,通过电泳仪(DYCZ-40D型,北京六一仪器厂)十二烷基磺酸钠-聚丙烯酰凝胶电泳分离蛋白、通过转膜槽(DYCZ-24DN型,北京六一仪器厂)湿法转聚偏二氟乙烯(PVDF)膜、牛血清白蛋白(浓度5%)室温封闭1 h,滴加Nrf2(1∶1000)、HO-1(1∶1000)、NF-κB(1∶1000)、β-actin(1∶1500)一抗后4 ℃孵育过夜,TBST溶液洗涤3次,滴加IgG二抗(1∶3000)后室温孵育2 h,TBST溶液洗涤3次后滴加DAB显色,根据目的条带与β-actin(内参)条带灰度值比值进行半定量分析。
1.9 统计学方法 应用SPSS 15.0统计学软件进行分析。计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 GB对T2DM大鼠FBG水平的影响 见表1。模型组FBG水平较正常对照组明显升高(P<0.05);与模型组相比,GB组和MET组FBG水平明显降低(均P<0.05);GB组和MET组FBG水平比较,差异无统计学意义(均P>0.05)。
2.2 GB对T2DM大鼠血清ALT、AST水平的影响 见表1。模型组血清ALT、AST水平较正常对照组明显升高(均P<0.05);与模型组相比,GB组和MET组ALT、AST水平明显降低(均P<0.05);与MET组比,GB组ALT、AST水平明显降低(均P<0.05)。

表1 GB对T2DM大鼠FBG水平和血清ALT、AST水平的影响
2.3 GB对T2DM大鼠肝组织病变和NAS评分的影响 正常对照组大鼠肝组织结构和肝细胞形态均未见异常;模型组可见肝索结构模糊、假性肝小叶形成,散在肝细胞空泡样脂肪变性,炎性细胞浸润等病变;与模型组相比,GB组和MET组大鼠肝组织上述病变明显改善,并且GB组效果优于MET组(图1)。

A:正常对照组;B:模型组;C:GB组;D:MET组
2.4 GB对T2DM大鼠肝细胞凋亡的影响 见表2(图2)。正常对照组大鼠肝组织可见很少量的凋亡细胞;模型组凋亡细胞数量较正常对照组明显增多;与模型组相比,GB组和MET组肝细胞凋亡数量减少。模型组AI较正常对照组明显升高(P<0.05);与模型组相比,GB组和MET组AI明显降低(均P<0.05);与MET组相比,GB组AI明显升高(均P<0.05)。
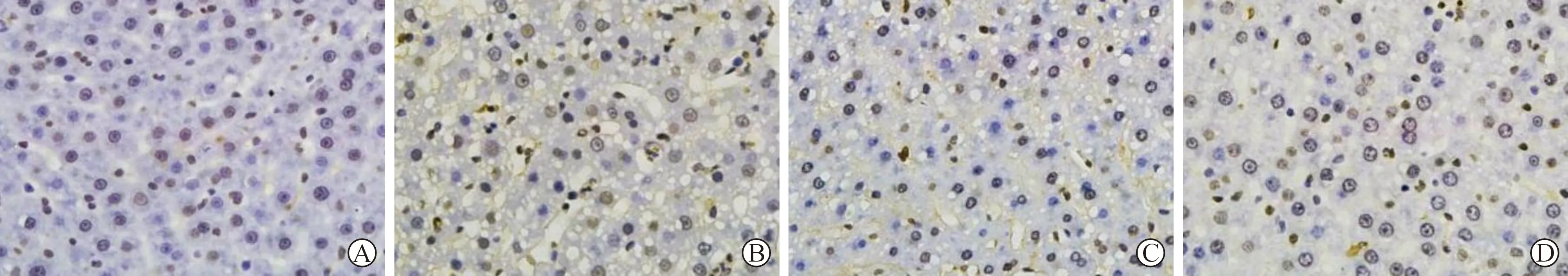
A:正常对照组;B:模型组;C:GB组;D:MET组
2.5 GB对T2DM大鼠肝组织SOD、GSH-Px活性和MDA含量的影响 见表3。模型组肝组织SOD、GSH-Px活性较正常对照组明显降低,MDA含量明显升高(P<0.05);与模型组相比,GB组和MET组SOD、GSH-Px活性明显升高,MDA含量明显降低(均P<0.05);与MET组相比,GB组SOD活性明显升高且MDA含量明显降低(均P<0.05),两组间GSH-Px活性比较差异无统计学意义(P>0.05)。

表3 GB对T2DM大鼠肝组织SOD、GSH-Px活性和MDA含量的影响
2.6 GB对T2DM大鼠肝组织Nrf2、HO-1、NF-κB蛋白表达的影响 见表4(图3)。

表4 GB对T2DM大鼠肝组织Nrf2、HO-1、NF-κB蛋白相对表达的影响

A:正常对照组;B:模型组;C:GB组;D:MET组
模型组肝组织Nrf2、HO-1表达较正常对照组明显下调,NF-κB表达明显上调(均P<0.05);与模型组相比,GB组和MET组Nrf2、HO-1表达明显上调且NF-κB明显下调(均P<0.05);与MET组相比,GB组Nrf2、HO-1表达明显上调且NF-κB明显下调(均P<0.05)。
3 讨 论
长期高血糖将导致多器官并发症,肝脏是糖脂代谢的主要场所,也是糖尿病最易累及的器官之一。有研究报道糖尿病性肝损伤并发率约占糖尿病患者的70%,具有发病隐匿、临床表现不典型的特点,糖尿病终末期肝病致死率高于其心血管并发症[10-11]。病理学研究发现,胰岛素分泌不足导致糖脂代谢紊乱,诱发氧自由基(Reactive oxygen species,ROS)大量生成,引发氧化应激损伤和细胞凋亡是糖尿病并发症发生发展的重要病理机制[12-13]。徐源等[14]和周少英等[15]研究发现通过药物干预抑制氧化应激和细胞凋亡对糖尿病大鼠肝脏具有保护作用。
糖尿病在中医属“消渴”范畴,其病机在于气阴两虚、脾肾阳虚、瘀血浊毒内停。银杏是中国独有的一种中生代孑遗植物,银杏果和银杏叶为我国传统中药品种。其中,银杏叶性平、味苦涩,具有活血化瘀、通络止痛、化浊降脂之功效。GB为银杏叶的主要活性成分,化学结构属于萜类内酯化合物,现代药理学研究发现,GB具有抑制血小板活化、抗氧化、抗凋亡等生物学活性。MET能够提高胰岛素敏感性、抑制肝糖原异生、抑制肠壁细胞摄取葡萄糖,是糖尿病治疗一线用药,并且对糖尿病所致肝损伤具有良好的治疗效果[16];此外,白福瑞[17]研究发现MET对中医痰湿体质和阴虚体质的糖尿病均效果显著。本实验结果显示,给予GB治疗能够明显降低T2DM大鼠FBG水平和血清ALT、AST水平,明显改善肝细胞气球样变、脂肪性病变、炎性细胞浸润等病理学改变和细胞凋亡状况,降低AI;并且GB组上述作用优于MET组,提示GB对T2DM大鼠肝脏具有保护作用。
持续高血糖导致ROS大量生成与释放,使以ROS为底物的抗氧化酶SOD、GSH-Px被过度消耗、ROS不能完全还原清除,过剩的ROS破坏生物膜、蛋白质等生成有毒性的MDA,所以SOD、GSH-Px活性和MDA含量能够间接反映机体氧化应激水平[18]。本实验结果显示,给予GB治疗能够明显提高T2DM大鼠肝组织SOD、GSH-Px活性并降低MDA含量,并且GB组对SOD活性和MDA含量的调节作用优于MET组,提示GB对T2DM大鼠肝组织氧化应激损伤具有抑制作用。
生理状态下,Nrf2与特异性抑制剂Keap1结合而无活性,ROS则能够破坏“Nrf2-Keap1”结合体使Nrf2游离,Nrf2核转位而诱导SOD、GSH-Px等转录与表达[19]。HO-1为Nrf2下游基因,能够催化降解血红素、CO等而抑制氧化应激反应[20-21]。NF-κB能够诱导半胱氨酸天冬氨酸蛋白酶-3表达与活化而促进细胞凋亡,而HO-1对NF-κB表达与活化具有抑制作用[22-23]。本实验结果显示,给予GB治疗能够明显上调T2DM大鼠肝组织Nrf2、HO-1表达并下调NF-κB表达,并且GB组对Nrf2、HO-1、NF-κB表达的调节作用优于MET组,这可能是GB抑制T2DM大鼠肝组织氧化应激损伤的重要分子机制。
综上所述,GB对糖尿病大鼠肝脏具有保护作用,可能与激活Nrf2/HO-1信号通路进而抑制氧化应激有关。
