双水相体系分离纯化紫甘薯花色苷
2021-08-19张军兵罗忠国罗舜菁刘成梅
方 舟,张军兵,罗忠国,熊 勇,*,罗舜菁,刘成梅
1.南昌大学 食品学院 (南昌 330000)2.江西丹霞生物股份有限公司 (鹰潭 335000)
紫甘薯色素是从紫甘薯的块根中提取精制而成的一种花色苷类色素,其中主要的花色苷配基为矢车菊色素和芍药色素,且以单酰基化和双酰基化的花色苷为主[1]。与其它花色苷类色素相比,紫甘薯色素具有酰化基团,从而具有较好的耐热性和耐光性[2]。同时,其对光、热、酸和碱等的敏感度要比一般无酰基化的花色苷小,因而性质更加稳定[3]。花色苷具有极强的抗氧化活性,可以作为自由基清除剂[1],除此之外,花色苷还具有抗癌[4]、抗炎[5]等多种功能。
影响紫甘薯花色苷纯度的主要是淀粉及其他糖类杂质,目前对花色苷进行分离纯化的方法有大孔树脂法[6]、膜分离法[7-8]、色谱法[9]等,这些方法存在时间长、易污染或成本高等问题。双水相技术作为一种新型的分离技术,与传统的分离方法相比,具有条件温和、产品活性损失小、步骤简单及分离效果好等优点[10],国外已经广泛应用于蛋白质的纯化及抗生素的提取,近年来逐渐应用于天然色素的分离纯化研究。紫甘薯花色苷的高效分离纯化是进行其功能性研究和对其进行应用的基础。本研究利用双水相技术对紫甘薯花色苷进行分离纯化并对其工艺条件进行优化,为紫甘薯色素的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫甘薯浓缩液(花色苷含量为2.229 3 mg/mL,糖含量为409.793 8 mg/mL),由江西丹霞生物科技有限公司提供;葡萄糖标准品,上海源叶生物科技有限公司;硫酸铵、磷酸二氢钠、氯化钾、乙酸钠、磷酸氢二钠、柠檬酸、苯酚、硫酸、盐酸,均为国产分析纯;无水乙醇,分析纯,西陇科学股份有限公司。
1.2 主要仪器与设备
UV-1800型紫外-可见分光光度仪,北京普析通用公司;超纯水机,青岛富勒姆科技有限公司;旋涡搅拌器(mini G),艾卡(广州)仪器设备有限公司。
1.3 单因素实验
1.3.1不同盐种类和浓度对紫甘薯花色苷分离纯化的影响
分别向50 mL离心管中添加4.8 g、5.4 g、6.0 g、6.6 g和7.2 g的硫酸铵[(NH4)2SO4]和磷酸二氢钠(NaH2PO4),各管中加入无水乙醇7.5 g,紫甘薯浓缩液1 mL,以蒸馏水补足总质量为30 g,此时各管中的盐浓度分别为16%、18%、20%、22%、24%,研究不同盐浓度对紫甘薯花色苷分离纯化的影响。
1.3.2不同乙醇浓度对紫甘薯花色苷分离纯化的影响
分别向50 mL离心管中添加7.5 g、9.0 g、10.5 g、12 g和13.5 g的无水乙醇,各管中加入盐6.0 g,紫甘薯浓缩液1 mL,以蒸馏水补足总质量为30 g,此时各管中的乙醇浓度分别为25%、30%、35%、40%、45%,研究不同乙醇浓度对紫甘薯花色苷分离纯化的影响。
1.3.3不同浓缩液添加量对紫甘薯花色苷分离纯化的影响
分别向50 mL离心管中添加0.4 mL、0.6 mL、0.8 mL、1.0 mL、和1.2 mL 的紫甘薯浓缩液,各管中加入盐6.0 g,无水乙醇7.5 g,以蒸馏水补足总质量为30 g,研究不同浓缩液添加量对紫甘薯花色苷分离纯化的影响
1.4 正交实验
在单因素实验基础上,选择盐浓度、乙醇浓度和浓缩液添加量为考察因素,以花色苷回收率和糖残留率作为考察指标,设计L9(33)正交实验。花色苷回收率表明在经过双水相体系处理后花色苷能够保留的比例;由于在紫甘薯浓缩液中的主要杂质为糖类,糖残留率则表明双水相体系对于紫甘薯花色苷的纯化能力。
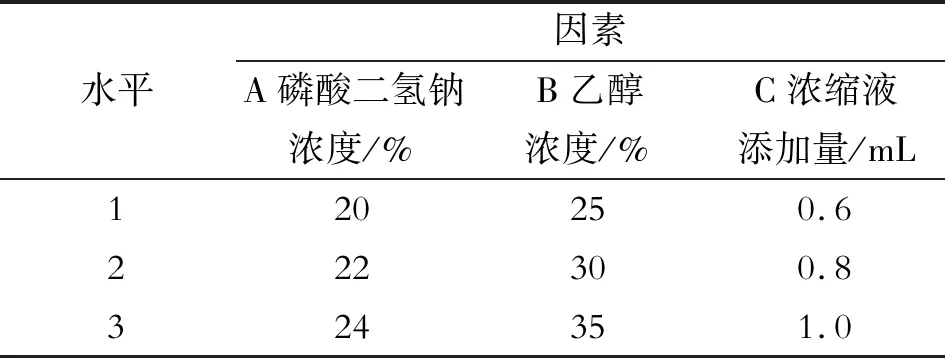
表1 L9(33)正交因素实验表
1.5 测定方法
1.5.1花色苷的测定
根据食品安全国家标准GB 1886.244—2016的方法对花色苷进行测定,以矢车菊-3-葡萄糖苷计。花色苷的含量计算如下:
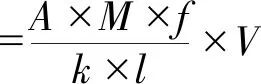
式中:A为(A520 nm-A700 nm)pH 1.0-(A520 nm-A700 nm)pH 4.5;M为矢车菊-3-葡萄糖苷的摩尔质量(M=449.2 g/mol),g/mol;f为样品的稀释倍数;k为矢车菊-3-葡萄糖苷的摩尔消光系数(ε=26 900),L/(mol·cm);l为光路长,cm;V为样品体积,mL。
花色苷回收率计算如下:

式中:W花为花色苷回收率;A上花为双水相体系中上相的花色苷总量;A总花为加入双水相体系中的花色苷总量。
1.5.2糖类的测定
准确称取标准葡萄糖25 mg于250 mL容量瓶中,定容,分别吸取1.0、2.0、3.0、4.0、5.0、6.0 mL葡萄糖溶液以蒸馏水补至10.0 mL,配制成0.01、0.02、0.03、0.04、0.05、0.06 mg/mL的葡萄糖溶液,各取1.0 mL置于比色管中,分别加入6%苯酚1.0 mL及浓硫酸5.0 mL摇匀,室温反应30 min以后于490 nm测吸光度,以1.0 mL水按同样显色操作为空白,横坐标为吸光度,纵坐标为多糖毫克数,绘制标准曲线。得标曲为y=0.132 5x,R2=0.998 7。
对样品进行适当稀释后以上述方法进行显色操作后以标准曲线计算多糖含量。
糖残留率的计算如下:
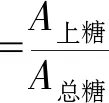
式中:W糖为糖残留率;A上糖为双水相体系中上相的糖类总量;A总糖为加入双水相体系中的紫甘薯浓缩液所含的糖类总量。
2 结果与讨论
2.1 单因素实验
2.1.1不同盐种类和浓度对紫甘薯花色苷分离纯化的影响
如图1所示,随着盐浓度的上升,花色苷的回收率呈上升趋势,而糖残留率则呈下降趋势,因此盐浓度的增加对于双水相体系分离纯化紫甘薯花色苷是有着显著作用的。可以看到在降低糖残留率方面,硫酸铵的效果更显著,但是对于花色苷的回收来说,磷酸二氢钠的效果更好。因此在接下来的实验中,选择磷酸二氢钠作为成相盐。
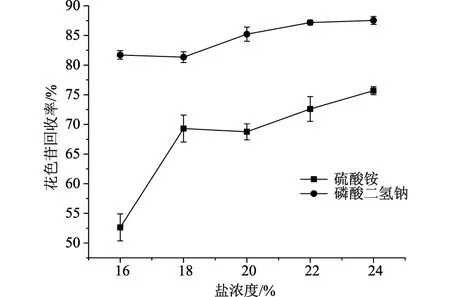
图1 盐的种类及浓度对花色苷回收率的影响
虽然盐的浓度增加,有利紫甘薯色素的分离纯化,但是在一定条件下盐的饱和浓度为其浓度极限,盐浓度增加,盐在上相的残留率同时增加,因此盐的浓度并非越高越好。当盐的浓度达到22%时,对于花色苷的回收率及糖残留率的变化较小,因此选择盐浓度为22%。
2.1.2不同乙醇浓度对紫甘薯花色苷分离纯化的影响
如图2所示,随着乙醇浓度的增加,花色苷的回收率增加,但糖残留率也同时增加,当乙醇浓度达到40%时,盐溶液达到饱和,开始有盐析出,当乙醇浓度达到45%时,盐进一步析出,导致无法成相。由于过高或过低的乙醇浓度会影响双水相体系的形成,且对糖残留率也有明显影响。因此选择乙醇浓度为25%。

图2 盐的种类及浓度对糖去除率的影响
2.1.3不同浓缩液添加量对紫甘薯花色苷分离纯化的影响
如图3所示,可以看到随着浓缩液添加量的增加,花色苷的回收率由接近100%下降至75.97%,糖残留率也同样随着浓缩液的变化而逐渐减少。浓缩液的添加量对于花色苷的回收率和糖残留率有着较大的影响,综合考虑花色苷回收率及糖残留率,选择浓缩液的添加量为0.8 mL。
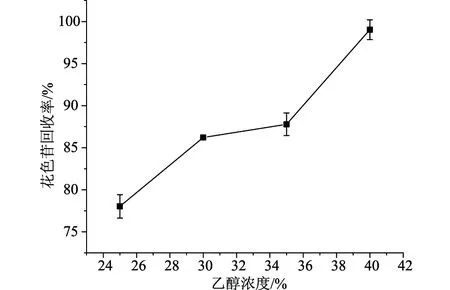
图3 乙醇浓度对花色苷回收率的影响
2.2 正交实验结果
如表2所示,分别以花色苷回收率和糖残留率为考察指标,由极差r可以看出对花色苷回收率来说三个因素的影响大小依次为浓缩液添加量、磷酸二氢钠浓度、乙醇浓度,最优工艺为A1B1C1,即磷酸二氢钠浓度为20%,乙醇浓度为25%,浓缩液添加量为0.6 mL,此时花色苷回收率为99.63%,糖残留率为55.78%;而由极差R则可以看出对糖残留率来说三个因素的影响大小依次为磷酸二氢钠浓度,乙醇浓度,浓缩液添加量,最优工艺为A2B2C1,即磷酸二氢钠浓度为22%,乙醇浓度为30%,浓缩液添加量为0.6 mL,此时花色苷回收率为99.31%,糖残留率为42.51%。
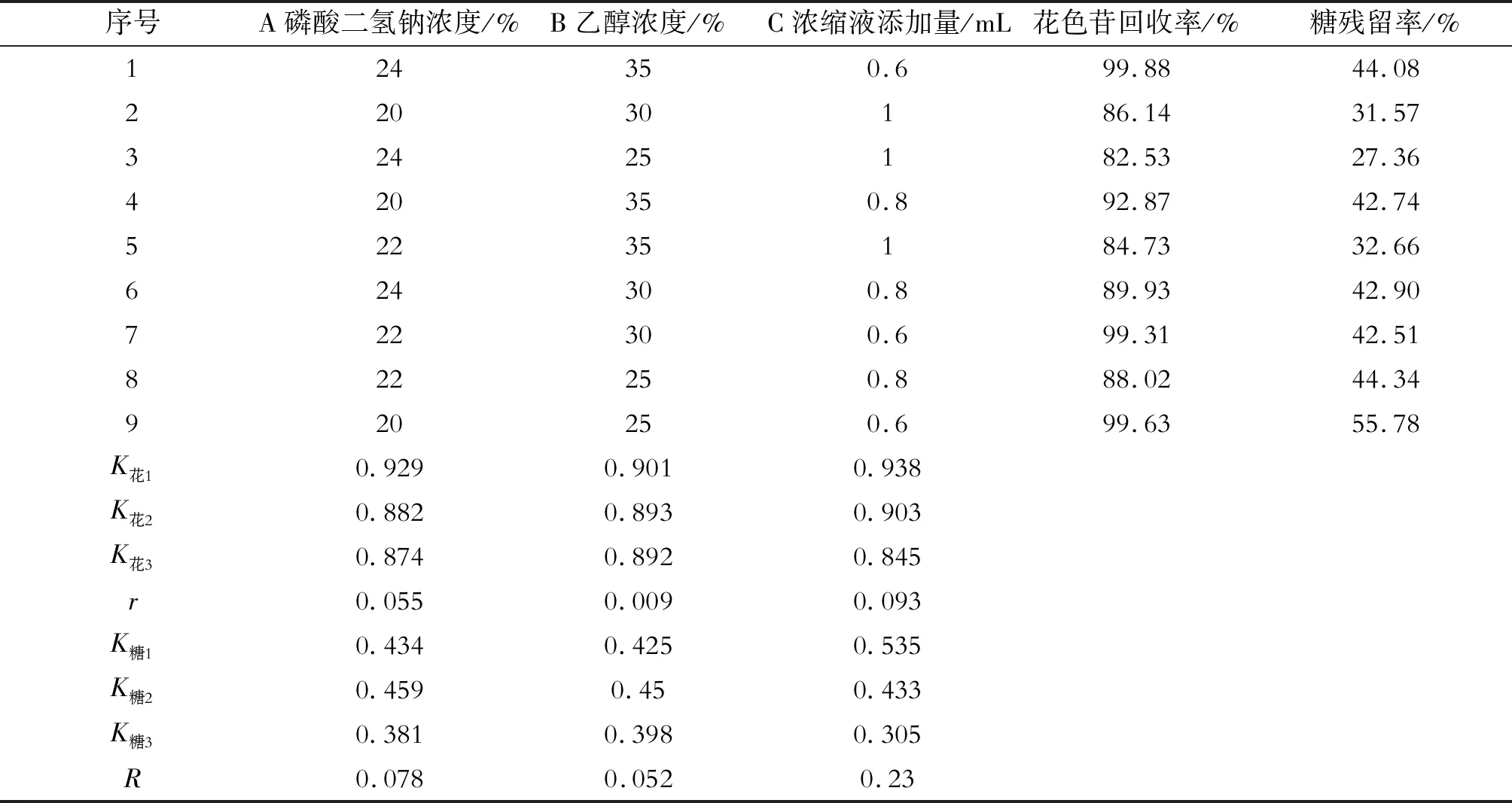
表2 双水相体系分离纯化紫甘薯花色苷的正交因素实验结果
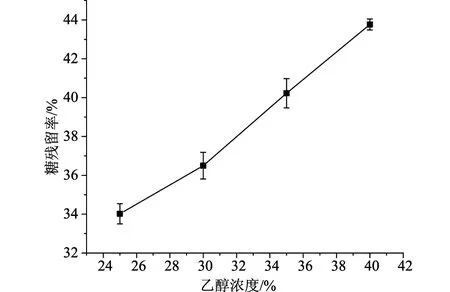
图4 乙醇浓度对糖残留率的影响
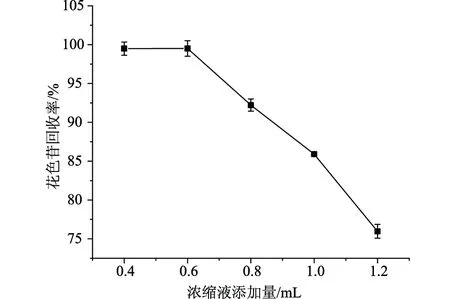
图5 浓缩液添加量对花色苷回收率的影响
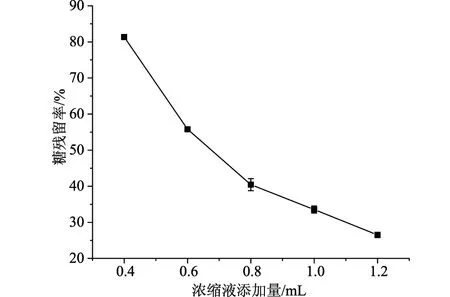
图6 浓缩液添加量对糖回收率的影响
两组工艺的花色苷回收率分别为99.63%和99.31%,相差不大,但糖残留率则分别为55.78%和42.51%,有明显差别。考虑到对紫甘薯花色苷进行分离纯化的目的,因此综合考虑选取的最佳工艺为为A2B2C1,即磷酸二氢钠浓度为22%,乙醇浓度为30%,浓缩液添加量为0.6 mL,此时花色苷回收率为99.31%,糖残留率为42.51%。
3 结论
采用磷酸二氢钠/乙醇双水相体系分离纯化紫甘薯花色苷。经正交实验并综合考虑糖残留率和花色苷回收率,选取的最佳工艺为为磷酸二氢钠浓度为22%,乙醇浓度为30%,浓缩液添加量为0.6 mL,此时花色苷回收率为99.31%。显然,磷酸二氢钠/乙醇双水相体系对紫甘薯花色苷有良好的选择性并能有效去除糖类杂质。通过对双水相体系分离纯化紫甘薯花色苷的研究,优化了其工艺,为紫甘薯花色苷的产业化及开发利用提供理论依据。
