枸杞根系内生真菌的染色方法
2021-08-19陈思杰李金杜娟贾宝森顾沛雯
陈思杰,李金,杜娟,贾宝森,顾沛雯
(宁夏大学 农学院,宁夏 银川 750021)
枸杞Lyciumbarbarum是茄科中唯一一属盐生植物,有悠久的栽培历史,是国家卫生部批准的药食同源的中药材之一,其果实枸杞子具有提高免疫、防衰老、抗氧化等多种功能[1].枸杞是宁夏的一张“红色名片”,宁夏枸杞是唯一载入中国药典的枸杞品种.明代药学家李时珍在《本草纲目》中,将枸杞列为本经上品,称“全国入药杞子,皆宁产也”.宁夏枸杞因其特殊的地理位置,药用价值高于其他产地枸杞[2].但多年来因耕地面积限制,连作不可避免,进而引发连作障碍,土传病害较为严重,尤其是枸杞根腐病发生较重,造成枸杞品质下降,产量降低,严重时全株枯死,成为宁夏枸杞产业可持续发展的瓶颈问题之一.
植物内生真菌具有丰富的生物多样性,分布在植物根、茎、叶等部位.现已有研究表明,根系内生菌与植物共生后能改变根系分泌物的组分进而改善土壤微生物群落,有助于缓解连作障碍[3],同时能促进植物生长,提高植物的抗病能力[4].丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)和深色有隔内生真菌(dark seprate endophytes,DSE)均是植物根际广泛分布的一类内生真菌.AMF属球囊霉门真菌,能够与80%以上陆生高等植物根系形成菌根共生关系[5],这种共生关系通过提高宿主植物养分吸收和促进碳循环的方式改善宿主植物的生长[6],同时保护宿主植物免受各种土传植物病原真菌、细菌和线虫的侵害.DSE广泛定殖于植物根的表皮、皮层甚至维管束组织的细胞内或细胞间隙,形成深色、具横膈的菌丝和脑状、叶状、链状等形状各异的微菌核结构[7].自然条件下,DSE与AMF能共同在植物根系侵染定殖,具有促进植物生长,提高植物抗病性等功能[8],在生态系统中发挥重要作用.
根系内生真菌的定殖主要通过染色法观察.早在1970年,Phillips和Hayman[9]利用台盼蓝染色法研究菌根真菌定殖和侵入率测定.Muthukumar等[10]利用0.5 g/L台盼蓝染色法观察5种不同植被类型的46科147种植物根系DSE和AMF的定殖,结果显示74种植物根系被DSE和AMF共同侵染,并能清楚观察到AMF和DSE的典型结构.王文彬等[11]利用酸性品红染色法观察西北荒漠油蒿根系,可见清晰的胞间菌丝和泡囊.唐燕等[12]用苯胺蓝染色液对腋花杜鹃的根系进行染色,能清楚观察到AMF和DSE的侵入,并能观察到AMF菌丝、泡囊和DSE菌丝,但目前有关枸杞根系内生真菌的定殖研究报道较少.本研究团队前期用酸性品红染色法观察了不同品种枸杞根系DSE侵染状况,能清楚观察到DSE的结构[13],但利用该染色方法观测枸杞根系AMF的定殖时,染色效果较差,背景很深.这是由于取自田间的枸杞根样多为多年生枸杞的主根及二级根,根系老化,呈棕褐色,没有经过脱色的根内菌丝和泡囊结构虽然着色,但背景颜色较深,故菌丝和泡囊结构与背景颜色反差不大.本文针对枸杞根系老化、颜色较深的特点,探讨理想的染色方法,为研究不同土壤类型的枸杞根系内生真菌侵染定殖及生物学功能奠定基础.
1 材料与方法
1.1 植物材料和试剂
1.1.1 植物材料
枸杞根系采自宁夏森淼枸杞园.随机选取长势好的植株,去除落叶浅层土后,在距植株主干0~30 cm内挖土壤刨面,采集根样.选择健康枸杞的根系作为实验材料,清水冲洗后,选取直径小于2 mm的须根置于FAA固定液(福尔马林、冰醋酸、体积分数70%的酒精体积比为18∶1∶1)中,4 ℃保存.
1.1.2 染色剂
1)酸性品红:0.05 g酸性品红+20 mL甘油+60 mL乳酸+20mL蒸馏水;2)苯胺蓝:0.5 g苯胺蓝+100 mL无水乙醇;3)苏丹红Ⅳ:0.1 g苏丹红Ⅳ +10 mL 体积分数95%的酒精+10 mL甘油;4)台盼蓝:0.05 g台盼蓝+20 mL甘油+60 mL乳酸+20 mL蒸馏水);5)醋酸墨水:5 mL Quink牌墨水(上海派克笔有限公司)+ 95 mL 体积分数5%的冰醋酸.
1.1.3 其他试剂
100 g/L KOH,碱性H2O2,乳酸和甘油等.
1.2 研究方法
将保存于FAA固定液中的枸杞根系取出,流水冲去FAA固定液.将枸杞根系剪成1 cm的根段,置于6个离心管中,每个离心管40个根段,各加入100 g/L KOH完全浸泡根样,90 ℃水浴90 min后倒去KOH溶液,自来水冲洗3次并控干水分.加入质量分数30%的H2O2漂白5 min,同时软化根系.脱色结束自来水冲洗并控干水分.加乳酸于室温下酸化5 min,倒去乳酸.分别加入5种不同的染色液(①酸性品红;②苯胺蓝;③苏丹红Ⅳ;④台盼蓝;⑤醋酸墨水)于室温染色3~5 min后,倒去染色液,染色液⑤染色后的根样在清水中浸泡,染色液①~⑤染色后的根段浸泡在乳酸甘油(乳酸、甘油体积比为1∶1)中,室温下过夜脱色.随机取25个根段,平行放置于载玻片上,盖上盖玻片,适当轻压,观察并统计AMF和DSE的定殖率.
定殖率=受侵染的根段数/总镜检的根段数×100%.
2 结果与分析
2.1 酸性品红染色
酸性品红能将根系内AMF菌丝和泡囊染上色(图1a-b),同时能观察到DSE菌丝(图1c),但是背景褪色不明显,导致根皮层细胞也被染上与菌丝、泡囊相近的颜色,染色清晰度不高,且毒性较大,不利于长期使用.

a.AMF菌丝;b.AMF菌丝和泡囊;c.DSE菌丝.图1 枸杞根系内生真菌酸性品红染色Fig.1 Endophytic fungi in Lycium barbarum roots dyed with acid fuchsin
2.2 苯胺蓝染色
苯胺蓝染色后的背景为深蓝色,和AMF菌丝(图2a)、泡囊(图2b-c)颜色相近,几乎无法区分,根系内的杂质也多被染成蓝色,不利于实验的观察.能观察到DSE胞间菌丝(图2d),而且苯胺蓝为致癌疑似物,对身体的伤害较大,不利于长期使用.

a.AMF菌丝;b-c.AMF泡囊;d.DSE菌丝.图2 枸杞根系内生真菌苯胺蓝染色Fig.2 Endophytic fungi in Lycium barbarum roots dyed with aniline blue
2.3 苏丹红Ⅳ染色
用苏丹红Ⅳ染色操作简单,AMF菌丝着色淡(图3a),但可清晰观察到深红色的AMF不规则形泡囊(图3b)和根内孢子(图3c).由于褪色干净,可观察到DSE浅褐色有隔菌丝(图3d)和带状微菌核(图3e),但苏丹红Ⅳ有疑似致癌作用,也不利于长期使用.
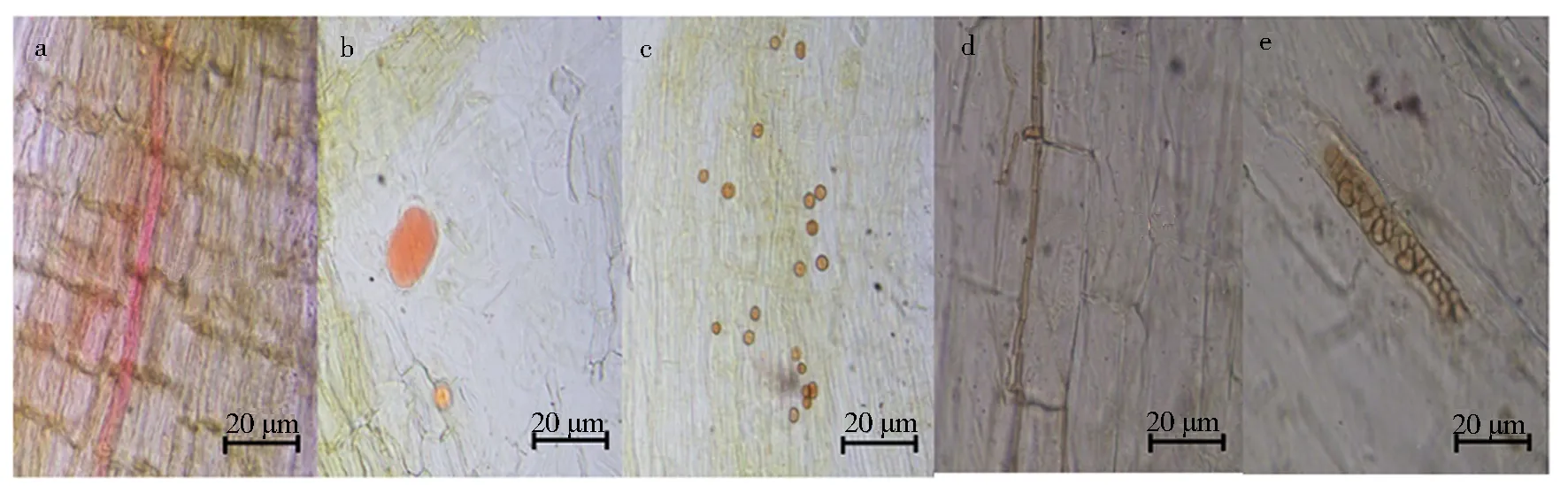
a.AMF菌丝;b.AMF泡囊;c.AMF根内孢子;d.DSE菌丝;e.DSE微菌核.图3 枸杞根系内生真菌苏丹红Ⅳ染色Fig.3 Endophytic fungi in Lycium barbarum roots dyed with Sudan Ⅳ
2.4 台盼蓝染色
经台盼蓝染色后,枸杞根内AMF菌丝和泡囊着深蓝色(图4a-e).AMF泡囊外轮廓清晰,可见其内含物(图4e)及AMF根内孢子(图4f).但是由于根皮层组织也染上了相近的颜色,与背景反差较小,可观察到DSE典型结构菌丝(图4g-h)和微菌核(图4i).但台盼蓝为致癌疑似物,对身体的伤害较大,不利于长期使用.
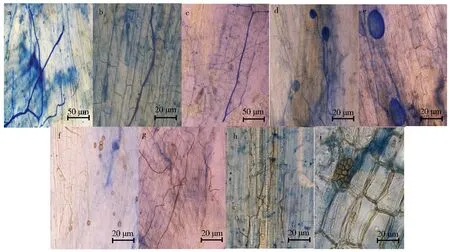
a-c.AMF菌丝;d.AMF菌丝和泡囊;e.AMF泡囊;f.AMF根内孢子;g-h.DSE菌丝;i.DSE微菌核.图4 枸杞根系内生真菌台盼蓝染色Fig.4 Endophytic fungi in Lycium barbarum roots dyed with trypan blue
2.5 醋酸墨水染色(Quink牌墨水)
从图5可知,醋酸墨水对AMF菌丝和泡囊的着色都很好,染色效果良好,在低倍镜下就能清晰地观察到AMF、DSE能在枸杞根系定殖,并发育形成泡囊和微菌核等典型结构.同时,醋酸墨水染色方法操作简便,成本低且无毒,染色效果非常好.但是不同的脱色处理之间也存在差异.用2种不同的脱色剂进行脱色效果比较,发现清水脱色后背景几乎完全褪色,AMF结构染色效果与背景反差大,AMF泡囊处可见较清晰的AMF菌丝,可见DSE菌丝(图5a-e).而用乳酸甘油脱色后观察到的菌丝等结构虽然脱色效果也较好(图5f-j),但是相对于清水脱色的背景仍显不足,可见醋酸墨水染色,清水脱色的方法更适用于枸杞根系内生真菌的染色观察.此外,利用醋酸墨水染色法还观察到DSE菌丝形成前期的丝核菌菌丝(图5j),未见AMF根内孢子.
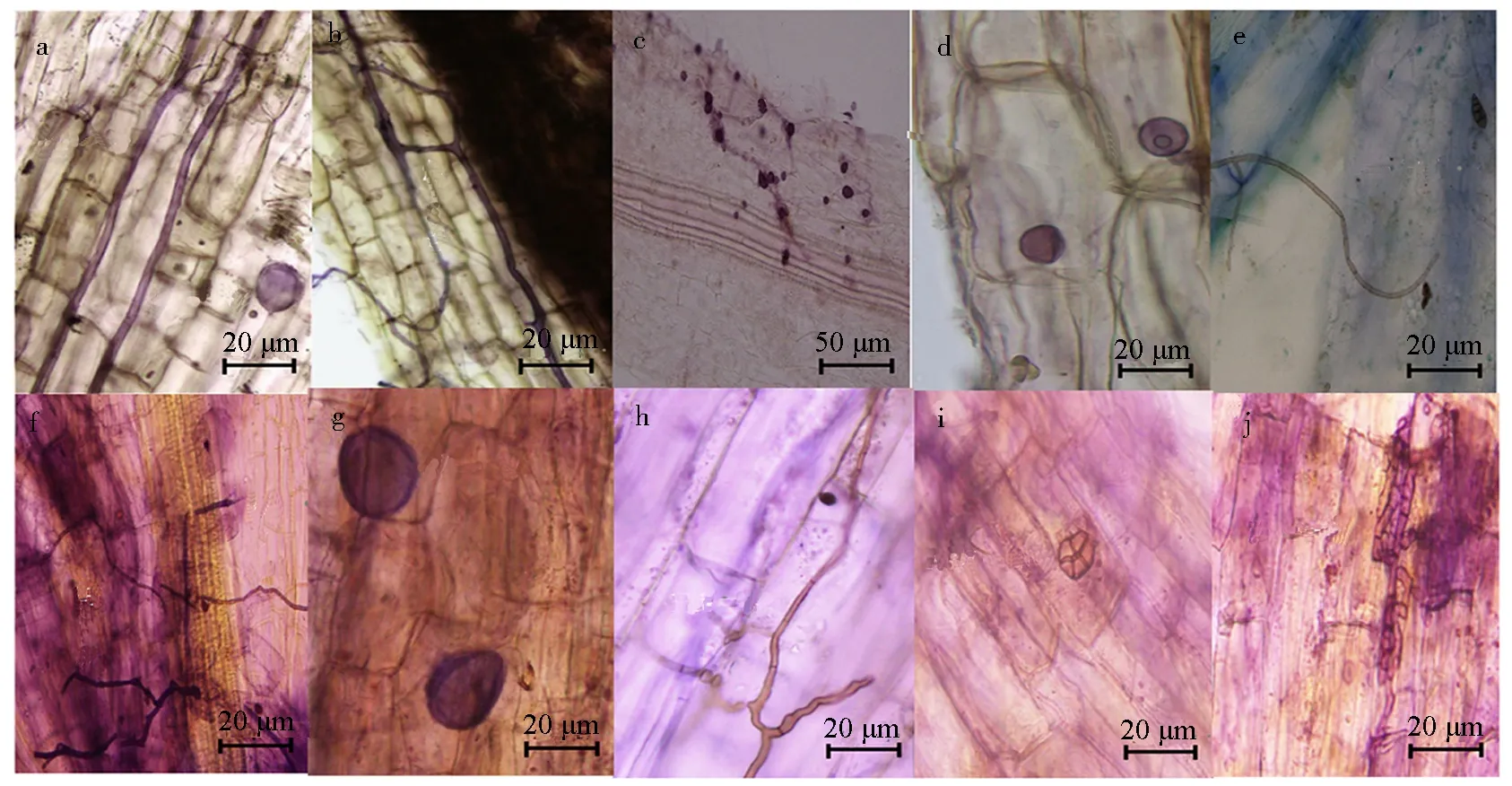
a.AMF菌丝和泡囊;b.AMF菌丝圈;c-d.AMF泡囊;e.DSE菌丝;f.AMF菌丝和DSE菌丝;g.AMF泡囊;h.DSE菌丝;i.DSE微菌核;j.DSE菌丝形成前期.图5 枸杞根系内生真菌醋酸墨水染色Fig.5 Endophytic fungi in Lycium barbarum roots dyed with vinegar and ink
2.6 不同染色方法对枸杞根系内生真菌侵染定殖率的影响
使用5种染色方法对DSE、AMF定殖率进行统计,结果见表1.因不同染色方法对内生真菌结构呈现的清晰度和反差效果存在较大差异,相同样品得到的AMF和DSE定殖率明显不同,其中用台盼蓝和醋酸墨水染色,AMF和DSE的定殖率没有较大差异,其他染色方法获得的定殖率普遍偏低.

表1 不同染色方法对枸杞AMF和DSE定殖率的影响Tab.1 Effects of different dyeing methods on colonization rate of AMF and DSE in Lycium barbarum
3 讨论
内生真菌定殖结构观察及侵染率测定主要采用染色镜检法,通常需要根系透明、染色和脱色3个步骤,其中最重要的是染色.目前对于根系内生菌的染色可以采用台盼蓝、酸性品红、墨水等多种染色剂[14].不同染色剂处理植物根系染色效果存在较大的差别,根系内生真菌染色效果直接影响分析其侵染定殖的准确性,因此找到稳定可靠、反差大、安全无毒的染色方法非常必要.
在光学显微镜下,观察5种染色剂对枸杞根系内生真菌结构的染色效果.不同染色剂对内生真菌结构染色的清晰度、反差效果等方面存在较大差别.经酸性品红染色后,菌丝和泡囊着色较浅,DSE浅褐色菌丝可见,但根内的皮层细胞也同样着色,因此与背景的反差小.而高秀兵等[15]采用此染色法观察茶树根系,可清楚观察到菌丝、泡囊、丛枝等AMF结构,推测可能是染色剂对不同植物着色效果不同.用苯胺蓝染色时,AMF菌丝、泡囊着深蓝色,可见DSE褐色菌丝,但部分杂质被染上较深的颜色,较难准确辨别;经苏丹红Ⅳ染色乳酸甘油脱色后背景褪色干净,可观察到AMF和DSE结构,但AMF菌丝颜色浅,这与覃晓娟[16]等报道的结果一致.用台盼蓝和墨水2种染液染色后,不仅AMF菌丝和泡囊染色效果较好,而且可观察到DSE典型结构.本研究采用2种墨水,醋酸鸵鸟牌墨水对AMF菌丝、泡囊着色很差,背景褪色不干净,而醋酸Quink牌墨水对AMF菌丝、泡囊着深蓝色,背景与目标反差大,适合AMF的染色观察.此外,Vierheilig[17]指出,当采用醋酸墨水和台盼蓝对不同植物根系进行染色,侵染定殖率结果并没有明显差异,这与本研究结果一致.然而,台盼蓝被国际癌症研究机构列为可能的致癌物,Quink牌墨水使用食用色素亮黑和坚牢黄2种染料,安全无毒[18].因此,通过对比可知,采用醋酸Quink牌墨水染色、清水脱色的枸杞根系根内AMF菌丝等结构着色深,脱色后背景褪色干净,AMF与背景反差大,DSE菌丝等结构也能被呈现,既可以兼顾染色效果又安全无毒,更适合枸杞根系内生真菌的侵染定殖观察.
4 结论
醋酸Quink牌墨水和台盼蓝的染色效果最佳,根系皮层细胞内AMF的菌丝、泡囊和DSE菌丝、微菌核等结构清晰可见,能准确分辨出AMF、DSE和其他真菌.但综合考虑操作难易程度和安全性,醋酸Quink牌墨水因操作简单、安全无毒、染色效果好,更适用于枸杞根系内生真菌的染色和制片观察.
