结晶紫高效脱色菌株的筛选、鉴定与脱色特性
2015-10-20都林娜等

摘要:结晶紫是一类难以降解且对许多生物都具有致癌致畸性的三苯甲烷类染料,筛选能够高效脱色结晶紫的菌株对修复受污染水体具有重要意义。从浙江温州分离筛选到1株结晶紫高效降解菌株CV-b,系统地研究了各操作因素对该菌株脱色结晶紫的影响。经16S rRNA基因序列分析表明,该菌株属于肠杆菌属(Enterabacter sp.)。当pH值在3.0~10.0之间时,培养24 h以后,该菌株对50 mg/L结晶紫的脱色率均在50%以上;脱色的最适温度范围为 25~35 ℃;多数供试碳源对脱色有显著促进效应,而多数供试氮源则对脱色无显著影响;供试金属离子中,Cu2+、Fe3+和Zn2+对脱色有显著的促进效应。动力学试验结果表明,该菌株对结晶紫的脱色与对数模型拟合度较高(r2=0.942 7)。经脱色前后的全波长扫描分析显示,菌株CV-b对结晶紫的脱色是由生物降解引起的。总体而言,菌株CV-b在结晶紫脱色中的实际应用潜能较大。
关键词:肠杆菌属(Enterabacter sp.);结晶紫;脱色特性;动力学
中图分类号: X703;Q939.9文献标志码: A文章编号:1002-1302(2015)09-0378-03
工业废水中的污染物种类繁多,其中合成染料对环境的影响极为恶劣,废水中的染料泄漏至环境水体中,导致被污染水体色度增大,进而影响水生动植物的生态平衡。而且,多数合成染料对动物和水生生物的毒害性较大,加之分子结构中多含有稳定性极强的苯环,导致其极难在环境中自然降解[1-2]。如何从废水中移除合成染料已经成为科研工作者亟待解决的一个难题。在众多不同种类的合成染料中,三苯甲烷类染料是印染行业中应用最为广泛的一类染料,约占所有合成染料的30%~40%[3-4]。结晶紫(crystal violet,CV)是一类典型的三苯甲烷类染料,广泛应用于印染、生物和医学等各个领域。然而由于结晶紫的分子结构稳定,极难被微生物降解,导致其在环境水体中长时间存在,进而危害水生生物[5]。许多研究者尝试用不同的处理方法移除废水中的结晶紫染料,例如化学氧化还原法、物理沉淀或絮凝、光催化氧化、吸附、电化学处理、反渗透技术和生物降解等[5]。其中,生物降解作为一种环境友好型且高效低耗的处理手段而越来越受到广泛的关注[6-7]。而国内外关于细菌降解结晶紫染料的研究报道较为少见。本研究从浙江温州水头皮革废水重污染区域筛选到1株结晶紫高效降解菌株,在此基础上,本研究旨在初步鉴定菌株CV-b,并采用单因素试验研究该菌株对结晶紫的脱色特性以及脱色动力学。
1材料与方法
1.1试验材料
1.1.1菌种来源供试土样取自浙江温州水头,菌株CV-b来源于皮革废水底泥中。
1.1.2试剂结晶紫,购自国药集团化学试剂有限公司;革兰氏染色液;TE缓冲液;Tris饱和酚(pH值8.0);氯仿;10×PCR缓冲液、DNA 连接酶、dNTPs和Taq DNA 聚合酶(TaKaRa 公司);DNA 纯化试剂盒(上海生工生物工程有限公司)等。其他生化试剂均为国产分析纯。
1.1.3培养基无机盐培养基(MSM,pH值7.0):15.13 g/L Na2HPO4,3.0 g/L KH2PO4,0.5 g/L NaCl,1.0 g/L NH4Cl,0.491 g/L MgSO4·7H2O,0.026 g/L CaCl2·2H2O。LB培养基pH值(7.0~7.2):10 g/L蛋白胨,5 g/L酵母粉,10 g/L NaCl。纯化培养基:在MSM培养基中添加终浓度为100 mg/L的CV染料。用于动力学研究的培养基(pH值6.2):1.0 g/L木糖,1.0 g/L谷氨酸,0.5 mmol/L ZnCl2,50 mg/L CV。
1.2试验仪器
超净工作台;电热恒温鼓风干燥箱;高压蒸汽灭菌锅;全温恒温摇床;电子天平;pH计;高速冷冻离心机;Evolution 300紫外可见光分光光度计;Bio-rad PCR仪;自动凝胶图像分析仪及水平电泳仪等。
1.3试验方法
1.3.1CV高效降解菌株的富集、分离和纯化方法将10 g土样置于100 mL无菌水中,在转速为150 r/min的摇床中振荡30 min后取出,待土水分离后,取10 mL上层悬液接入已灭菌的含10 mg/L CV为唯一碳源的MSM培养基(100 mL)中。于30 ℃、180 r/min摇床中振荡培养1周后,吸取1 mL培养液转接至含20 mg/L CV的新鲜培养基中,连续驯化、富集。转接多次后,培养物可耐受的CV终浓度为100 mg/L。用接种环蘸取少许富集培养液,在纯化培养基平板上直接划线分离。在平板上选择不同形态特征的单菌落,重新转接至含100 mg/L CV的纯化培养基平板上,转接多次直至获得单一形态的CV降解菌纯培养物。
1.3.2菌株CV-b 16S rRNA基因的PCR扩增与序列分析具体方法参见都林娜等介绍的方法[8]。
1.3.3菌株CV-b对CV的脱色特性研究(1)培养基起始pH值对脱色的影响。用1.0 mol/L的HCl或NaOH将2.0 g/L酵母粉溶液的初始pH值分别调整到2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。灭菌后添加过滤除菌的CV,使其终浓度为50 mg/L,接种等量菌株CV-b过夜培养物(干质量,0.15 g/L),并于30 ℃、180 r/min条件下振荡培养。(2)培养温度对脱色的影响。分别设定培养温度为15、20、25、30、35、40 ℃,pH值为7.0左右,接种培养方法同(1)。(3)碳氮源对脱色的影响。将供试碳源(葡萄糖、乳糖、D-半乳糖、蔗糖、麦芽糖、D-果糖、D-木糖和淀粉)分别添加至MSM培养基中,使其终浓度为 2.0 g/L。将供试氮源(NH4Cl、NaNO3、牛肉膏、蛋白胨、酵母粉、甘氨酸和L-谷氨酸)分别添加至无NH4Cl的MSM培养基中,使其终浓度为20 g/L。接种和培养方法同(1)。(4)金属离子对脱色的影响。分别向2.0 g/L的酵母粉溶液(pH值7.0)中添加终浓度为1.0、2.0 mmol/L的CuCl2、FeCl3、CaCl2、ZnCl2、MgCl2和MnCl2,接种和培养方法同(1)。所有试验均重复3次以上,并同时设置对照试验。
1.3.4菌株CV-b对CV的脱色动力学研究接种后于30 ℃条件下培养,在一定的时间间隔内从三角瓶中吸取 4 mL 样品,于10 000 r/min条件下离心10 min,上清液用于测定脱色率。
1.3.5菌株CV-b对CV脱色前后的全波长扫描分析在MSM培养基中添加终浓度为50 mg/L的CV,接种后于30 ℃条件下培养24 h后,取4 mL样品,于10 000 r/min条件下离心10 min,上清液用Evolution 300紫外可见光分光光度计进行全波长扫描分析,同时设置对照试验。
1.4脱色率计算
将混合培养物在10 000 r/min条件下离心10 min后,取上清,用Evolution 300紫外可见光分光光度计在580 nm(CV的λmax)处测定吸光度。对照试验为同等条件下不接菌的试验组。脱色率通过以下公式计算:
脱色率=Dc-DfDc×100%。
式中:Dc为对照试验组的吸光度;Df为接种并培养一定时间后染料溶液的吸光度。
2结果与分析
2.1CV高效降解菌株的筛选与鉴定
经多次富集、纯化培养后,筛选到一株对CV脱色效果较好的菌株,命名为CV-b。革兰氏染色结果显示该菌株是革兰氏阴性菌,杆状。
以菌株CV-b基因组为模板,用引物BSF8/20和BSR1541/20进行PCR扩增,检测PCR产物、回收、纯化后测序,获得1476 nt的CV-b菌株的16S rRNA基因片段,在GenBank中的登录序号为KF956723。将该序列经与GenBank中的数据比对后发现,其相似度与Enterobacter sp. AP11的相似度达到97%以上,并且在系统进化树中也与该菌株聚类在一起,表明该菌株属于肠杆菌属(Enterobacter sp.)。
2.2菌株CV-b对CV的脱色特性
2.2.1初始pH值对CV脱色的影响由图1可知,培养 24 h 后,pH值在3.0~10.0之间时,该菌株对50 mg/L的CV脱色率均在50%以上,说明该菌株对CV脱色的pH适应性较强,实际应用潜力较大。同时,当培养基pH值偏酸性的情况下,该菌株对CV的脱色率仍较高,最适脱色pH值位于3.0~40之间。以往的报道显示,多数菌株对染料进行脱色的最适pH值为中性范围,如Ayed 等在研究Bacillus sp.菌株对CV的降解特性时发现,脱色的最适pH值为7.0左右,而偏酸或偏碱对脱色的抑制效果都较为显著[9];无独有偶,胡起靖等在研究一株嗜麦芽寡养单胞菌对结晶紫的脱色条件时也发现,脱色的最适pH值为中性,偏酸或偏碱会对脱色有显著的抑制效果[10]。与以往报道相比,菌株CV-b在偏酸或偏碱性条件下均有较好的脱色效果,pH适应性较强,能够适应实际废水处理过程中含染料废水偏酸或偏碱的情况,故而实际应用潜能较大。
2.2.2温度对CV脱色的影响由图2可知,培养24 h时,温度为25~35 ℃之间时,该菌株对50 mg/L的CV脱色率均在50%以上。随着脱色时间的延长,菌株对CV的脱色率也随之升高。
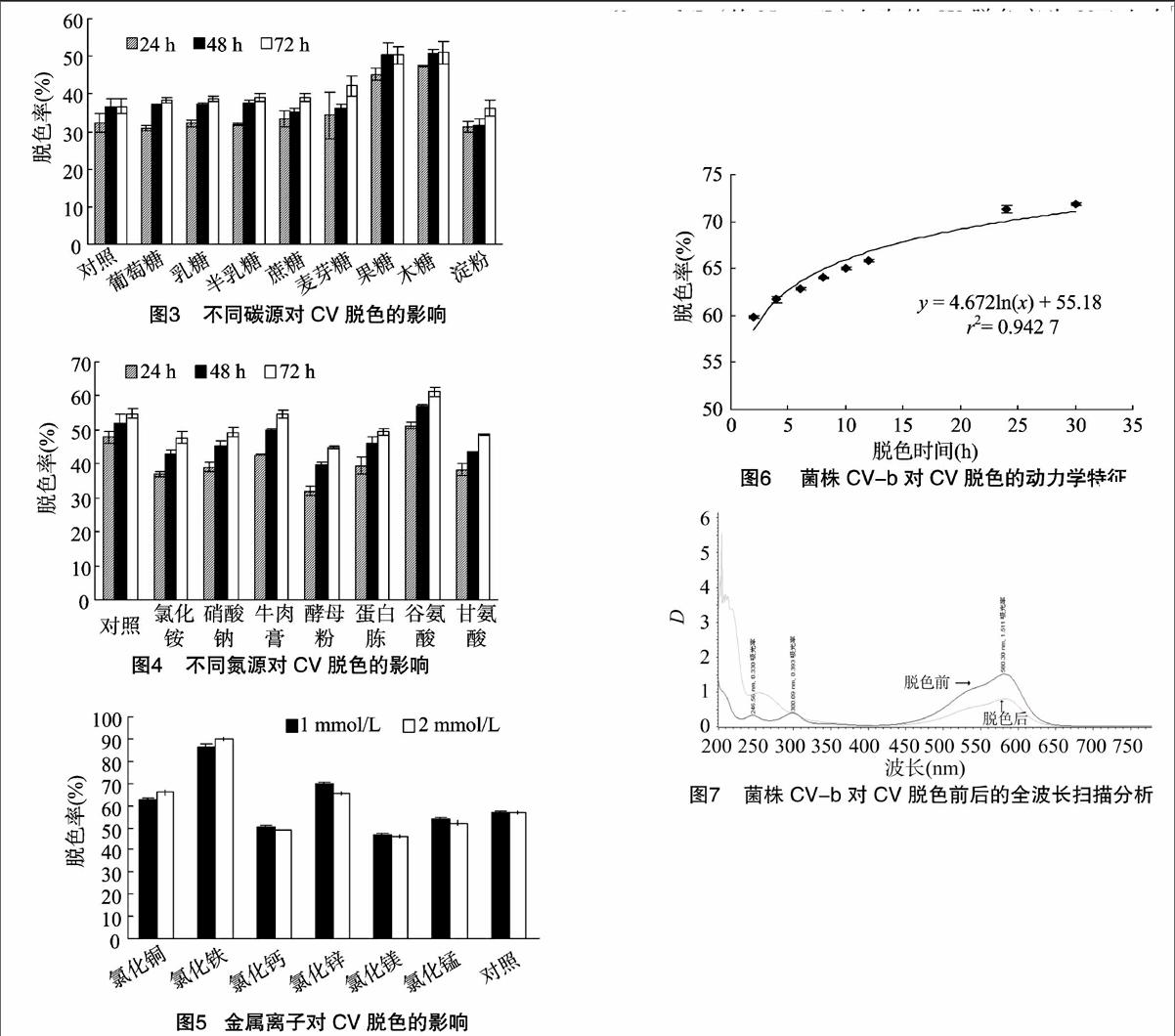
2.2.3碳氮源对CV脱色的影响试验结果(图3)表明,多数供试碳源对CV脱色无显著影响或有促进效应,其中以麦芽糖、果糖和木糖的促进效果最为显著,总体而言,供试碳源中以木糖对CV脱色的促进效果最好。不同的菌株对CV进行脱色的最适碳源不尽相同,多数研究中发现的CV生物脱色的最适碳源为葡萄糖,如Cheriaa等在研究Sphingomonas paucimobilis对CV脱色的过程中发现,脱色的最适碳源为葡萄糖[11],而不同菌株对不同碳源的偏好性的原因尚不清晰。
氮源对CV脱色的影响如图4所示。与碳源相比,多数供试氮源对CV脱色均无显著影响或有显著抑制效应,仅谷氨酸对脱色有显著的促进效应。
2.2.4金属离子对CV脱色的影响由图5可知,无论浓度为1 mmol/L或2 mmol/L,在供试金属离子中Ca2+、Mg2+和Mn2+均对CV脱色有显著抑制效应,而Cu2+、Fe3+和Zn2+则对CV脱色有显著促进效应,其中尤以Fe3+的促进效果最佳。但考虑到Fe3+本身有絮凝效果,且经离心后的菌体沉淀呈现紫色,因此,后期未在培养基中添加Fe3+作为脱色促进因子,而是选取了促进效果次之的Zn2+作为脱色促进因子。
2.3菌株CV-b对CV的脱色动力学特性
菌株CV-b对CV的脱色动力学试验结果如图6所示。由试验数据可知,该菌株对CV脱色的动力学数据可以很好地拟合为如下动力学模型:y=4.672ln(t)+55.18(r2=0.942 7),y为脱色率,t 为脱色时间。此外,由图6可知,经培养24 h后,该菌对50 mg/L的CV脱色率可以达到70%以上。根据以往报道,由于培养条件和接种量等差异,不同的菌株对CV的脱色率也各不相同,如Yatome等在研究Nocardia coralline 降解CV时发现,在CV浓度达到7 μmol/L(约3 mg/L)以上时,该菌株对CV的脱色就完全被抑制[12];谯建军等在研究细菌Kingella H共降解CV的动力学过程中发现,当CV浓度达到38 mg/L时,脱色率仅为30%左右[13];Chen 等的研究表明,经过1周的培养后,菌株Pseudomonas putida 对 60 μmol/L (约25 mg/L)左右的CV脱色率为80%左右[5];Cheriaa等发现Sphingomonas paucimobilis对50 mg/L CV的最高脱色率可达71.29%[11]。与以往报道相比而言,本研究中菌株CV-b脱色能力较强,且pH适应性强,应用前景较为广阔。
2.4菌株CV-b对CV脱色前后的全波长扫描图谱
前人研究表明,细菌对染料的脱色原因或是由生物降解引起,或是由生物吸附或富集引起。若经脱色后,染料的特征吸收峰完全消失且产生新的产物吸收峰,则脱色是由生物降解引起;而若经脱色后,染料全波长扫描图谱中的吸收峰相应降低,但并不产生新的吸收峰,则脱色是由生物富集或吸附引起[14-15]。CV脱色前后的全波长扫描图谱如图7所示。结果显示,经菌株CV-b脱色后,CV的特征吸收峰(λmax=580 nm)降低,且在紫外光谱区有新的产物吸收峰产生,因此,该菌株对CV的脱色主要由生物降解引起。
3结论
本研究从浙江温州分离筛选到一株CV高效降解菌株CV-b,经鉴定属于肠杆菌属(Enterabacter sp.)。该菌株对CV进行脱色的pH适应性较强,脱色过程中对碳氮源的依赖性不高,且多数供试金属离子对其脱色都没有显著的抑制效应,说明其实际应用潜力较大。另外,该菌株对CV脱色的动力学数据可以很好地用对数动力学模型进行拟合,经脱色前后的全波长扫描分析显示该菌株对CV的脱色可能是由生物降解引起的。进一步的研究将围绕该菌株对CV的降解机理和实际应用展开更加深入的探索。
参考文献:
[1]van der Zee F P,Villaverde S. Combined anaerobic-aerobic treatment of azo dyes—A short review of bioreactor studies[J]. Water Research,2005,39:1425-1440.
[2]Ali H,Muhammad S K. Biosorption of crystal violet from water on leaf biomass of Calotropis procera[J]. Journal of Environmental Science and Technology,2008,1(3):143-150.
[3]Mondal P K,Ahmad R,Usmani S Q. Anaerobic biodegradation of triphenylmethane dyes in a hybrid UASFB reactor for wastewater remediation[J]. Biodegradation,2010,21(6):1041-1047.
[4]Wu J,Li L G,Du H W,et al. Biodegradation of leuco derivatives of triphenylmethane dyes by Sphingomonas sp. CM9[J]. Biodegradation,2011,22:897-904.
[5]Chen C C,Liao H J,Cheng C Y,et al. Biodegradation of crystal violet by Pseudomonas putida[J]. Biotechnology Letters,2007,29(3):391-396.
[6]Chen C Y,Kuo J T,Cheng C Y,et al. Biological decolorization of dye solution containing malachite green by Pandoraea pulmonicola YC32 using a batch and continuous system[J]. Journal of Hazardous Materials,2009,172(2/3):1439-1445.
[7]Wu J,Jung B G,Kim K S,et al. Isolation and characterization of Pseudomonas otitidis WL-13 and its capacity to decolorize triphenylmethane dyes[J]. Journal of Environmental Sciences-China,2009,21(7):960-964.
[8]都林娜,泮琇,李刚,等. 孔雀石绿高效脱色菌株的筛选、鉴定与脱色特性研究[J]. 环境科学学报,2014,34(1):143-151.
[9]Ayed L,Cheriaa J,Laadhari N,et al. Biodegradation of crystal violet by an isolated Bacillus sp.[J]. Annals of Microbiology,2009,59(2):267-272.
[10]胡起靖,林玉满,甘莉,等. 一株嗜麦芽寡养单胞菌对结晶紫的脱色条件研究[J]. 福建师范大学学报:自然科学版,2008,24(2):75-79.
[11]Cheriaa J,Triphenylmethanes B A. Malachite green and crystal violet dyes decolourisation by Sphingomonas paucimobilis[J]. Annals of Microbiology,2009,59(1):57-61.
[12]Yatome C,Yamada S,Ogawa T,et al. Degradation of crystal violet by Nocardia coralline[J]. Applied Microbiology and Biotechnology,1993,38:565-569.
[13]谯建军,姚秉华,田萍,等. 结晶紫生物共降解的动力学研究[J]. 中国环境科学,2005,25(6):664-668.
[14]Parshetti G K,Telke A A,Kalyani D C,et al. Decolorization and detoxification of sulfonated azo dye methyl orange by Kocuria rosea MTCC 1532[J]. Journal of Hazardous Materials,2010,176(1/3):503-509.
[15]Khataee AR,Dehghan G,Ebadi A,et al. Biological treatment of a dye solution by macroalgae Chara sp.:effect of operational parameters,intermediates identification and artificial neural network modeling[J]. Bioresource Technology,2010,101:2252-2258.
