中药改善多器官功能障碍综合征的研究进展
2021-08-19陈卓宫帅帅任玉川寇俊萍
陈卓,宫帅帅,任玉川,寇俊萍
(中国药科大学中药学院中药药理与中医药系,江苏 南京 211198)
多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)是临床常见危重症。其特征是当严重感染、创伤、烧伤等损伤机体后,可诱发持续全身炎症反应综合征 (systemic inflammatory response syndrome,SIRS),进而导致两个或两个以上器官功能障碍,涉及全身性炎症和包括细胞死亡在内的细胞应激反应[1]。一般是肺最先受累,次为肾、肝、心血管、中枢系统、胃肠、免疫系统和凝血系统功能障碍[2]。MODS的发病机制非常复杂,确切发病机制目前尚不完全清楚,临床上尚无有效的防治方法。
在中医理论中,多将MODS归入“热病”范畴。有学者认为“瘀血内结”是MODS关键病机,既是疾病发展中的病理产物,也是影响疾病预后的主要因素;正气虚是MODS发生的内在因素[3]。也有学者认为“滞闭不通”为MODS发生的主要原因之一[4]。有观点认为MODS的中医学论治应该从脏腑辨证着手,运用五脏相关理论进行论治[5],并总结出其五脏传变规律为肺-心-肾-脾;“启动脏腑”为肺,“枢纽脏腑”为肾[6]。现代研究发现MODS的发病主要与炎症反应、组织缺血-再灌注损伤[7]、肠道屏障功能破坏等因素相关[8]。
当前MODS治疗主要以早期抗菌治疗,限制性液体复苏和器官功能支持疗法为主[9]。但单一方面的治疗方法,往往无法取得良好的疗效。中医药的“整体观念”优势或许可以弥补目前单一治疗方法的不足,因此探索有效的中医药治疗手段来改善MODS,具有重大意义。本文拟从干预炎症反应、干预组织缺血-再灌注损伤、干预肠道屏障功能破坏和干预微循环障碍以及其他方面对近五年来发表的关于中药治疗MODS的作用机制进展予以综述,以期为研发防治MODS的新药提供实验依据和线索。
1 中药干预炎症反应改善多器官功能障碍综合征
MODS是一个机体受损后,炎症介质过度释放引起炎症失控和免疫紊乱的综合征。局部受损会持续释放炎症介质和迅速启动全身炎症反应,促使全身炎症反应瀑布式放大,最终导致MODS[10]。在全身炎症反应的过程中有大量的活性氧(reactive oxygen species,ROS)和促炎性介质白介素-6(interleukin-6,IL-6)、白介素-8(interleukin-8,IL-8)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)释放[11],可以通过直接与间接的途径促使血管内皮细胞和器官组织细胞发生细胞凋亡,器官的组织细胞凋亡大量发生可能直接使器官功能发生障碍甚至衰竭。
研究表明,姜黄活性成分姜黄素(200 mg·kg-1)在由酵母聚糖引起的非败血性MODS的小鼠模型中,可以通过抑制核因子κB(nuclear factor kappa-B,NF-κB)的表达[12],减少细胞因子的产生和炎性细胞的浸润,改善肝、肺的损伤和功能障碍[13]。也有研究表明在用姜黄素(200 mg·kg-1)治疗后,明显抑制脓毒症小鼠血浆中TNF-α和IL-6的水平,增强调节性T细胞(regulatory T cells,Tregs)的抑制功能,升高白介素-10(interleukin-10,IL-10)的血浆水平,显著减轻败血症小鼠肺和肾脏的炎症损伤[14]。另有研究表明,在雨蛙素诱导的重症急性胰腺炎(severe acute pancreatitis,SAP)模型中,胡黄连的活性成分胡黄连苷Ⅱ(25 mg·kg-1)能抑制NF-κB、TNF-α和sirtuin1(SIRT1)的表达,降低SIRT1对微管相关蛋白1轻链3(microtubule-associated protein light chain3,LC3)的去乙酰化作用来降低SAP中的自噬活性和降低大鼠白细胞介素-1β(interleukin-1β,IL-1β)、TNF-α和IL-6的水平发挥抗炎活性[15]。垂盆草提取物(100 mg·kg-1)治疗可在大鼠SAP后期(12和24 h)下调肺中磷酸化Akt和磷酸化NF-κBp65的表达进而降低肺中IL-1β,IL-6和TNF-α的水平,其通过调节PI3K/AKT/NF-κB信号通路,来改善SAP中的肺损伤和MODS[16]。创伤导致的失血性休克(hemorrhagic shock,HS)会导致多器官障碍综合征,有研究表明丹参的活性成分丹参酮IIA磺酸钠(10 mg·kg-1)[17]、西红花的活性成分藏红花素[18]能在大鼠HS模型中抑制NF-κB信号通路,降低TNF-α和白介素-12(interleukin-12,IL-12)的水平,进而改善肾脏、肝脏、胰腺和神经肌肉损伤。水翁花的乙醇提取物(200 mg·kg-1)能通过调节核因子NF-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)/血红素氧合酶1(heme oxygenase-1,HO-1)途径降低血清中炎症因子水平,减弱脂多糖(lipopolysaccharide,LPS)诱导的内毒素休克,并减轻肺和肝组织的损伤[19]。在盲肠结扎和穿刺(cecum ligation and puncture,CLP)脓毒症大鼠模型中,远志皂苷元(60 mg·kg-1)通过抑制NF-κB的核转运,降低血清中TNF-α和IL-1β水平,显著减轻CLP诱导的肺损伤,降低肺湿重/干重比,减少蛋白质泄漏[20]。牡丹皮活性成分丹皮酚(120 mg·kg-1)可以通过上调miR-339-5p表达进而介导高迁移率族蛋白B1(high mobility group box 1,HMGB1)和IκB激酶β(inhibitor kappa B kinase β,IKKβ)的表达减轻脓毒症模型小鼠的炎症[21]。
升降汤(5 g·kg-1)在急性胰腺炎大鼠模型中能降低血清中TNF-α水平和升高血清中IL-10水平,其通过调节炎症反应减轻肺,胰腺,肾脏和肠的病理损伤,改善多器官损伤[22]。生脉注射液能抑制热休克蛋白90(heat shock protein 90,HSP90)的表达,进而影响NF-κB、Akt和IKK的表达,干扰炎症反应,改善败血症诱导的多器官损伤[23]。血必净中药注射液(18 mL·kg-1)能调节Tregs和辅助性T细胞17(T helper cell 17,Th17)的平衡,降低败血症小鼠血清中炎症因子TNF-α和IL-6的水平,可以有效地防止嗜中性粒细胞浸润到肺和肾脏,并提高小鼠存活率[24]。
2 中药干预缺血再灌注损伤改善多器官功能障碍综合征
MODS可发生于休克和复苏后,多与机体组织的缺血-再灌注损伤有关。缺血再灌注损伤不仅造成机体局部的功能损伤,同时再灌注使受损部位的代谢毒性物质进入血液循环,到达其他器官组织,引起其他远隔部位的器官功能损伤[25]。
在双侧后肢缺血再灌注大鼠模型中,黄芩的活性成分野黄芩苷(20 mg·kg-1),通过抑制环氧化酶-2(cyclooxygenase-2,COX-2)途径,降低促凋亡蛋白Bax的表达,而显著提高抗凋亡蛋白Bcl-2的表达,并下调半胱氨酸蛋白酶-3(caspase-3)活性,进而减轻后肢缺血再灌注引起的肺损伤[26]。人参皂苷Rg1(40 mg·kg-1)通过调节NF-κB/COX-2信号通路减轻后肢缺血再灌注引起的肺损伤,显著改善缺血再灌注引起的肺组织学异常[27]。黄柏中的总黄酮,可以增加抗凋亡因子Bcl-2的表达,减少促凋亡因子的表达,并抑制caspase-3、caspase-9的激活,改善下肢缺血性损伤[28]。在大鼠肠系膜缺血再灌注模型中,肉桂中的肉桂醛(40 mg·kg-1)预处理,可以抑制肺组织和肝脏组织中NF-κB相关蛋白的表达,和p53家族成员(包括caspase-3、caspase-9、Bax和p53)的蛋白表达,并增加Bcl-2的表达[29]。其能显著恢复肠系膜缺血再灌注损伤中肝组织中的天冬氨酸转氨酶(aspartate aminotransferase,AST)和丙氨酸转氨酶(alamine aminotransferase,ALT)的水平,改善肝功能[30]。在肠缺血之前,腹腔注射甜菜碱(50 mg·kg-1)能减少肠缺血再灌注大鼠中肥大细胞的数量,增加肠绒毛高度;减少肺内的髓过氧化物酶(myeloperoxidase,MPO)阳性细胞数量。甜菜碱预处理能保护空肠黏膜和肺,并降低肠道缺血再灌注损伤后的炎症细胞密度[31]。也有研究表明黄芩苷(100 mg·kg-1)通过抑制小鼠NF-κB核转位减轻肠缺血/再灌注引起的急性肺损伤[32]。在急性腹主动脉缺血再灌注模型中,姜黄素(200 mg·kg-1)能降低模型组大鼠血清中总氧化态(total oxidant status,TOS)和氧化应激指数(oxidant stress index,OSI),可以有效减轻氧化应激损伤以及改善肺,肾和心脏的组织病理学损伤[33]。另有研究表明,在局部缺血期间腹腔注射200 mg·kg-1水飞蓟素,能减轻急性腹主动脉缺血/再灌注大鼠的损伤,减轻氧化应激损伤并保护肝,肾和肺,改善多器官损伤[34]。
参麦注射液(9 mL·kg-1)通过抑制p38MAPK的活化,提高Bcl-2与Bax的比例来抑制肺细胞凋亡,进而保护肠缺血再灌注损伤所致的肺损伤[35]。在临床上,中药星萎承气汤(胆南星、瓜蒌、生大黄、芒硝)治疗7 d后,急性脑缺血并发MODS患者中医症状与体征改善明显,血清中TNF-α、LPS、D-乳酸浓度显著降低,减少急性脑缺血合并MODS的发生率,降低病死率[36]。
3 中药干预肠道损伤改善多器官功能障碍综合征
肠道作为体内最大的“储菌库”和“内毒素库”,被认为是危重病应激的“中心器官”及MODS“启动器官”[37]。在各种刺激作用下肠道免疫功能受抑制,肠黏膜完整性被破坏,导致肠屏障功能受损,促使肠道细菌移位,引起宿主过度炎症反应,诱发/加重全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),而SIRS再次损伤肠道,两者互为因果,互相促进,最终形成MODS[38]。
黄芪的活性成分黄芪甲苷(3 mg·kg-1)通过抑制RhoA/NLRP3炎性体信号通路,增加肠中紧密连接(tight junctions,TJ)蛋白的表达和维持肠上皮屏障功能完整性[39]。大黄素能增加CLP大鼠肠组织中闭合蛋白-3(claudin-3),闭锁小带蛋白1(zonula occludens 1,ZO-1)和密封蛋白(occludin)的表达水平进而保护肠道屏障[40]。柚皮苷(60 mg·kg-1)通过调节RhoA/ROCK/NF-κB/MLCK/MLC信号通路增加肠组织中紧密连接蛋白ZO-1和闭合蛋白-1(claudin-1)的表达,改善肠通透性,并抑制TNF-α和IL-6的释放,提高了CLP小鼠的存活率[41]。小檗碱(50 mg·kg-1)可增加锌铁调控蛋白-14(Zrt-Irt-like protein 14,ZIP14)表达从而促进肠组织中锌的蓄积,进而保护肠屏障[42]。也有研究表明小檗碱(100 mg·kg-1)在多细菌性败血症模型中通过调节ApoM/S1P途径降低肠组织中血管屏障通透性[43]。刺五加多糖在小鼠内毒素血症模型中通过抑制NF-κB/MLCK通路,上调紧密连接蛋白的表达,改善肠上皮功能障碍[44]。
研究表明,在脓毒症大鼠模型中,参附汤(3 mg·kg-1)能上调肠组织中ZO-1、occludin、claudin-1和磷酸化血管扩张刺激磷蛋白(phosphorylated vasodilator stimulated phosphoproteinp,p-VASP)的表达,降低肠道通透性,显著降低CLP大鼠的死亡率,改善脓毒症引起的肠和肝损伤[45]。通腑泻肺方(7.2 g·kg-1)通过上调ZO-1/occludin/claudin-1的表达维持肠屏障功能,并减轻脓毒症的炎症反应,增加了CLP大鼠的存活率[46]。宣白承气汤(15.12 g·kg-1)通过调节肠道菌群,提高乳酸杆菌,丁酸球菌和双歧杆菌的相对丰度,维持肠道上皮屏障完整和减少炎症反应,进而提高败血症大鼠存活率[47]。党参合剂及其纳米制剂能调整肠道菌群、扶植以双歧杆菌、乳酸杆菌为主的厌氧菌,抑制需氧和兼性需氧的肠杆菌、肠球菌,保护肠道生物屏障,从而降低内毒素的产生,阻断MODS的发生[48]。
4 中药干预微循环障碍改善多器官功能障碍综合征
MODS时,患者微循环障碍、血流不畅是其重要生理病理变化;微循环障碍也是严重脓毒症致MODS的重要机理之一[49]。当微循环功能障碍加重,微循环中的血液流速减慢,血小板红细胞聚集,诱发弥漫性血管内凝血。同时血管内皮损伤,释放大量的细胞因子,导致器官组织的功能性及结构性的改变,表现为MODS[50]。因此,微循环功能障碍和MODS两者互为因果。
在LPS诱导的新西兰兔弥散性血管内凝血合并多器官障碍综合征模型中,丹参酮ⅡA(20 mg·kg-1)能显著降低凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)和TNF-α水平,增加器官血流量改善器官损伤[51]。丹参酮IIA磺酸钠也能通过增加血流动力学参数,改善内毒素血症动物模型中心脏,肺和肝脏的组织病理学损伤[52]。芍药苷(60 mg·kg-1)能调节LPS诱导的弥散性血管内凝血动物模型中的凝血和纤溶系统的紊乱,具有抗凝血功能,改善肝脏和肾脏损伤[53]。白术中活性成分白术内酯-1(5 mg·kg-1)能降低凝血活酶时间、凝血酶原时间,预防血栓形成,并降低多器官功能障碍的发生率[54]。
在临床上发现,参附注射液(由红参、黑附子提取精制)联合血必净注射液治疗,可以降低脓毒症急性肾损伤患者中的巨噬细胞炎症蛋白-2(macrophage inflammatory protein-2,MIP-2),血管紧张素Ⅰ(angiotensinⅠ,Ang Ⅰ),尿肾损伤分子-1(kidney injury molecule 1,KIM-1)水平,改善患者的肾功能及增加肾动脉血流量,改善微循环[55]。参麦注射液(由红参与麦冬两味中药提取而成)治疗,能降低脓毒症患者TNF-α、C反应蛋白(C-reactive protein,CRP)的水平,明显提高抗凝血酶Ⅲ(antithrombin-Ⅲ,AT-Ⅲ)、活化蛋白C(activated protein C,APC)的水平,调节凝血-抗凝系统,改善微循环[56]。
5 其他
目前中药除了通过干预以上途径改善多器官障碍综合征,还可以通过其他途径改善多器官障碍综合征,如调整肠道微生态失衡,调节能量代谢。改良的大承气汤在重症急性胰腺炎模型大鼠中能减轻胰腺和小肠的损伤,降低肠系膜淋巴结中细菌移位的阳性率,并提高大鼠存活率,改善多器官损伤[57]。中草药川芎的提取物四甲基吡嗪(60 mg·kg-1)在大鼠脓毒症模型中能改善大鼠肝线粒体功能,促进肝细胞中ATP合成,调节能量代谢来减轻败血症引起的损伤[58]。参附注射液可抑制细胞色素c的释放,同时降低线粒体膜电位,从而保护线粒体功能,进而改善脓毒症大鼠中多器官损伤[59]。
6 总结与展望
以上研究表明,中药有效活性成分、复方或提取物能通过多途径防治多器官障碍综合征和保护组织器官。其治疗多器官障碍综合征的途径总结如表1所示。将近五年报道的可有效防治多器官障碍综合征的中药有效成分或复方按照其化学结构分类,经归纳总结可发现以苷类文献报道最多,其次是生物碱类、酚类,蒽醌类,糖类等相对较少。已报道的苷类主要通过调节NF-κB和COX-2途径,进而降低炎症因子的表达,来改善MODS。其中生物碱中以丹参酮为主,通过抑制炎症和调节凝血系统两方面改善MODS。酚类通过抑制炎症和发挥抗氧化作用改善MODS。蒽醌类以大黄中大黄素为主,能通过维持肠道屏障完整性,改善MODS。从中药功效上以参附汤为代表的补气药,能抑制炎症,改善微循环;大黄、大承气汤为代表的泻下药,能减少肠道细菌移位,维持肠屏障完整,进而改善MODS。
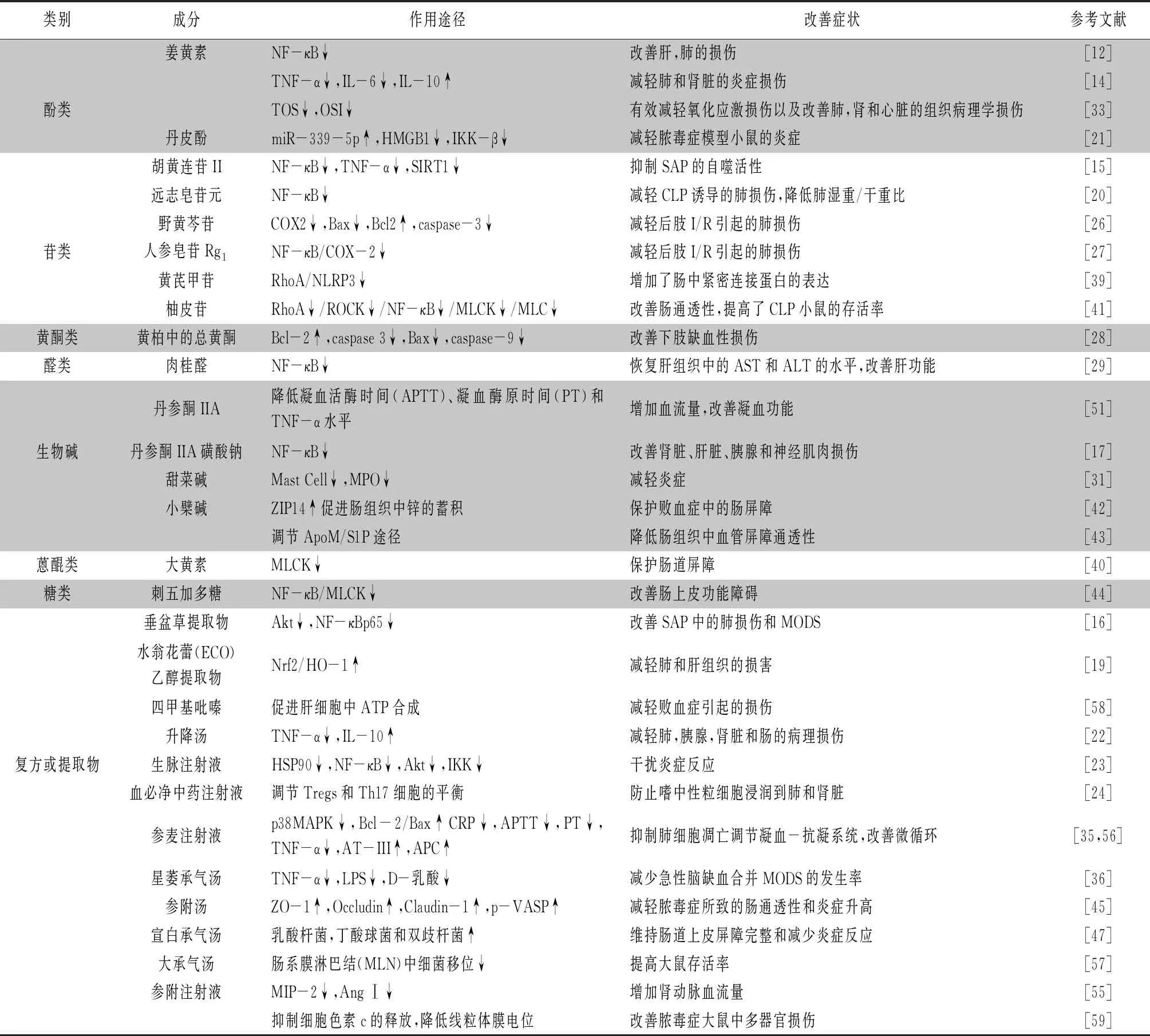
表1 中药治疗多器官障碍综合征的主要作用及调控机制汇总
尽管中药活性成分防治多器官障碍综合征的研究已取得一定进展,但也存在不少问题,较为突出的是缺少合适的动物模型和统一的作为评判的生理指标。目前MODS的模型主要有两类:非感染性模型(创伤、失血休克模型、重症胰腺炎等)和感染性模型(脓毒症模型、肠缺血再灌注模型、大肠埃希菌脂多糖模型)。其中失血休克较好模型了临床失血性休克、创伤后引发的器官损伤,但需要对模型动物血压、心率循环进行持续监测,此类方法较为适用于体型较大、血容量较为充足的动物;重症胰腺炎模型较好模拟了过度炎症所诱发的MODS,但是手术操作难度大;脓毒症模型和肠缺血再灌注模型则模拟了MODS初期的肠黏膜缺血损伤和后期的细菌毒素迁移,模型制作可重复性好,但对动物创伤较大;大肠埃希菌脂多糖模型只需向大鼠体内腹腔或静脉注射脂多糖即可,操作方便,但大肠埃希菌脂多糖的剂量、种类、批次和注射方式对模型影响较大,重复性差。因此,如何通过构建符合中医证候特点的动物模型并结合临床研究探索到MODS的发病机制和利用基因组学、蛋白质组学、代谢组学和网络药理学等方法,对中药治疗多器官障碍综合征的分子机制或关键作用靶点进行全面完整深入阐释和确证,仍然是未来需要攻克的难题。
