二甲双胍增强胶质瘤细胞对替莫唑胺的化疗敏感度的分子机制研究
2021-08-19金鹏程朱鹏磊王欧洋童凌云
金鹏程 林 杰 朱鹏磊 王欧洋 吴 昊 童凌云
胶质瘤是中枢神经系统最常见的原发性肿瘤,也是致死率最高的肿瘤[1]。既往研究认为小胶质细胞作为脑内主要的免疫细胞从而限制了其抗原递呈过程,而最新研究表明脑组织内存在活跃的免疫监视和免疫响应机制[2,3]。胶质瘤微环境中程序性细胞死亡配体1(PD-L1)表达水平升高,主要组织相容性复合物表达降低,小胶质细胞释放大量抗炎因子,具有肿瘤免疫抑制特征[4]。研究发现胶质瘤中PD-L1表达水平与胶质瘤预后呈负相关,并且发现经放化疗后复发的胶质瘤组织具有更强的免疫原性[4~6]。
替莫唑胺(temozolomide,TMZ)是一种具有抗肿瘤活性的烷化剂,是胶质瘤治疗的一线化疗用药。一项临床研究发现TMZ治疗后组织PD-1表达显著升高[7]。另一项更大样本量的临床研究则发现PD-L1表达水平与患者总生存期呈负相关[5]。Wang等[8]研究发现,TMZ处理后的胶质瘤细胞强烈抑制外周单核细胞的激活和促炎性因子的表达,同时TMZ促进PD-L1表达。将PD-1抑制剂与TMZ联用可以显著增加肿瘤组织T细胞浸润,改善T细胞耗竭,增强胶质瘤化疗敏感度[8~10]。
二甲双胍是一个代谢调控药物,由于其临床应用成熟、成本低廉,研究者利用其与各种治疗方式开展联合治疗,以寻求更优的治疗策略。二甲双胍可通过mTOR通路抑制HIF-1α表达,通过HIF-1α/PFKFB3/PFK1途径降低糖酵解活性从而抑制肝癌细胞增殖,还可通过HIF-1α/PKM2通路抑制成纤维细胞上皮间质转化[11, 12]。有研究表明二甲双胍可改善低氧状态下胶质瘤细胞对TMZ的敏感度[13]。本研究探讨了如何提升胶质瘤现有治疗药物敏感度,为寻找新的有效干预策略提供科学依据。
材料与方法
1.细胞培养:人源胶质瘤细胞株U87MG购自中国科学院细胞库。含10% FBS的MEM完全培养基37℃、5% CO2培养箱培养。隔天更换培养基,每3天传代1次。
2.药物处理:二甲双胍处理浓度为10mmol/L,mTOR激动剂MHY1485处理浓度为2μmol/L,TMZ处理浓度为0.1mmol/L,处理时长为48h。
3.Western blot法:RIPA缓冲液(Beyotime)冰上裂解U87MG,然后BCA方法测量总蛋白浓度。20μg蛋白质进行10% SDS-PAGE,并电转至PVDF膜。通过与5% BSA在室温下孵育阻断非特异性结合。然后将膜与一抗(1∶1000)在4℃孵育过夜。使用的一抗均购自美国Cell Signaling Technology生物公司:HIF-1α(#36169),HK2(#2867),PKM2(#4053),PFKFB3(#13123),PD-L1(#13684),mTOR(#2983),p-mTOR(#5536)。次日将膜与相应的二抗在室温下孵育。使用增强的化学发光试剂盒(美国Beyotime公司)检测免疫印迹信号。
4.qRT-PCR:使用Trizol(日本TaKaRa公司)从U87MG中提取总RNA。使用Nanodrop(美国Thermo Scientific公司)在260和280nm的波长处读取样品吸光度,测定RNA的完整性和浓度。紧接着利用cDNA合成试剂盒(美国Thermo Scientific公司)合成cDNA。引物序列详见表1。使用2-ΔΔct方法评估基因的相对表达。使用美国ABI StepOne实时PCR热循环仪(Applied Biosystems)进行qRT-PCR。

表1 相关引物序列
5.细胞免疫荧光:将U87MG接种于24孔板。4%多聚甲醛固定U87MG,用1PBS溶液(+0.1% Triton X-100)通透,抗山羊血清封闭,紧接着HIF-1α一抗 (1∶150) 4℃孵育过夜。次日,相应的荧光二抗 (1∶200) 水平摇床孵育2h,DAPI (1∶1000) 避光染核。最后于荧光显微镜下观察。
6.葡萄糖消耗量和乳酸释放量:葡萄糖消耗检测采用葡萄糖检测试剂盒,乳酸释放量检测采用乳酸检测试盒,试剂盒均购自南京建成生物工程研究所。U87MG经过实验处理后,收集上清,加入相应试剂。自动酶标仪测定505nm波长的吸光度葡萄糖消耗量;测定530nm波长的吸光度乳酸释放量。
7.Annexin V-FITC/PI染色检测细胞凋亡:收集U87MG,凋亡试剂盒(美国B D公司)处理细胞,注意避光。Annexin V-FITC/PI双染流式细胞术检测U87MG细胞凋亡率,采用FACSDiva 6.2软件进行数据分析。
8.CCK8测定IC50:经过二甲双胍或MHY1485处理后,将U87MG接种到 96 孔板。加入TMZ,恒温培养48h。加入CCK8工作液,酶标仪测定450nm 波长处吸光度,计算各组U87MG的生长抑制率。采用GraphPad Prism 8.0分析软件计算 IC50值,进而反映U87MG对TMZ的药物敏感度。
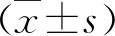
结 果
1.替莫唑胺对胶质瘤细胞HIF-1α表达的影响:本研究将U87MG用TMZ(0.1mmol/L)处理0、24、48、72h,HIF-1α表达随着TMZ处理时间增加而升高(图1A和图1B),细胞免疫荧光结果表明,48h后HIF-1α核内水平显著升高(图1C)。

图1 TMZ影响胶质瘤细胞HIF-1α表达A.Western blot法;B.qRT-PCR;C.TMZ不同处理时间下,细胞免疫荧光检测HIF-1α;与0h组比较,*P<0.05,**P<0.01,***P=0.000
2.HIF-1α表达抑制对胶质瘤细胞糖酵解活性以及PD-L1的影响:在U87MG中下调HIF-1α表达,发现糖酵解关键酶HK2、PKM2、PFKFB3表达下调,并且葡萄糖消耗量和乳酸释放量均显著降低,糖酵解活性降低(图2)。研究发现,下调HIF-1α表达使得糖酵解活性降低,PD-L1表达显著下调,进而影响胶质瘤细胞免疫逃逸的发生。
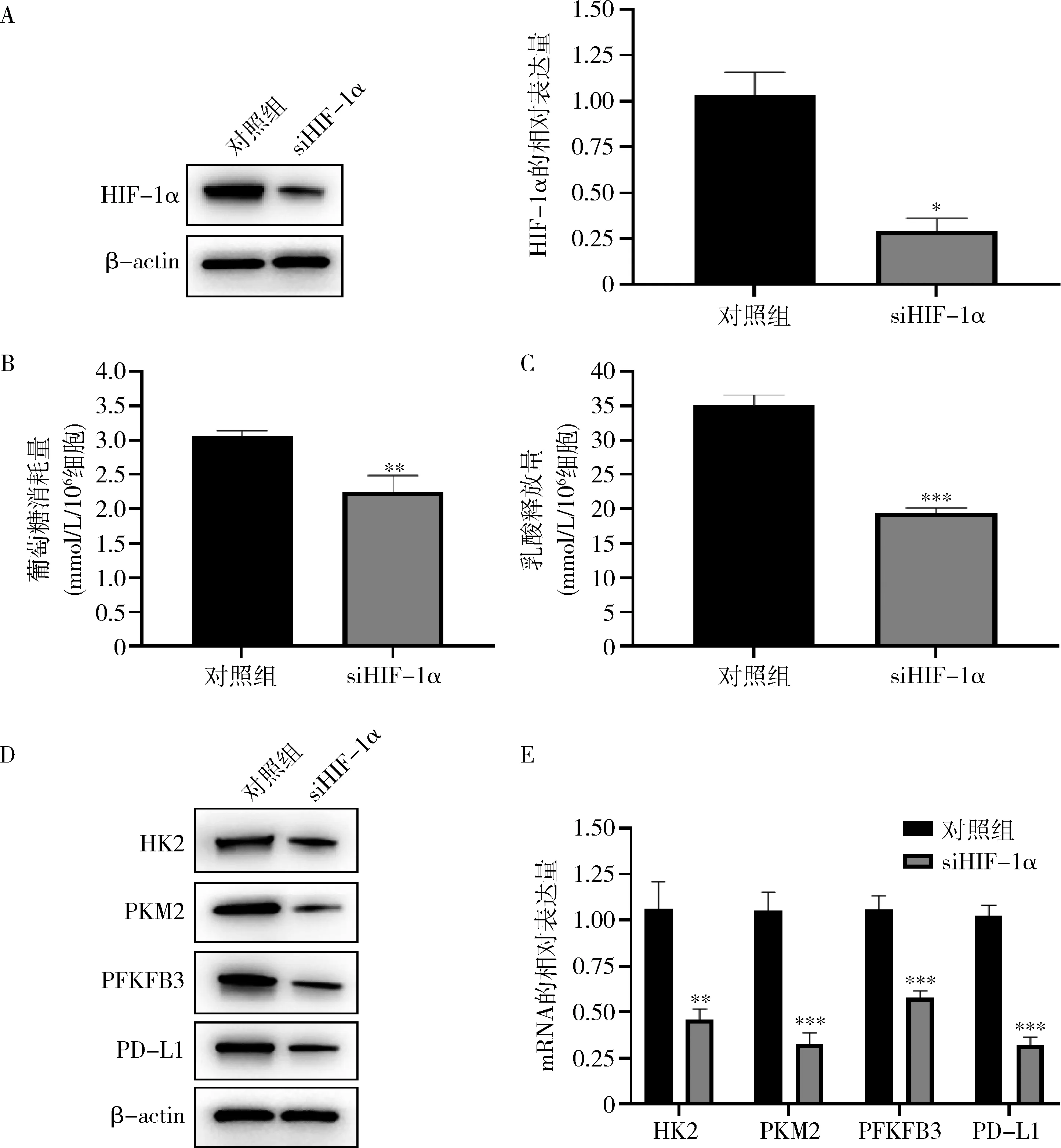
图2 下调HIF-1α表达影响胶质瘤细胞糖酵解活性以及PD-L1表达A.检测siHIF-1α干扰效果; B.葡萄糖消耗量; C.乳酸释放量; D.Western blot法检测糖酵解关键酶和PD-L1表达; E.qRT-PCR;与对照组比较,*P<0.05,**P<0.01,***P=0.000
3.替莫唑胺联合二甲双胍对胶质瘤细胞的作用:TMZ联合二甲双胍(10mmol/L)处理U87MG细胞株,结果表明,与TMZ诱导组比较,TMZ+二甲双胍组HIF-1α表达下调,但均比对照组表达高(图3A~C)。测定糖酵解活性发现联合处理组糖酵解活性降低,糖酵解关键酶表达显著下调(图3B和图3C),同时葡萄糖消耗量和乳酸释放量降低(图3D和图3E)。Western blot法和qRT-PCR检测结果表明联合处理组PD-L1蛋白表达下调(图3B和图3C)。Annexin V-FITC/PI染色结果表明联合处理组凋亡率升高(图3F)。CCK8 实验检测二甲双胍对胶质瘤细胞TMZ化疗敏感度的影响。通过计算半数抑制浓度(IC50)反映细胞对TMZ的敏感度。结果显示TMZ+二甲双胍组IC50减小(图3G)。

图3 TMZ联合二甲双胍对胶质瘤细胞的作用A.细胞免疫荧光;B.Western blot法;C.qRT-PCR;D.葡萄糖消耗量;E.乳酸释放量;F.Annexin V-FITC/PI染色;G.CCK8检测IC50;与以不做任何处理的U87MG为对照组比较,*P<0.01,**P=0.000; 与以仅用TMZ处理为对照组比较,**P=0.000
4.mTOR激动剂减弱二甲双胍对胶质瘤细胞替莫唑胺化疗敏感度的增强作用:Western blot法和qRT-PCR检测结果表明,与TMZ诱导组比较,TMZ诱导+二甲双胍组mTOR磷酸化水平降低,HIF-1α表达下调,并且PD-L1表达显著降低(图4A和图4B)。CCK8实验检测TMZ化疗敏感度(图4C),发现MHY1485处理后,IC50值一定程度变大。

图4 MHY1485对胶质瘤细胞的影响A.Western blot法;B.qRT-PCR;C.CCK8检测IC50;**P<0.01,***P=0.000
讨 论
胶质瘤细胞和胶质瘤微环境的代谢重构是影响胶质瘤生长、转移和免疫治疗效果的关键因素[14]。胶质瘤细胞主要以糖酵解方式快速获取能量,同时将葡萄糖转化为乳酸。在肿瘤微环境中,胶质瘤细胞消耗大量葡萄糖和氧气,造成局部缺氧,诱导相关蛋白生成,进而抑制NK细胞活性并激活免疫抑制性CD4+T细胞,导致肿瘤免疫抑制微环境;代谢产物乳酸的堆积促使单核细胞分化为树突状细胞,通过分泌免疫抑制因子、抑制T细胞免疫应答而直接抑制免疫反应[15]。本研究联合二甲双胍与TMZ作用胶质瘤细胞U87MG,改变肿瘤微环境,影响肿瘤细胞免疫逃逸,同时研究其作用机制。
本研究用TMZ处理U87MG,发现HIF-1α表达升高,同时48h后HIF-1α在核内水平显著升高。有研究报道,TMZ处理原代胶质瘤细胞可诱导HIF-1α水平升高并大量入核[16]。与本研究结果一致。下调U87MG中HIF-1α表达,研究发现糖酵解活性降低,同时发现PD-L1表达显著下调。Palsson-McDermott等[17]研究发现糖酵解关键酶PKM2能够发挥转录活性从而促进PD-L1的表达。Chen等[18]研究发现了PFKFB3通过NF-κB依赖的途径促进PD-L1表达。以上研究表明,TMZ能够升高HIF-1α在核内水平,进而增强糖酵解活性,促进PD-L1表达。
TMZ虽然是胶质瘤治疗的一线化疗用药,但是上调了PD-L1表达,促使胶质瘤细胞发生免疫逃逸,进而导致治疗失败和肿瘤复发,因此TMZ敏感度是胶质瘤治疗的关键因素[8,9]。二甲双胍能够抑制HIF-1α表达,进而降低糖酵解活性从而抑制细胞增殖,而且多篇研究发现二甲双胍可改善低氧状态下胶质瘤细胞对TMZ的敏感度[13,19,20]。但是,二甲双胍的具体作用机制尚不明确。本研究将TMZ联合二甲双胍处理U87MG,发现HIF-1α表达下调,糖酵解活性降低,PD-L1蛋白表达下调,进而影响胶质瘤细胞免疫逃逸的发生。同时细胞凋亡被促进,替莫唑胺IC50值变小,说明二甲双胍能够增强胶质瘤细胞对TMZ的化疗敏感度。进一步研究发现mTOR激动剂能够减弱二甲双胍对胶质瘤细胞TMZ化疗敏感度的增强作用。
综上所述,本研究发现了二甲双胍能够增强胶质瘤细胞对TMZ的化疗敏感度,同时阐明了其作用机制,为提升胶质瘤现有治疗药物敏感度、寻找新的有效干预策略提供了科学依据。
