乳腺癌组织中miR-502和HDAC3表达的相关性及其临床意义
2021-08-18赵云飞罗启翅陈茂山
赵云飞, 何 姣, 杨 玲, 刘 智, 罗启翅, 陈茂山
(遂宁市中心医院 1.病理科,2.乳腺甲状腺外科,四川省遂宁市 629000)
乳腺癌是临床上较为常见的女性恶性肿瘤,发病率及致死率呈逐年增加趋势,严重危及患者的生命安全[1-2]。随着基因组学、生物信息学及分子生物学的不断发展,乳腺癌标志物筛选及其靶点治疗已成为关注的焦点[3]。微小RNA(microRNA,miRNA)属于非编码小分子RNA,已有多项研究表明多种miRNA参与了癌症、免疫、代谢等疾病的发生发展[4]。研究发现miR-502在乳腺癌[5]、宫颈癌[6]等妇科肿瘤的发生发展中起到不同程度的调节作用,可作为妇科肿瘤的抑癌基因。组蛋白修饰是导致表观遗传学变化的重要机制,组蛋白去乙酰化酶3(histone deacetylase3,HDAC3)在肿瘤的发生发展中起到重要的作用[7]。有研究表明HDAC3在浸润性乳腺癌中异常高表达,起到一定的促癌基因作用[8]。本文探讨miR-502和HDAC3在乳腺癌组织中表达的相关性,及对乳腺癌诊断效能和预后的影响。
1 资料和方法
1.1 一般资料
选择本院2015年5月—2017年12月76例经手术病理证实的乳腺癌患者,收集其癌旁组织及癌组织标本。患者年龄36~73岁,平均(55.12±7.20)岁。全部患者均签署知情协议书,并获本院伦理委员会批准。纳入标准:手术病理学诊断为乳腺癌,并符合相关诊断标准[9];首次确诊;临床资料齐全。排除标准:术前接受放化疗及免疫治疗;依从性低或精神障碍者;合并其他恶性肿瘤;严重内科疾病;患严重感染、造血功能障碍及免疫缺陷疾病。
1.2 仪器与材料
RNA提取试剂盒购自Invitrogen公司;PrimeScript RT试剂盒及SYBR® Premix Ex TaqTMⅡ试剂盒均购自默沙克生物公司;反转录试剂盒购自大连宝生物工程有限公司;miR-502、HDAC3、U6、磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)引物购自Takara公司;紫外分光光度计及蛋白提取试剂盒均购自北京索莱宝科技有限公司;BSA试剂盒购自北京中生利康科技有限公司;HDAC3、GAPDH相关抗体、BCA试剂盒、荧光素酶试剂盒均购自Abcam公司;苏木精购自上海博谷生物科技有限公司;图像扫描系统购自上海涵飞医疗器械有限公司。
1.3 荧光定量PCR检测
提取各组织中总RNA。其中miR-502以U6为内参,HDAC3以GAPDH为内参。定量RNA,将RNA反转录成cDNA,反转录体系10 μL,反应条件:37 ℃、15 min×3次、85 ℃ 5 s。实施荧光定量PCR操作,反应体系50 μL:SYBR® Premix Ex TaqTMⅡ(2×)25 μL,PCR上游和下游引物均2 μL,ROX Reference Dye(50×) l μL,ddH2O 16 μL,DNA模板4 μL。miR-502反应条件:94 ℃ 10 min;95 ℃ 15 s;60 ℃ 60 s;72 ℃ 1 min,40个循环;HDAC3反应条件:95 ℃ 15 s;95 ℃ 30 s;60 ℃ 30 s;72 ℃ 10 s,40个循环。通过2-ΔΔCt法计算目的基因(miR-502、HDAC3)的相对转录水平。引物序列:miR-502正向引物:5′-ATCCTTGCTATCTGGGTGCTA-3′,反向引物:5′-CGAGCTCGGATCCACTAGTCC-3′;HDAC3正向引物:5′-CCTGGCATTGACTCATAG-3′,反向引物:5′-ATTAAGGCTCTTGGTGAAA-3′;U6正向引物:5′-CTCGCTTCGGCAGCACA-3′,反向引物:5′-AACG CTTCACGAATTTGCGT-3′;GAPDH正向引物:5′-ACGGCAAGTTCAACGGCACAG-3′,反向引物:5′-GACGCCAGTAGACTCCACGACA-3′。
1.4 免疫组化
组织标本固定于10%的甲醛中,常规石蜡包埋切片(厚4 μm),置于60 ℃温箱1 h,常规脱蜡脱水,3%双氧水中37 ℃孵育0.5 h,磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗,放于0.01 mol/L柠檬酸综合证缓冲液中,95 ℃ 20 min,冷却至室温,PBS冲洗。羊血清工作液封闭,37 ℃ 10 min。放入一抗:HDAC3(1∶250),4 ℃过夜,PBS冲洗。滴加相应的二抗室温孵育0.5 h,显色,苏木精复染,封片。每张切片随机选5个高倍视野(400×),计算阳性细胞所占百分比,阳性细胞判定标准[9]:细胞核/细胞质内棕黄色颗粒。
1.5 免疫印迹检测
提取组织标本中蛋白,按照BCA试剂盒说明书定量,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),将PAGE胶中蛋白转移至PVDF膜上,5%脱脂牛奶,室温密封1 h,加一抗:HDAC3(1∶1 000)、GAPDH(1∶1 000)4 ℃孵育过夜,冲洗后,将相应二抗与PVDF膜至室温孵育1 h。漂洗、化学发光、暗室曝光,显影并定影,通过图像扫描系统对蛋白条带进行分析。
1.6 荧光素酶报告实验
通过生物信息学http://www.targetscan.org/vert_72/、https://cm.jefferson.edu/网站预测miR-502和HDAC3的靶向关系,了解miR-502与HDAC3 3′UTR的结合位点。PCR反应扩增HDAC3结合位点片段,循环后72 ℃继续延伸3 min,4 ℃保存。经琼脂糖电泳分析,PCR产物纯化,经酶切、连接、转化、扩大菌落培养并提取质粒,构建HDAC3 3′UTR野生型(WT)质粒(HDAC3-WT)。并以质粒为基础,构建HDAC3 3′UTR突变型(MUT)质粒(HDAC3-MUT)。将对数生长的293T细胞于96孔板中接种,待对数生长期时,将HDAC3-MUT和HDAC3-WT的载体分别和mimic-NC或miR-502 mimic共转至293T细胞中。转染48 h后收集并裂解细胞,离心取上清,荧光素酶试剂盒检测荧光素酶活性。
1.7 临床病理特征分析
分析患者年龄、绝经状态、TNM分期、肿瘤直径、淋巴结转移、雌激素受体/孕激素受体(ER/PR)表达情况。根据癌组织miR-502、HDAC3相对表达中位数将乳腺癌患者分为高、低表达组,分析miR-502、HDAC3不同表达水平与乳腺癌患者临床病理资料之间的关系及对乳腺癌患者的诊断效能和预后生存的影响。患者随访时间至2020年12月。
1.8 统计学方法
2 结 果
2.1 miR-502、HDAC3的溶解曲线结果
miR-502、HDAC3的产物溶解峰,扩增产物分别在84.85、84.23 ℃出现单一峰,即qRT-PCR法可以检测组织中miR-502、HDAC3的表达且具有较高的特异度(图1)。

图1 miR-502与HDAC3的溶解曲线
2.2 组织标本中miR-502及HDAC3的表达情况
qRT-PCR及West blot实验结果显示,乳腺癌组织中miR-502表达水平显著低于癌旁组织,而HDAC3基因、阳性表达率及其蛋白表达水平均显著高于癌旁组织(P<0.05;图2A~C)。相关性分析结果显示,miR-502与HDAC3在乳腺癌组织中呈负相关(P<0.05;图2D)。网站预测HDAC3是miR-502的靶基因(图2E、F);荧光素酶报告实验显示,mimic-NC和miR-502 mimics共转染293T细胞后的HDAC3-WT荧光素酶活性差异有显著性(P<0.05;图2F)。

图2 miR-502与HDAC3之间表达关系
2.3 miR-502、HDAC3表达与乳腺癌临床病理资料之间的关系
根据miR-502、HDAC3相对表达水平的中位数将乳腺癌患者分为低表达组与高表达组,结果显示,miR-502、HDAC3相对表达水平与TNM分期、肿瘤直径、淋巴结转移及ER/PR表达情况有关(P<0.05;表1)。
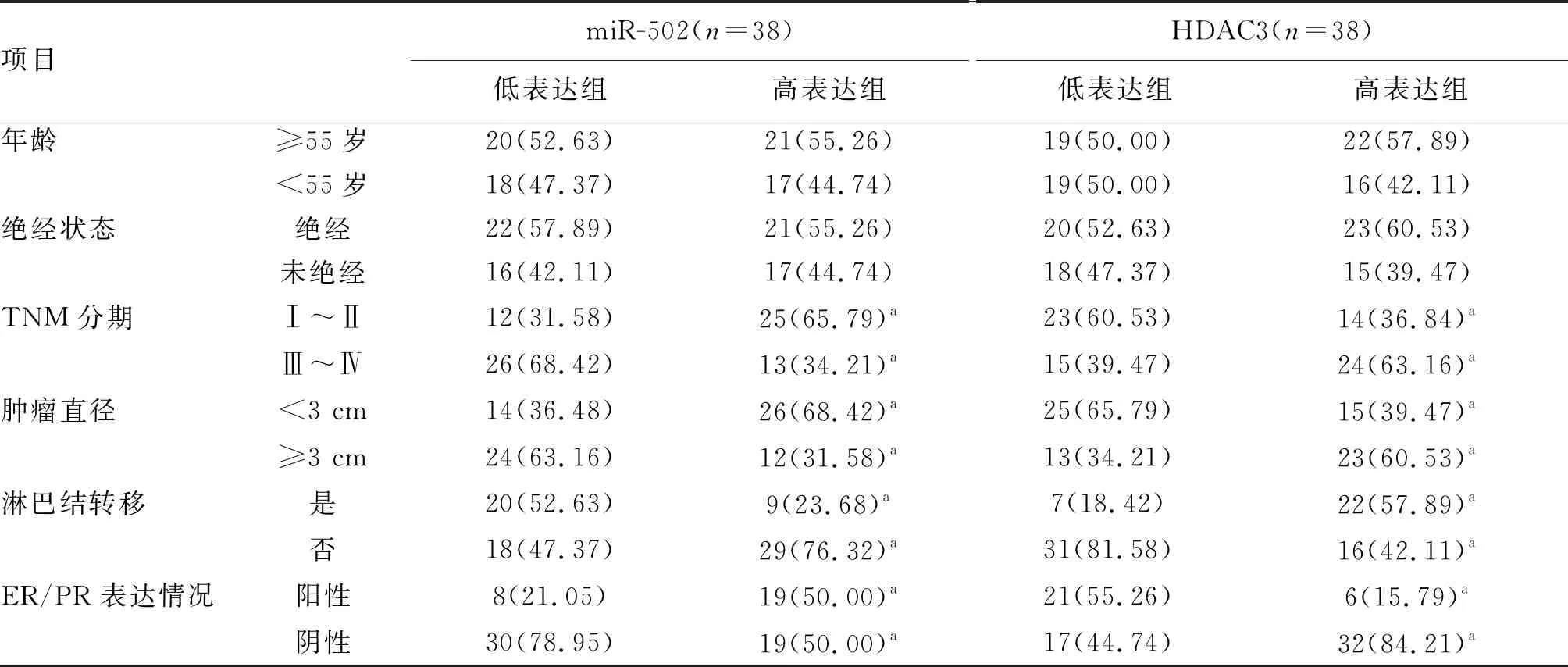
表1 miR-502、HDAC3基因表达与乳腺癌临床的关系 单位:例(%)
2.4 miR-502、HDAC3基因表达对乳腺癌患者的诊断效能
乳腺癌组织中miR-502、HDAC3及二者联合表达诊断乳腺癌患者均具有一定的诊断价值,其中二者联合诊断价值最高(表2)。

表2 miR-502、HDAC3基因表达对乳腺癌患者诊断效能的影响
2.5 miR-502、HDAC3基因表达对乳腺癌患者预后生存率的影响
miR-502高表达组患者的3年总生存率高于低表达组(P<0.05);HDAC3高表达组患者的3年总生存率显著低于低表达组(P<0.05;表3)。

表3 miR-502、HDAC3基因表达对乳腺癌患者预后的影响 单位:例(%)
3 讨 论
现阶段多数乳腺癌患者在确诊时已处于癌症中晚期,经手术治疗后预后并不理想,因此探寻诊断价值高、可较好反应预后的生物靶点,对乳腺癌筛查、诊治及预后改善具有重要影响,也是现阶段临床妇科分子生物研究关注的重点[10]。microRNA异常表达参与了恶性肿瘤的发生发展,起到抑癌或促癌的作用[11]。
Liu等[12]发现miR-502处理或下调Set8可抑制乳腺癌细胞增殖和细胞周期,减少细胞迁移、侵袭和上皮间质转化,临床分析显示,miR-502在乳腺癌肿瘤组织中的表达低于癌旁组织。HDAC3属于Ⅰ类组蛋白去乙酰化酶,而类组蛋白去乙酰化酶可催化生理过程中的关键蛋白。已有研究证实HDAC3在乳腺癌组织中表达水平高于正常组织,并与乳腺癌患者淋巴结转移及预后密切相关[8]。本研究通过网站预测了miR-502、HDAC3之间存在一定的靶向关系,但需实验验证。
本研究结果显示,乳腺癌组织中miR-502表达水平显著低于癌旁组织,而HDAC3表达趋势与之相反。这与Liu等[12]及林俊杰等[8]报道一致。说明乳腺癌组织中miR-502表达水平下调,HDAC3表达上调,分析原因:①在多种恶性肿瘤组织中,miR-502起到抑癌基因的作用,而HDAC3起到促癌基因的作用,因此在乳腺癌组织中,促癌基因发挥主要调控作用,抑癌基因表达受到抑制;②HDAC3表达上调可能受到乳腺癌组织中miR-502的靶向负调控的影响。结果显示,二者呈负相关,且HDAC3是miR-502的直接靶基因,由此推测miR-502通过靶向负调控HDAC3参与乳腺癌病情的发生发展。
本文结果显示miR-502、HDAC3表达水平与TNM分期、肿瘤直径、淋巴结转移及ER/PR表达情况有关。TNM分期是乳腺肿瘤大小及其是否出现转移的重要体现,而TNM分期Ⅲ~Ⅳ期肿瘤组织中miR-502低表达及HDAC3高表达比较多,说明miR-502可能通过靶向负调控HDAC3抑制乳腺癌细胞的增殖、侵袭及迁移。当ER或PR呈阴性表达时,说明激素已经不能起到治疗乳腺癌的作用,反应乳腺癌的恶化程度较显著[13-14]。这说明随着乳腺癌病理分级及病情的恶化,miR-502呈下调趋势,HDAC3呈上调趋势,其中HDAC3病理分析结果与Zhao等[15]研究类似。
本文结果显示,miR-502、HDAC3及二者联合针对乳腺癌患者具有较好的诊断价值,miR-502高表达组患者的3年总生存率高于miR-502低表达组;HDAC3表达趋势与之相反。结果说明患者癌组织中若miR-502呈低表达及HDAC3呈高表达,可一定程度反应患者预后不良,进一步提示miR-502及HDAC3可能成为乳腺癌治疗的靶标因子。
综上,miR-502在乳腺癌组织中呈低表达水平,HDAC3呈高表达水平,HDAC3是miR-502的直接靶基因,二者之间呈负相关,且与患者病情发展及预后相关,可作为早期诊断乳腺癌的生物学指标。
