禾谷炭疽菌CgRAB4的功能研究
2021-08-18齐尧尧石晓玲
齐尧尧,赵 耀,石晓玲
(1.临沂职业学院,山东 临沂 276017;2.临沂大学农林科学学院,山东 临沂 276000)
0 引言
【研究意义】炭疽菌属(Colletotrichum)是世界植物致病真菌中分布最广、种类最丰富的属之一[1],该属的典型代表禾谷炭疽菌(C.graminicola)是半活体营养病原菌,其引发的叶枯病和茎腐病造成玉米大幅减产,是制约玉米生产的主要因素,严重威胁世界粮食安全[2-3]。禾谷炭疽菌的侵染过程经历了分生孢子的萌发、附着胞的形成、侵入栓的产生、初生侵染菌丝和次生侵染菌丝的形成及侵染过程[4-5]。尽管对禾谷炭疽菌致病的整个过程有了较清晰的认识,但是调控禾谷炭疽菌生长发育和侵染致病过程的具体机制尚不清楚。【前人研究进展】Rab 家族蛋白作为分子开关,能靶定到特异的细胞器上,通过与上游调控因子和下游特定效应子进行互相作用,实现GTP 活性态和GDP 失活态的循环,从而精确调控囊泡运输的各个过程,进而参与真菌的侵染致病过程[6-8]。其成员Rab4 蛋白在哺乳动物和植物中研究较多,有Rab4A、Rab4B 和Rab4C 等3 个亚型,且不同亚型的功能不尽相同,但真菌中发现的Rab4 蛋白只有一个,例如,裂殖酵母中ypt4 主要维持细胞周期发育过程中液泡的大小和稳态[9],而玉米黑粉菌中Rab4 参与调控囊泡的移动和分裂[10]。禾谷炭疽菌中关于Rab4 的功能有待深入研究。【本研究切入点】前期通过生物信息学的方法鉴定到禾谷炭疽菌中有一个Rab4 蛋白(GLRG_08562),333 个氨基酸,含有Rab 蛋白保守的结构域[11],其在禾谷炭疽菌生长发育和侵染致病过程中的作用值得探究。【拟解决的关键问题】本研究利用同源重组的原理对CgRAB4 基因进行敲除,利用潮霉素作为筛选标记且经PCR 验证后获得缺失突变体菌株,进而分析缺失突变体菌株在禾谷炭疽菌菌丝生长、孢子产量、附着胞萌发及对玉米毒性等方面的作用,以期阐明CgRAB4 在禾谷炭疽菌的生长发育和侵染致病过程中的作用,为寻找炭疽病的防控策略提供理论指导。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 禾谷炭疽菌株M2,pCX62 为本实验室课题组保存。
1.1.2 试剂耗材 超保真酶和KOD 酶购自Vazyme公司;2 ×TaqPCR Master Mix、DNA Marker 和核酸染料购自天根公司;溶壁酶、潮霉素和荧光增白剂(Calcofluor White Stain,CFW)购自Sigma 公司;氨苄青霉素和硫酸链霉素购自上海生工生物工程有限公司;刚果红(Congo,CR)和山梨醇(DSorbitol)购自索宝来公司;NaCl、KCl、SDS 购自国药;琼脂糖、TAE 缓冲液配置所需试剂、PCR 管和离心管购自博尚公司;培养皿购自广州杰特公司;疏水载玻片(Gelbond film)购自BMA 公司。
引物合成由上海生工生物工程有限公司完成。
1.1.3 培养基 供试培养基如表1 所示。

表1 供试培养基Table 1 Culture media applied
1.2 方法
1.2.1 同源重组的基本原理 根据同源重组原理,利用潮霉素磷酸转移酶基因(HPH)替代CgRAB4 基因进行敲除,其基本策略如图1A 所示。首先以禾谷炭疽菌基因组DNA 为模板,利用CgRAB4 基因的上游和下游2 000 bp AF/AR 和BF/BR 为引物分别扩增A 片段和B 片段;然后以pCX62 质粒DNA 为模板,以潮霉素内部引物HYG/F 和YG/R、YG/F 和HY/R 为引物分别扩增NH 和HC 片段;最后利用重叠延伸PCR(Splicing by overlap extension,SOE-PCR)扩增AH和HB 片段,50 μL 反应体系包括A 片段和NH 片段(或B 片段和HC 片段)各1 μL、25 μL 2 × Phanta Max Buffer、1.0 μL 10 mmol·L-1dNTP Mix、Primer-AF 和Primer-HY/R(或YG/F 和BR)各2 μL、1.0 μL Phanta Max Super-Fidelity DNA Polymerase、17 μL ddH2O,反应体系如图1-B 所示,将纯化回收的AH和HB 共转化到禾谷炭疽菌的原生质体后最终重组形成A+HPH+B 片段,从而成功敲除掉CgRAB4 基因。

图1 同源重组的敲除策略(A)和SOE-PCR 热循环体系(B)Fig.1 Homologous recombination knockout (A) and SOC-PCR system (B)
1.2.2 禾谷炭疽菌原生质体的制备和转化 原生质体的制备:首先将新活化的野生型菌株M2 切成40 小块,放入200 mL PDB 中,置于28 ℃、150 r·min-1的气浴恒温振荡器中振荡培养36~48 h 后过滤、研磨后收集菌丝,用30 mL·个-1样品的溶壁酶溶液进行 裂 解,30 ℃、90 r·min-1裂解3.5 h。然后利用STC 重悬沉淀和Sorbitol淋洗,最终调整浓度至5 × 107~5 × 108个·mL-1。最后混匀后用剪过尖端的枪头吸取250 μL 原生质体分装至无菌的离心管中。原生质体的转化:通过聚乙二醇(Polyethylene glycol,PEG)介导的转化技术进行转化,即将CgRAB4 的AH 和HB 片段各10 μL 与上述250 μL 原生质体混匀后冰上静置20 min,加入1.5 mL PTC 溶液(40% PTC 3350,50 mmol·L-1Tris-HCl pH8.0,50 mmol·L-1CaCl2)混匀冰上静置20 min,4 000 r·min-1离心10 min 后倒掉上清液,加入5 mL 液体TB3 培养基,30 ℃,90 r·min-1孵育12 h 后与加入35 mL 含有100 mg·mL-1潮霉素的TB3 培养基混合倒下层板,静置20 min 凝固,再在上层倒入50 mL 含有300 mg·mL-1潮霉素的TB3 培养基,于26 ℃的光照培养箱中培养7 d 左右长出转化子。
1.2.3 转化子DNA 的提取和验证 转化子DNA 的提取:首先将大板(15 cm)上长出来的转化子挑取到PDA(6 cm)上培养4 d 左右,然后刮取转化子的菌丝到含有适量石英砂和400 μL DNA 提取buffer(50 mmol·L-1Tris-HCl pH8.0、50 mmol·L-1EDTA pH8.0、2% SDS、0.5 mol·L-1NaCl)的1.5 mL 离心管中,200 r·min-1振荡培养3~4 h;最后用氯仿抽提,70%酒精冲洗DNA,适量无菌水溶解DNA。转化子DNA 的验证:首先用1.0%的琼脂糖凝胶电泳检测提取的DNA,然后用OF/OR 和UAF/H853两对引物从DNA 水平验证转化子。
1.2.4 禾谷炭疽菌菌丝生长相关试验 生长速率测定:首先将新鲜活化的CgM2、△Cgrab4-2、△Cgrab4-7和△Cgrab4-Ect菌株用打孔器获取大小相等的菌丝块,然后分别接种于PDA、CMII 和MK 培养基(9 cm)的正中央,置于26 ℃ 2 000 lx 光照培养箱中培养5 d,最后测量直径拍照。本试验重复3 次,每次每个菌株至少3 个重复。菌丝形态观察:首先分别将CMII 培养基上生长2 d 的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株切取2.0 cm × 0.5 cm菌丝块,然后倒置于干净无菌的载玻片上,最后显微镜下观察菌丝的形态并拍照。生长胁迫试验:首先将新鲜活化的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株用打孔器获取大小相等的菌丝块,然后分别转接到含有0.7 mol·L-1NaCl、0.7 mol·L-1KCl、1 mol·L-1Sorbitol、200 μg·mL-1CFW、200 μg·mL-1CR、0.01% SDS的培养基上,置于26 ℃2 000 lx 光照培养箱中培养5 d,最后测量直径拍照。本试验重复3 次,每次每个菌株至少3 个重复。
抑制率=[(未加抑制剂的菌落直径-添加抑制剂的菌落直径)/未加抑制剂的菌落直径]×100%
1.2.5 禾谷炭疽菌孢子产量统计和形态观察 孢子产量测定:首先将新鲜活化的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株用打孔器获取大小相等的菌丝块,转接3 块到含有氨苄抗生素的50 mL PDB培养基里,于28 ℃ 110 r·min-1振荡培养48 h,最后离心收集孢子,弃上清后加入5 mL无菌ddH2O,混匀后吸取10 μL 到血球计数板上计数,计数所得个数换算成单位面积的产孢量。试验重复3 次,每次每个菌株至少3 个重复。孢子形态观察:将上述计数后的分生孢子置于显微镜下观察拍照。
1.2.6 禾谷炭疽菌附着胞的形成和形态观察 首先将CgM2、△Cgrab4-2、△Cgrab4-7和△Cgrab4-Ect的分生孢子定量至5 × 105个,然后分别吸取15 μL·滴-1到Gelbond film 疏水表面上,置于26 ℃黑暗培养,最后分别于0、6、12、24、48 h 统计孢子和附着胞的萌发率,并于显微镜下观察附着胞形态。其中每个载玻片3 滴,每个样品重复3 次。
1.2.7 禾谷炭疽菌致病力的测定 玉米叶片造伤接种:将生长15 d 左右(三叶一心)的Mo13 玉米叶片取下粘贴于滤纸上,然后用无菌牙签轻轻点击玉米叶片(叶片不能穿透),然后接种大小相等的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌丝块,最后加水浸润滤纸,覆盖保鲜膜于26 ℃黑暗培养24 h后光照培养5 d,观察玉米叶片的发病情况。孢子悬浮液喷雾接种玉米叶片:将定量好的分生孢子悬浮液(加吐温)喷雾接种于三叶一心的玉米叶片上,黑暗处理24 h 后,26 ℃光照培养7 d,观察玉米叶片的发病情况。
2 结果与分析
2.1 CgRAB4 缺失突变体相关引物的设计
本研究利用primer5 设计引物,具体的序列如表2 所示。

表2 供试引物序列Table 2 Sequence of primer employed
2.2 SOE-PCR 扩增获得CgRAB4 缺失突变体的长片段
SOE-PCR 在设计引物时有两条是常规的引物,另外两条引物是特殊设计的,其序列上一端与自身的目的片段互补,另外一端却是另外一段目的基因的序列(表2)。两段基因的引物经过各自的PCR克隆后,在各自的产物其中的一端加上特别的接头。利用接头的特异互补进行PCR 扩增,从而将两段PCR 产物连接到了一起,形成了不靠限制性内切酶连接的杂交基因片段。
利用PCR 扩增CgRAB4 的上游A 片段、下游B片段、潮霉素NH 片段和潮霉素HC 片段,然后将PCR产物用1.0%琼脂糖凝胶电泳检测,上样3.0 μL,结果如图2 所示,得到A 片段大小为783 bp,介于750~1 000 bp,B 片段大小为1 048 bp,略高于1 000 bp 的条带,而NH 片段(768 bp)和HC 片段(918 bp)的片段也大小正确,条带单一。然后将获得的A 片段、NH 片段、B 片段和HC 片段,通过SOE-PCR 扩增AH片段和HB片段,扩增得到AH(1 582 bp)和HB(1 966 bp)条带单一大小正确,可用于后续转化试验。
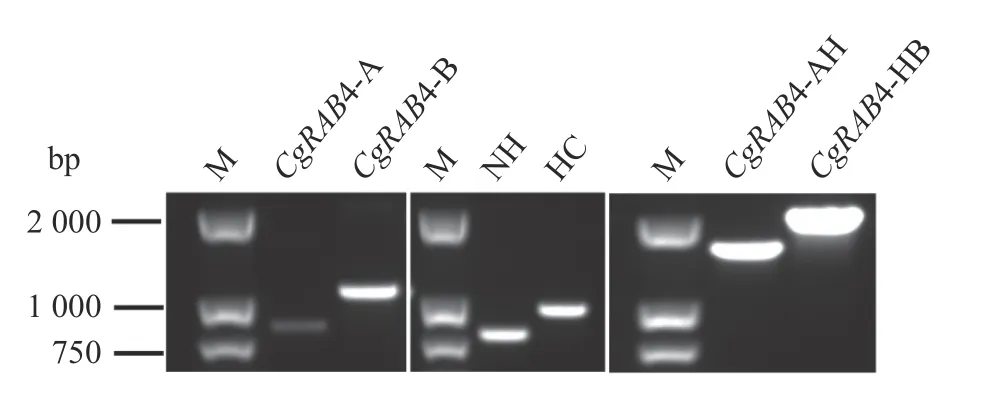
图2 SOE-PCR 扩增AH 和HBFig.2 SOE-PCR amplifications of AH and HB
2.3 CgRAB4 敲除转化子的筛选验证
本试验共转化了2 批,共得到了11 个转化子。提取DNA 后利用CgRAB4 基因ORF 内部一对引物OF/OR、AF 上游一条引物UAF 与潮霉素基因内部一条特异性引物H853(UA)对11 个候选转化子进行DNA 水平的验证。结果如图3 所示,凡是ORF 无阳性扩增(503 bp)且UA 有阳性扩增(1 475 bp)的转化子即为敲除突变体,共获得Cgrab4-2、Cgrab4-6、Cgrab4-7 三个敲除突变体。而ORF 未被潮霉素基因替换,即ORF 有阳性扩增,且潮霉素基因随机整合到基因组具备潮霉素抗性但UA 无阳性扩增的转化子即为异位整合突变体,共获得Cgrab4-1 一个异位整合突变体。本试验取缺失突变体Cgrab4-2、Cgrab4-7 和异位整合突变体Cgrab4-1 用于后续的表型分析试验。
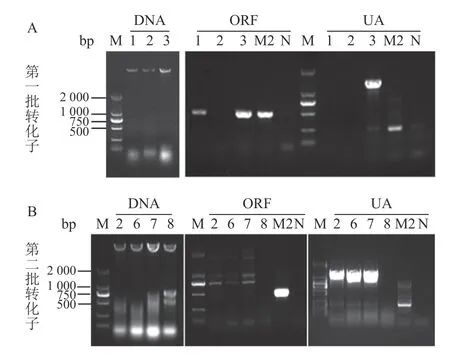
图3 转化子的DNA 提取与验证Fig.3 DNA extraction and verification on transformants
2.4 CgRAB4 缺失对禾谷炭疽菌生长发育的影响
将CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株分别于CMII、PDA 和MK 培养基上培养,6 d后测量直径,结果发现与CgM2 相比,缺失突变体△Cgrab4-2、△Cgrab4-7 的生长速率略微加快(图4-A和4-B);将培养基纵切,观察到野生型和缺失突变体的气生菌丝量没有显著变化(图4-A);异位整合突变体△Cgrab4-Ect与野生型CgM2 的生长速率和气生菌丝与野生型无明显变化。进一步观察菌丝的形态发现,与野生型CgM2 相比,CgRAB4 缺失突变体和异位整合突变体的菌丝形态没有变化,都产生细长的菌丝(图4-C)。以上结果表明CgRAB4 缺失后促进了菌丝的生长,但并不影响菌丝的形态发育。

图4 禾谷炭疽菌CgRAB4 缺失突变体的生长发育Fig.4 Development of CgRAB4-deleted mutants
2.5 CgRAB4 缺失对禾谷炭疽菌胁迫响应的影响
胞吞过程在真菌细胞应对各种环境刺激和胁迫的过程中发挥了至关重要的作用,而Rab 蛋白调控胞吞过程,因此本研究分析了CgRAB4 应对高渗胁迫和细胞壁抑制剂条件下的生长情况。结果发现,无论是在CMII培养基(图5-A)还是PDA培养基(图5-C)上,与野生型CgM2 相比,CgRAB4 缺失后菌落生长略有增长,抑制率都略有增加(图5-B、D),表明CgRAB4不参与调控外界胁迫的响应过程。

图5 CgRAB4 缺失突变体胁迫响应试验Fig.5 Stress responses of CgRAB4-deleted mutants
2.6 CgRAB4 缺失对禾谷炭疽菌孢子产量和形态的影响
进一步对CgRAB4 缺失突变体和异位整合突变体的产孢量进行统计,结果如图6-A 所示,与野生型相比,CgRAB4 缺失突变体中孢子量没有变化。观察孢子形态发现,与野生型一样,CgRAB4缺失突变体也会产生镰刀型分生孢子,形状和大小并无变化,表明CgRAB4 不参与调控禾谷炭疽菌分生孢子的产生和发育过程。
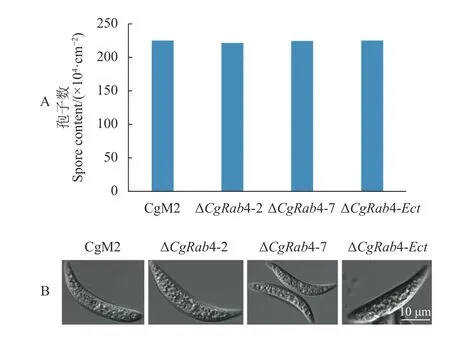
图6 CgRAB4 缺失突变体产孢量和孢子形态Fig.6 Conidiations and spore morphology of CgRAB4-deleted mutants
2.7 CgRAB4 缺失对禾谷炭疽菌附着胞的影响
通过对分生孢子萌发形成附着胞的过程进行观察,与野生型一样,CgRAB4 缺失突变体在6 h 后分生孢子会在两端或中间进行萌发,12 h 后产生近球状的附着胞(图7),48 h 几乎全部萌发产生附着胞。此外,两者的菌丝顶端都可以直接萌发产生多边形不规则的附着胞,表明CgRAB4 不参与禾谷炭疽菌分生孢子和附着胞的发育过程。

图7 CgRAB4 缺失突变体的孢子萌发和附着胞形态Fig.7 Spore germination and appressorium morphology of CgRAB4-deleted mutants
2.8 CgRAB4 缺失对禾谷炭疽菌致病性的影响
为了明确CgRAB4 是否参与禾谷炭疽菌的致病过程,本试验通过对玉米叶片进行造伤接种(图8-A)和喷雾接种(图8-B),结果发现,与野生型CgM2一样,CgRAB4 缺失突变体能在玉米叶片上造伤口附近产生梭形的扩展斑(图8-A),喷雾接种到玉米叶片上,病斑连接成片,玉米叶片发黄,表明CgRAB4并不参与调控禾谷炭疽菌的致病过程。

图8 CgRAB4 缺失突变体对玉米的致病性Fig.8 Pathogenesis of CgRAB4-deleted mutants on corn
3 讨论与结论
前期生物信息学鉴定出禾谷炭疽菌共有10 个Rab候选蛋白[11],其成员之一Rab4 在动物、植物和真菌中均有研究[12-14],主要定位于网格包被囊泡、早期内涵体和循环囊泡上,有Rab4A、Rab4B 和Rab4C等3 个亚型,Rab4A 的同源基因存在于人类、斑马鱼等生物中,Rab4B 在裂殖酵母等高等多生物中均存在同源基因,而目前Rab4C 的结构与功能尚不清楚[15],是货物循环和内涵体分选的关键调控因子[16]。例如,在人类细胞中,Rab4 与效应蛋白Rabenosyn-5 相互作用参与货物从早期内涵体到质膜的循环[17];Rab4 与Rab5 共同参与非洲爪蟾视觉系统中突触的伸长过程[18];拟南芥中的Rab4b 极性定位于根毛细胞[19],其效应蛋白PI-4Kβ1 通过新同源结构域IIIβ PI-4Ks 与Rab4b 相互作用,并利用NH2 末端与AtCBL1 相互作用,从而将Ca2+通道和PI-4,5P2 信号通路建立联系,进而调控根毛细胞顶端细胞壁成分的极性分泌[14]。到目前为止,真菌中仅报道了裂殖酵母和玉米黑粉菌中均只有一个Rab4 蛋白,分别维持细胞周期发育过程[9]和液泡的大小以及稳态[10],但在真菌的生长发育和侵染致病过程的作用尚有待深入研究。因此对不同真菌中Rab4 功能的研究有助于揭示Rab4 蛋白的保守型和功能差异性,对禾谷炭疽菌中CgRAB4的研究能丰富Rab4 在真菌中的研究,并为Rab 蛋白的功能研究提供理论支持。
为进一步分析Rab4 是否参与调控禾谷炭疽菌的生长发育和侵染致病过程,本研究首先根据同源重组的原理对CgRAB4 基因进行敲除,利用SOE-PCR扩增长片段AH 和HB,将其共同转化至禾谷炭疽菌的原生质体中,经潮霉素抗性筛选和PCR 验证,成功获得3 个缺失突变体和1 个异位整合突变体。然后分析CgRAB4 缺失突变体在菌丝生长发育、产孢和孢子萌发、对玉米致病力等方面的作用,发现与野生型CgM2 相比,CgRAB4 缺失后促进了禾谷炭疽菌的生长,但不影响菌丝的形态,且不参与调控外界胁迫的响应过程,孢子产量和形态、附着胞的发育以及对玉米的致病力都没有明显变化,表明CgRAB4可能只参与调控禾谷炭疽菌的生长过程。
本研究中只进行了两次禾谷炭疽菌原生质体的转化,共获得11 个候选转化子,转化效率不是很高,但经验证后得到3 个缺失突变体,CgRAB4 基因敲除的效率却较高。另外本研究对CgRAB4 基因进行回补,经过多次尝试均未获得互补突变体。本研究对CgRAB4 功能的初探有助于解析Rab4 调控禾谷炭疽菌的致病机理,也丰富了Rab4 蛋白在真菌中的研究,为寻找炭疽病的防控策略提供理论指导。
