湖北道地药材贝母ISSR反应体系优化及多态性引物筛选
2021-08-18蒋小刚郭坤元张美德
蒋小刚,王 华,郭坤元,张美德
(湖北省农业科学院中药材研究所/国家中药材产业技术体系恩施综合试验站/湖北省农业科技创新中心中药材分中心,湖北 恩施 445000)
0 引言
【研究意义】湖北贝母(Fritillaria hupehensisHsiao et K.C.Hsia)属于百合科贝母属多年生草本植物,主要分布于湖北西南部,在恩施、建始、五峰等地有大面积种植,距今已有200 多年的栽培历史,是湖北省道地药材之一[1-2]。湖北贝母鳞茎中含有活性成分生物碱,牛换云等[3]通过体外抑菌试验发现湖北贝母总生物碱及单体生物碱对革兰氏阳性菌的抑菌作用强于革兰氏阴性菌,表明湖北贝母总生物碱以及单体生物碱均有一定的抑菌活性;张勇慧等[4]以小鼠为研究对象,发现湖北贝母生物碱单体比如鄂贝甲素、湖贝甲素苷具有镇咳祛痰的功效。随着研究的不断深入,湖北贝母的药用价值逐渐得到了人们的认可,《中华人民共和国药典》最新几版均收载了湖北贝母,使其成为国家法定中药材[5]。湖北贝母以干燥鳞茎入药,具有清肺化痰、止咳、散结的功能,主要用于治疗热痰咳嗽,痰核瘰疬,痈肿疮毒等症状[6-7]。近年来,中药材产业正处于蓬勃发展阶段,巨大利益驱动下湖北贝母等药材市场出现品种混杂、质量参差不齐的现象。因此,构建高效快捷的鉴别体系对于湖北贝母的鉴定及资源保护具有重要意义。【前人研究进展】ISSR 分子标记是一种基于微卫星序列开发的新型分子标记技术,该方法操作简单,尤其适用于检测基因组序列未知的物种的多样性[8-9]。余志雄等[10]采用单因素试验结合正交设计的方法,建立了火龙果ISSR-PCR优化体系,并发现相比于DNA 模板含量,dNTP、引物和TaqDNA 聚合酶含量对ISSR-PCR 反应影响更大;采用上述建立的优化体系,袁亚芳等[11]对福建地区20 份火龙果种质进行遗传多样性分析,初步揭示了不同地区种质亲缘关系,为火龙果种质鉴定和品种选育提供价值;张立杰等[12]采用正交设计的方法优化莲雾ISSR-PCR 反应体系,发现引物浓度是影响PCR 的最重要因素,建立的优化体系将为莲雾种质资源评价、优良品种选育等提供科学依据。何桥等[13]用建立的优化体系将14 份莲雾种质聚类为4 组,与按照果实成熟期的划分结果基本一致。此外,在白术[14]、淫羊藿[15]、猕猴桃[16]等药用植物也开展了ISSR-PCR 优化体系的研究,这些研究将为药用植物的种质资源鉴定、亲缘关系、遗传多样性分析、良种选育等提供科学依据。【本研究切入点】目前在湖北贝母的研究多集中于生态种植、病虫害防治、药理药效等方面[7,17],湖北贝母遗传多样性分析的研究有待深入探讨,因此亟需进行湖北贝母的遗传多样性分析。【拟解决的关键问题】本研究拟采用均匀设计和单因素试验结合的方法,进行湖北贝母ISSR-PCR 体系优化、多态性引物筛选及遗传多样性分析,为湖北贝母种质鉴定及品种选育奠定研究基础。
1 材料与方法
1.1 供试材料
供试材料采集于恩施市新塘乡湖北贝母资源圃,包括湖北恩施市、利川市、建始县等产地的12 份湖北贝母叶片样品,产地信息见表1,随机选取每个产地3 株植株的幼嫩叶片作为一份样品,装入自封袋中,回实验室后,保存于-20 ℃冰箱备用。

表1 12 份湖北贝母种质资源产地Table 1 Producing areas of 12 F.hupehensis germplasms
1.2 试剂与仪器
供试的ISSR 引物参照加拿大哥伦比亚大学(UBC)设计的100 条引物序列,由上海英俊生物技术公司合成,核酸染料Gel-red 以及2×TaqMaster Mix均购自武汉中恩科技有限公司。主要仪器设备:离心机(SIGMA 3K15)、电泳仪(DYCP-31DN)、超微量核酸测定仪(Thermo NANODROP ONE)、PCR 仪(DYY-12)。
1.3 基因组DNA 提取与检测
采用北京天根生物科技有限公司的新型植物DNA提取试剂盒,提取12 份湖北贝母叶片基因组DNA,通过分光光度法和琼脂糖凝胶电泳对DNA 的浓度和质量进行检测,保存于-20 ℃冰箱备用。
1.4 ISSR-PCR 体系均匀设计
均匀设计原理是基于数论中的一致分布理论,将数论和多元统计相结合,充分考虑试验点在试验范围内的“均衡分散”性,使试验点均匀分布[18]。本研究采用3 因素4 水平的U12(43)均匀设计表设计PCR体系各因素水平(表2、表3),以引物UBC873 为例,DNA 模板浓度为50 ng·μL-1,引物浓度为2.5 μmol·L-1,通过12 个20 μL 反应体系,筛序较优ISSR-PCR 体系。PCR 程序:(1)94 ℃,预变性5 min;(2)94 ℃,变性0.75 min,52 ℃,复性0.75 min,延伸1.5 min,共40 个循环;(3)最后72 ℃延伸10 min,4 ℃保存。
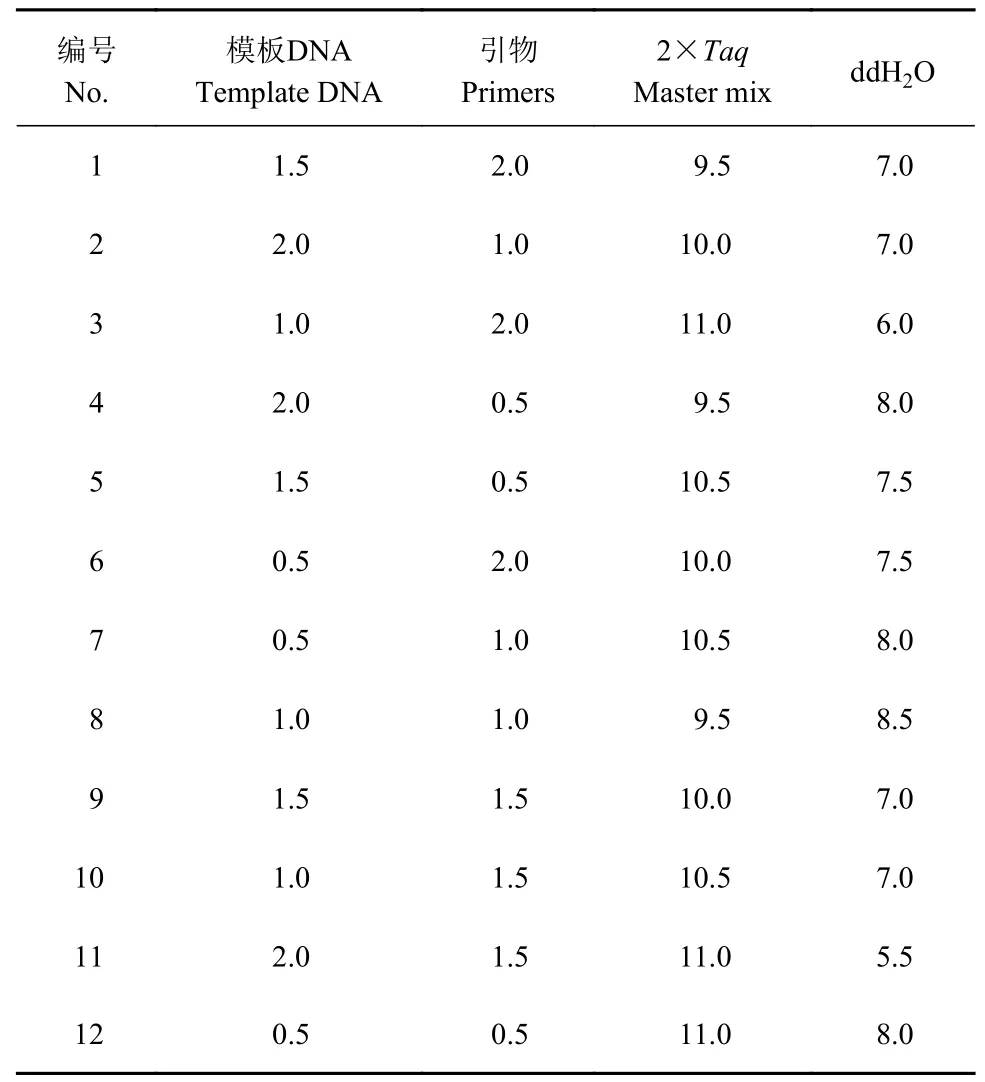
表3 ISSR-PCR 均匀设计U12(43)Table 3 Mixed uniform design U12(43)for ISSR-PCR (单位:μL)
1.5 ISSR-PCR 体系单因素试验
基于U12(43)均匀设计试验确定的较优ISSRPCR 体系,进行2×TaqMaster mix(表4)、模板DNA(表5)、引物(表6)的单因素试验,反应体系20 uL,PCR 程序同 ISSR-PCR 体系均匀设计。

表4 2×Taq Master mix 的单因素试验设计Table 4 Single factor screening test on 2×Taq Master Mix (单位:μL)

表5 模板DNA 的单因素试验设计Table 5 Single factor screening test on DNA (单位:μL)
1.6 最佳退火温度确定
基于优化的ISSR-PCR 体系筛选ISSR 引物的最佳退火温度,基于引物TM 值设置8 个退火温度,PCR 程序其他条件同上。
1.7 最优反应体系验证
基于优化的ISSR-PCR 体系,用引物UBC866 对12 份不同产地的湖北贝母资源进行优化体系验证,优化体系(20 μL):DNA 模板0.8 uL(40.0 ng),2×TaqMaster mix 10.5 μL,引 物2.2 μL(5.5 μmol),ddH2O 6.5 μL。PCR 程序:(1)94 ℃,预变性5 min;(2)94 ℃,变性0.75 min,60.0 ℃,退火0.75 min,延伸1.5 min,共40 个循环;(3)最后72 ℃延伸10 min,4 ℃保存。
2 结果与分析
2.1 基因组DNA 提取及检测
由图1 可知,提取的12 份湖北贝母基因组DNA条带清晰,无拖尾,中药材条形码ITS2引物都扩增出500 bp 左右的片段,条带清晰明亮(图2),表明提取的湖北贝母基因组DNA 质量高,可用于后续ISSR-PCR 体系建立与优化。

图1 12 份湖北贝母基因组DNA 电泳图Fig.1 DNA electrophoretograms of 12 F.hupehensis germplasms

图2 12 份湖北贝母ITS2 扩增结果Fig.2 ITS2 amplifications on 12 F.hupehensis germplasms
2.2 均匀设计优化ISSR-PCR体系
以湖北贝母基因组DNA 为模板,UBC873 为扩增引物,采用均匀设计U12(43)方法建立ISSRPCR 体系,每个处理设置3 个重复(表3)。图3 结果表明,除处理4、5、12 外,其他处理各重复都扩增出5 个条带,而处理6 扩增条带最亮,重复性好,且2×TaqMaster mix 用量较少,综合考量条带数量、亮度、2×TaqMaster mix 用量、重复性等因素,选择处理6 作为ISSR-PCR 初步较优体系。

图3 ISSR-PCR 均匀设计U12(43)扩增结果Fig.3 Results of U12(43) uniform design experiment for ISSR-PCR
2.3 单因素试验优化ISSR-PCR 体系
2.3.1 2×TaqMaster mix 的单因素试验 在均匀设计处理6 的基础上进行2×TaqMaster mix 的单因素试验(表4),每个处理3 个重复。由图4 可知,各处理的3 个重复都能扩增出5 条带,而处理4 的3 个重复整体的条带亮度和清晰度都最高,因此10.5 uL 为2×TaqMaster mix 的单因素试验的最佳用量。
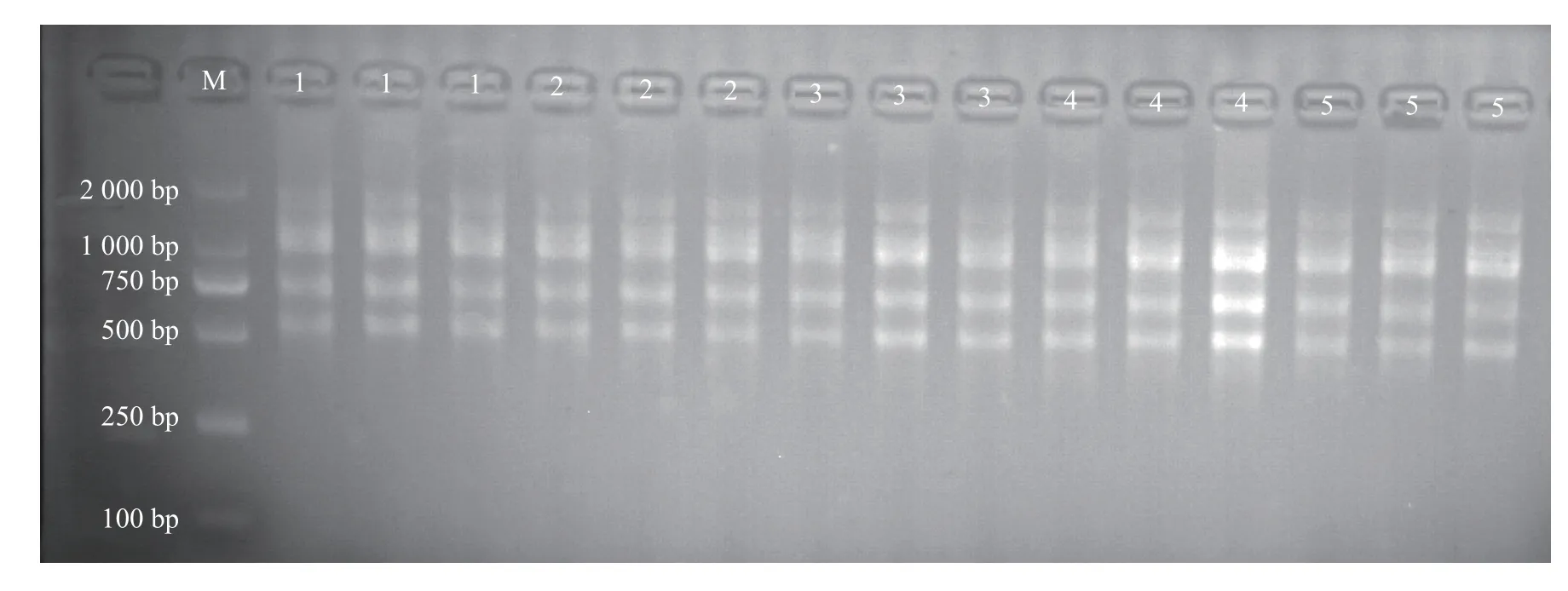
图4 2×Taq Master mix 单因素试验设计的ISSR-PCRFig.4 ISSR-PCR of single factor screening test on 2×Taq Master Mix
2.3.2 模板DNA 的单因素试验 在2×TaqMaster mix的单因素试验的处理4 基础上,进行模板DNA 的单因素试验(表5),由图5 可知,各处理都能扩增出5 条清晰条带,处理3、4、5、6 条带亮度基本一致,考虑DNA 用量的经济适用性,处理3 为最优处理,即0.8 μL(40.0 ng)为模板DNA 的单因素试验的最佳用量。

图5 模板DNA 的单因素试验设计的ISSR-PCRFig.5 ISSR-PCR of single factor screening test on DNA
2.3.3 引物的单因素试验 在模板DNA 的单因素试验处理3 的基础上,进行引物的单因素试验设计(表6),由图6 可知,处理5 整体条带亮度和清晰度都高于其他各处理,表明2.2 μL 为引物单因素试验最佳用量。

图6 引物的单因素试验设计的ISSR-PCRFig.6 ISSR-PCR of single factor screening test on DNA
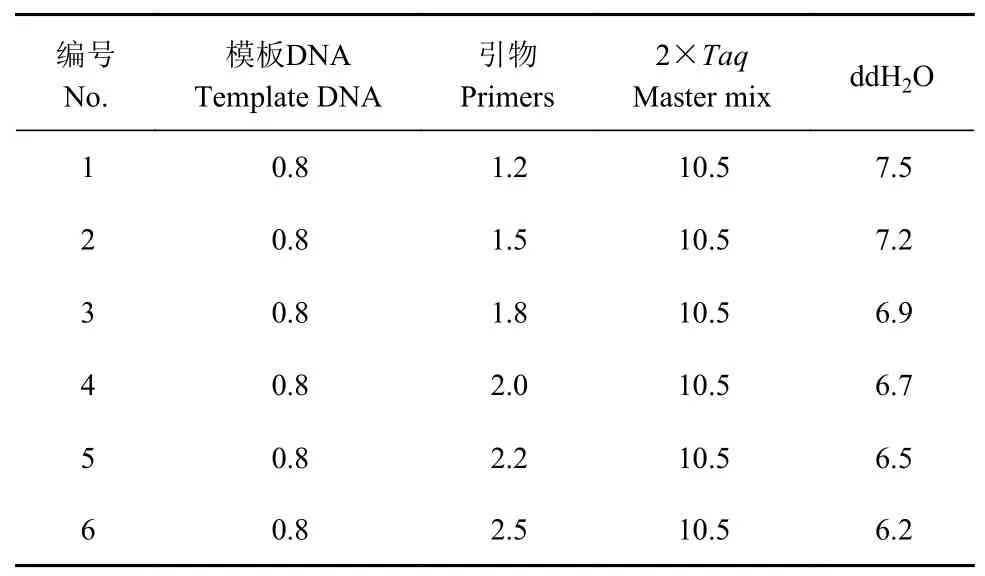
表6 引物的单因素试验设计Table 6 Single factor screening test on primers (单位:μL)
2.4 最佳退火温度的确定
基于优化的ISSR-PCR 体系通过梯度退火温度试验确定引物的最佳退火温度,以引物UBC848 为例(图7),退火温度为59.3 ℃时,引物UBC848 扩增的条带数最多,且条带最明亮清晰,退火温度过高或过低时,条带数和清晰度明显降低,表明引物UBC848 的最佳退火温度为59.3 ℃,其余引物的最佳退火温度见表7。

图7 引物UBC848 不同退火温度扩增Fig.7 Amplification of primer UBC848 at different annealing temperatures
2.5 优化体系验证
优化的ISSR-PCR 体系(20 μL):2×TaqMaster mix 10.5 μL,模板DNA 0.8 μL(40.0 ng),引物2.2 uL(5.5 μmol),ddH2O 6.5 μL。用表7 筛选的多态性引物对表1 的12 份湖北贝母资源进行优化体系验证。图8 为引物 UBC866 的扩增结果,可见扩增条带清晰,多态性丰富,表明优化的ISSR-PCR 体系稳定可靠,可用于湖北贝母ISSR 分析。

图8 引物 UBC866 对12 份湖北贝母资源的扩增结果Fig.8 Amplification results of 12 F.hupehensis germplasms by primer UBC866

表7 ISSR 引物最佳退火温度Table 7 Optimum primer annealing temperature
2.6 遗传多样性分析结果
采用NTSYS-pc2.1 分析12 份湖北贝母种质遗传相似系数。如表8 所示,各种质间遗传相似系数范围为0.542 9~0.942 9,其中FH3 和FH5,FH1 和FH12的遗传相似系数最大,都为0.942 9,表明FH3 和FH5,FH1 和FH12 的亲缘关系最近;其中FH8 和FH11 的遗传相似系数最小,为0.542 9,表明FH8 和FH11 的亲缘关系最远。采用UPGMA 聚类法对供试材料进行聚类分析,由图9 知,遗传相似系数为0.75 时,可将12 份湖北贝母种质聚为3 类,第一类包括FH1、FH2、FH3、FH5、FH6、FH7、FH11、FH12,第二类包括FH4、FH8、FH9,第三类包括FH10。

图9 12 份湖北贝母种质聚类分析Fig.9 Cluster diagram of 12 F.hupehensis germplasms

表8 12 份湖北贝母遗传相似系数Table 8 Genetic similarity coefficients of 12 F.hupehensis germplasms
3 讨论与结论
ISSR 分子标记技术已被广泛应用于植物、微生物的种质资源鉴定、遗传多样性分析等研究中,相比传统分子标记,ISSR 分子标记具有数量多、易检测、成本低的优势[16]。ISSR-PCR 反应易受酶、DNA模板、引物等因素的综合影响,因此需要对反应体系进行优化。目前,很多研究采用正交设计和单因素试验的方法优化ISSR-PCR 体系[19],而本研究采用的是均匀设计结合单因素试验,在原理上,均匀设计与正交设计相似,能均衡考虑各因素的影响,简化试验程序和步骤[14,18],但相比于多数研究采用的L16(45)正交试验设计[19-20],本研究采用的U12(43)均匀设计在保证实验结果的基础上,能减少工作量和节省时间。
DNA 模板、Taq酶、Mg2+、dNTP 等是PCR 扩增反应的重要因素,本研究中,用2×TaqMaster mix代替了Taq酶、Mg2+、dNTP、缓冲液。单因素试验结果表明,DNA 模板及引物用量对反应结果影响最大,DNA 模板和引物含量过低会降低反应效率,过高导致非特异性扩增,这与丁雯等[20]研究结果一致。2×TaqMaster mix用量也是较为重要的影响因素,随着2×TaqMaster mix 用量增加,条带亮度缓慢升高,继续增加至一定量时,条带亮度降低,这与郭傲等[21]研究结果较为一致,表明2×TaqMaster mix 浓度过低时,合成产物较少,浓度过高时,会导致非特异性扩增,条带清晰度降低。
研究表明引物的退火温度高低对扩增结果影响较大。退火温度过高,引物与模板不易结合,导致扩增效率降低;退火温度过低,引物与模板易错配结合,出现非特异性扩增,表现拖尾现象[22]。本研究基于优化的ISSR-PCR 体系通过梯度退火试验筛选引物的最佳退火温度,结果表明,筛选的大部分引物最佳退火温度值整体较高,在一定范围内随着退火温度的升高,条带数和清晰度逐渐增加,而当退火温度升高至一定值后,条带数和清晰度减小,这与闫林等[23]研究结果较为一致,表明筛选的引物基本都能适应较高的退火温度。基于优化的ISSRPCR 体系,通过梯度退火温度试验筛选引物的最佳退火温度,用筛选后的引物U866 对12 份湖北贝母资源进行ISSR-PCR 优化体系验证,结果表明,优化体系扩增的条带清晰稳定,多态性较好,适用于遗传多样性分析。
聚类分析可将供试种质聚为3 类,表明筛选的多态性ISSR 引物适用于区分不同种质遗传差异,供试种质亲缘关系无地域性差异,这与浙贝母、新疆贝母的遗传多样性研究结果存在差异[24-25],此类差异形成原因可能与不同贝母属种质遗传稳定性、采样地点、采样数量等有关。本研究结果将为湖北贝母种质鉴定及良种选育提供参考依据。
