新型鹅星状病毒RT-PCR检测方法的建立及初步应用
2021-08-18余明兴林裕胜
余明兴,林裕胜
(1.福建省浦城县动物疫病预防控制中心,福建 浦城 353400;2.福建省农业科学院畜牧兽医研究所,福建 福州 350013)
0 引言
【研究意义】2017 年以来,我国江苏、河南、河北、广东、福建、安徽、浙江等多省养鹅场暴发了由新型鹅星状病毒引起的雏鹅痛风病。该病主要发生于5~20 日龄雏鹅,临床症状主要表现为站立不稳、消瘦、精神沉郁、采食量下降,剖检可见肾脏、肝脏及关节处有尿酸盐沉积,其发病率在30%左右,死亡率最高可达50%[1-3],给我国养鹅业造成了巨大的经济损失。福建省是鹅星状病毒病的首发疫区之一。鉴于目前市面上尚无可预防或治疗该病的相关疫苗或药物,使得该病的防控异常困难。因此,建立一种快速检测新型鹅星状病毒的检测方法对于该病早期诊断显得尤为重要。【前人研究进展】鹅星状病毒属于星状病毒科(Astroviridae)禽星状病毒属(Avastrovirus),经基因组解析后发现与火鸡星状病毒和鸭星状病毒有明显不同,属于新的基因型,因此当前命名为新型鹅星状病毒[4-5]。目前新型鹅星状病毒的诊断方法主要有分离鉴定法、电镜观察法、常规PCR 法、LAMP 法和荧光定量PCR 法[6]。分离鉴定法主要通过接种鹅胚或鹅胚肾细胞,一般需要传至3 代左右才可出现鹅胚死亡或出现明显病变,比较耗费时间。电镜观察法是星状病毒早期的检测方法之一,然而Yuan等[7]使用鹅肝脏超薄切片进行观察,却无法观察到星状病毒特有的形态,因此该方法存在一定的缺陷。在分子诊断技术方面,前人也进行了相关研究,如张玉霞等[8]基于ORF1b基因建立的LAMP 检测方法,邱思语等[9]基于ORF1b建立的SYBR Green I 荧光定量RT-PCR方法,白彩霞等[10]基于ORF2 建立的SYBR Green I 荧光定量RT-PCR方法,Yuan 等[11]基于ORF1b建立的TaqMan 实时荧光定量RT-PCR 方法。分子生物学方法是目前病原检测应用最广泛的一种方法,尤其是PCR 技术,因能检测到微量的病原DNA 而常应用于病原体的早期检测,与分离培养法、电镜分离法、ELISA 法和免疫荧光检测法等相比具有一定优势[12]。姜胜男等[13]、蒲路莎等[14]研究表明当前流行的新型鹅星状病毒毒株之间ORF2 核苷酸编码的氨基酸同源性高达99.4%以上,保守性较高,适合作为病原诊断靶基因。【本研究切入点】为进一步扩展新型鹅星状病毒的检测方法,本研究根据新型鹅星状病毒ORF2基因为靶基因建立新型鹅星状病毒 RTPCR 检测方法。【拟解决的关键问题】本研究利用Oligo 7 软件设计并筛选出1 对特异性引物,建立适用于检测新型鹅星状病毒的RT-PCR 方法,为新型鹅星状病毒病临床样品的快速检测和流行病学调查提供技术支持。
1 材料与方法
1.1 试验材料
1.1.1 毒株及临床样品 新城疫病毒(Newcastle disease virus,NDV)、禽呼肠孤病毒(Avian reovirus,ARV)、鹅细小病毒(Goose parvovirus,GPV)、鹅多瘤病毒(Goose hemorrhagic polyomavirus,GHPV)、鹅圆环病毒(Goose vircovirus,GoCV)和新型鹅星状病毒等DNA 或cDNA 由福建省农业科学院畜牧兽医研究所动物病毒研究室提供。45 份临床样品于2019–2020 年期间采自福建省浦城县,均为临床上疑似鹅痛风的脾、肾组织和关节液,发病鹅表现为关节肿大,剖检肾脏表面可见大量尿酸盐沉积。
1.1.2 主要试剂 病毒RNA/DNA 提取试剂盒、反转录试剂盒均购自北京全式金生物技术有限公司;Ex TaqDNA 聚合酶、DL2000、DL1000 Marker 均购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 引物设计合成 根据GenBank 登录的新型鹅星状病毒SDXT 株(No.MN399857)ORF2 基因序列,利用Oligo 7 软件设计并筛选出1 对特异性引物,引物的核苷酸序列为:P1:5′-ATGAAGGCCGAGAG GAAGCTT -3′;P2:5′-GTTCAAGATGCGGCCGA GC -3′。扩增片段大小为384 bp。引物由福州博尚生物有限公司合成。
1.2.2 核酸抽提 利用病毒DNA/RNA 提取试剂盒、参照说明书分别提取供试病毒和临床样品的DNA 和RNA,用作PCR 反应的模板。
1.2.3 反应条件及优化 cDNA 合成按照全式金生物技术有限公司反转录试剂盒操作手册进行。反应程序:25 ℃ 10 min,42 ℃ 15 min,85 ℃ 5 s,4 ℃ 终止反应。PCR 扩增采用 25 μL 体系,Premix 12.5 μL,反转录产物 cDNA 2 μL,上下游引物浓度采用矩阵法在0.4~1.2 μmol·L-1调整,无菌去酶水补足20 μL。PCR 反应程序:扩增条件为 95 ℃ 5 min 热启动,94 ℃变性15 s,退火温度在50 ℃~60 ℃调整 15 s,72 ℃延伸15 s,35 个循环,72 ℃ 延伸 7 min。待反应结束后取 PCR 产物 7 μL,1.5%琼脂凝胶电泳检测,在凝胶成像系统扫描仪下观察拍照。扩增的特异性片段割胶回收后纯化,再送测序公司测序,通过Blast比对验证扩增片段的正确性。
1.2.4 特异性试验 应用建立的 RT--PCR 方法扩增新城疫病毒、禽呼肠孤病毒、鹅细小病毒、鹅多瘤病毒、鹅圆环病毒,检验建立方法的特异性效果。
1.2.5 敏感性试验 将反转录得到的新型鹅星状病毒cDNA(原液浓度为62 ng·μL-1)进行10 倍递增稀释,共稀释成9 个浓度梯度,分别为6.2 ng·μL-1、620 pg·μL-1、62 pg·μL-1、6.2 pg·μL-1、620 fg·μL-1、62 fg·μL-1、6.2 fg·μL-1、620 ag·μL-1、62 ag·μL-1,利用优化好的方法进行扩增,检验该方法的敏感性。
1.2.6 重复性试验 利用建立的新型鹅星状病毒RTPCR 方法对3 份新型鹅星状病毒分离株cDNA 进行 3次 RT--PCR 扩增。进行批内重复试验时,每次样品均设3 个重复;进行批间重复试验时,3 份新型鹅星状病毒cDNA 样品间隔5 d 检测1 次,共检测3 次。
1.2.7 RT-PCR 方法初步应用 利用建立的RT-PCR方法对从浦城采集的45 份临床样品进行检测,同时设置新城疫病毒和鹅细小病毒做阴性对照。
2 结果与分析
2.1 RT-PCR 反应条件的优化及扩增产物的鉴定
RT-PCR 最佳反应体系为:Premix 10 μL,ORF2上下游引物浓度10 μmol·L-1各1 μL,模板3 μL,无菌去离子水补足至20 μL。最佳反应程序为:94 ℃2 min;94 ℃ 30 s、55 ℃ 15 s、72 ℃ 15 s,30 个 循环;72 ℃ 10 min。应用优化后的体系对新型鹅星状病毒进行扩增,并对扩增产物进行测序,结果显示,新型鹅星状病毒经琼脂糖凝胶电泳扩增出1 条约380 bp 的目的片段,与预期大小一致(图1)。测序结果显示,RT-PCR 扩增的新型鹅星状病毒ORFV基因序列长度为384 bp,与参考的MN399857 株序列同源性为99.8%,与预期结果相符。

图1 新型鹅星状病毒ORF2 基因的RT-PCR 扩增结果Fig.1 Amplification on ORF2 of NGAstV by RT-PCR
2.2 特异性扩增
利用建立的RT-PCR 检测方法对新型鹅星状病毒、新城疫病毒、禽呼肠孤病毒、鹅细小病毒、鹅多瘤病毒、鹅圆环病毒的核酸进行检测,同时设置空白对照。结果显示,仅新型鹅星状病毒扩增出与预期大小相符的目的条带,而新城疫病毒、禽呼肠孤病毒、鹅细小病毒、鹅多瘤病毒、鹅圆环病毒和去离子水样品均为阴性(图2),表明建立的RTPCR 方法具有良好的特异性。
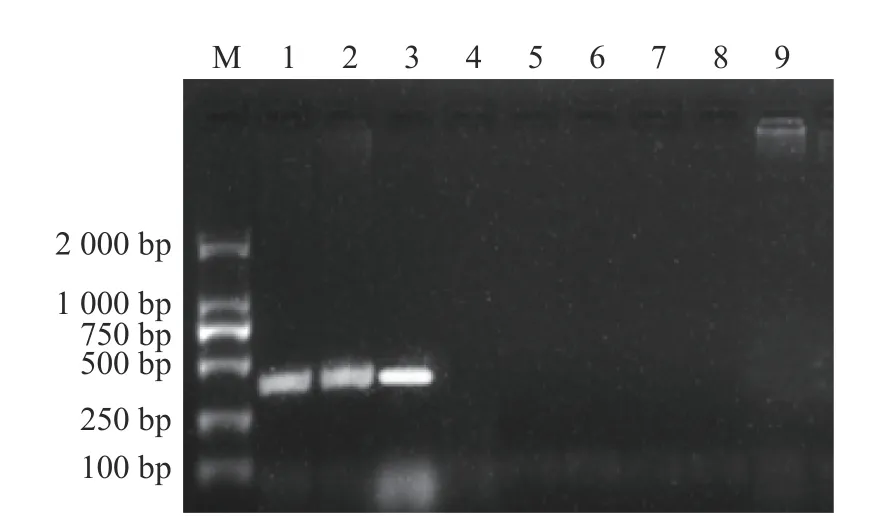
图2 新型鹅星状病毒RT-PCR 特异性试验结果Fig.2 Specificity of NGAstV detection by RT-PCR
2.3 敏感性试验
新型鹅星状病毒核酸反转录后的cDNA 浓度为62 ng·μL-1,以10倍系列稀释成6.2 ng·μL-1、620 pg·μL-1、62 pg·μL-1、6.2 pg·μL-1、620 fg·μL-1、62 fg·μL-1、6.2 fg·μL-1、620 ag·μL-1、62 ag·μL-1进行PCR敏感性试验,结果显示:建立的新型鹅星状病毒RTPCR 方法的检测限均为62 fg·μL-1(图3)。

图3 RT-PCR 敏感性试验Fig.3 Sensitivity of RT-PCR assay
2.4 重复性试验
利用建立的新型鹅星状病毒RT-PCR 方法对3 份新型鹅星状病毒阳性样品,新城疫病毒、禽呼肠孤病毒、鹅细小病毒、鹅多瘤病毒、鹅圆环病毒各1 份作阴性对照进行批内重复和批间重复试验。结果显示,批内和批间试验结果均一致(图略),即除了3 份新型鹅星状病毒阳性样品有扩增条带,其余样品均无扩增条带,表明重复性好。
2.5 临床样品检测结果
利用建立的RT-PCR 方法对45 份临床样品进行检测。结果显示,45 份样品中新型鹅星状病毒共检测出15 份,阳性率为33.33%(15/45),表明该病在浦城县流行较为严重,应引起重视,图4 为部分临床样品检测结果。

图4 部分临床样品RT-PCR 检测结果Fig.4 Detection of NGAstV on clinical samples by RT-PCR assay
3 讨论与结论
星状病毒在我国水禽群体中分布地域广泛且宿主范围宽广,能够引起鸡的肾炎、鸭的病毒性肝炎、火鸡肠炎等。鹅的星状病毒病是近年来通过多位学者[15-16]研究才确认的,然而目前对该病的致病机理尚不明确,缺乏有效的商品化疫苗,导致该病给养鹅业造成严重经济损失。福建省南平市是养鹅大市,因该病给养鹅户造成的经济损失较为严重。为了更好地对福建省新型鹅星状病毒病有更好的了解,为养殖户提供更为快速便捷的检测结果,建立一种用于检测新型鹅星状病毒的RT-PCR 方法显得尤为重要。
随着规模化养殖场的不断发展,当前多种疫病临床症状十分接近,剖解病变相差无几,不利于精准确定病因,耽误最佳治疗时间。分子生物学检测技术已然成为辅助临床诊断的主要方法。PCR 技术是目前所有动物疫病中应用最为广泛的技术之一,与荧光定量PCR 技术相比,不需要昂贵的仪器设备,而且操作流程简单,适合于基层工作者使用。
目前建立鹅星状病毒的分子诊断技术有张玉霞等[8]基于ORF1b基因建立的LAMP 检测方法,其灵敏度为1 ng·μL-1;邱思语等[9]基于ORF1b建立的SYBR Green I 荧光定量RT-PCR 方法,其灵敏度为24.2 拷贝·μL-1,白彩霞等[10]基于ORF2 基于建立的SYBR Green I 荧光定量RT-PCR 方法,其灵敏度为3.75 拷贝·μL-1,Yuan 等[11]基于ORF1b建立的TaqMan 实时荧光定量RT-PCR 方法,其灵敏度为52.5 拷贝·μL-1。本研究根据新型鹅星状病毒ORF2 基因设计1 对特异性的引物,通过对引物浓度和退火温度的优化,建立了新型鹅星状病毒RT-PCR 检测方法,其灵敏度为62 fg·μL-1,与邱思语等[9]、白彩霞等[10]、Yuan 等[11]建立荧光定量PCR 方法相比其灵敏性相距较远,但与张玉霞等[8]建立的LAMP 方法相比,本研究建立的方法灵敏度高100 倍。此外,本研究建立的方法对鹅常见病毒均未有检测出,表明特异性强;通过批内、批间重复验证结果表明,该方法具有良好的稳定性。通过对45 份临床样品进行检测,结果显示15 份样品阳性,阳性率为33.33%,提示新型鹅星状病毒病应当引起当地有关部门重视。
本研究成功建立了新型鹅星状病毒RT-PCR 检测方法,其特异性强、稳定性好,可应用于临床样品的检测,为及时控制该病提供有效的方法。
