初发脑梗死患者血小板内皮聚集受体1基因多态性与卒中后神经功能缺损和认知功能障碍的关系▲
2021-08-18郭宏伟刘迪龑胡义奎刘涛生谭龙君
郭宏伟 刘迪龑 胡义奎 刘涛生 谭龙君 冯 琼
(武汉市武昌医院/武汉科技大学附属武昌医院神经内科二病区,湖北省武汉市 430063,电子邮箱:1127246605@qq.com)
卒中后认知功能障碍是指在卒中这一临床事件后6个月内出现达到认知障碍诊断标准的一系列综合征,其危险因素包括高龄、受教育程度低、复发性卒中等[1]。近年来,血小板内皮聚集受体1(platelet endothelial aggregation receptor 1,PEAR1)基因位点rs12041331纯合突变被证实与卒中复发以及抗血小板药物疗效下降有关[2]。为了排除复发性卒中对卒中后神经功能缺损和认知功能障碍的影响,本研究选取初发脑梗死患者为研究对象,分析其卒中后神经功能缺损和认知功能障碍的发病与PEAR1基因位点rs12041331单核苷酸多态性(single nucleotide polymorphism,SNP)的相关性。
1 资料与方法
1.1 临床资料 选取2019年1月至2020年1月在武汉市武昌医院神经内科门诊或住院治疗的150例初发脑梗死患者为研究对象。所有患者均符合全国第四届脑血管病学术会议制定的脑梗死诊断标准[3],并在我院经颅脑CT或MRI检查确诊为脑梗死,排除短暂性脑缺血发作或小卒中患者、严重精神障碍和严重器官功能衰竭患者。根据PEAR1基因位点rs12041331的不同分型,将患者分为野生型组(GG组,68例)、纯合突变型组(AA组,48例)、杂合突变型组(GA组,34例)。所有研究对象均自愿参加本研究并签署知情同意书。本研究获得武汉市武昌医院医学伦理道德委员会批准。
1.2 观察指标
1.2.1 一般临床资料:收集患者一般信息和既往病例资料。测量所有患者的身高、体重,计算体质指数。高血压定义为收缩压≥140 mmHg和/或舒张压≥90 mmHg,或正在接受降压治疗。糖尿病定义为空腹血糖≥7.0 mmol/L,或OGTT后2 h血糖≥11.1 mmol/L,或正在接受降糖治疗。吸烟定义为几乎每日吸烟,平均每日吸烟1支以上,时间>1年。饮酒定义为几乎每日饮酒,平均每日饮酒50 g以上,时间>1年。高龄定义为年龄>75岁。低教育程度定义为中学以下文化程度或未接受过任何教育。于患者入院后次日,采集清晨空腹静脉血5 mL,采用日本东芝全自动生化检测仪测定血脂四项水平。
1.2.2 神经功能缺损程度评价:入组时采用美国国立卫生院卒中量表(National Institute of Health Stroke Scale,NIHSS)评价患者神经功能缺损程度[4],评价内容包括患者意识水平、面瘫、上肢运动等方面,评分越高表示患者神经功能缺损越严重。
1.2.3 认知功能评价:取入组时以及卒中后6个月内每月1次的简易精神状态检查量表(Mini-Mental State Examination,MMSE)评分[5],其中最大分值作为统计值,以此评价患者的认知功能。目前MMSE是国内外应用最广的认知筛查量表,评价内容包括时间定向力、地点定向力、即刻记忆、注意力及计算力、延迟记忆、语言、视空间。量表共30项题目,每项回答正确得1分,回答错误或答不知道计为0分,量表总分范围为0~30分,量表总分越高表示认知功能越好。
1.2.4 PEAR1基因位点rs12041331 SNP的检测:入组后次日清晨抽取所有患者空腹外周静脉血3 mL,-20℃保存于乙二胺四乙酸管中,按照DNA提取试剂盒(北京原平皓生物技术有限公司)说明书提取DNA,保存于-20℃。采用PCR-限制性片段长度多态性技术及直接测序法检测基因型。PCR体系包括基因组DNA 2 μL、上下游引物各 5 μL、2×Taq Mix 12.5 μL(北京艾德莱生物科技有限公司),加超纯水0.5 μL补至25 μL。PCR扩增条件为94℃ 3 min,94℃ 30 s,58.5℃和59.5℃各30 s,72℃ 30 s,重复30个循环,72℃ 5 min。反应结束后,利用2%琼脂糖凝胶电泳检测PCR扩增产物。rs12041331扩增引物正向序列为5′-CACTAATCTTATCCCCATTTTCTAGGTG-3′,反向为5′-GCCCTCTCAGCCTCCGAGC-3′。内切酶为Becl,酶切片段AA大小为178 bp、230 bp,酶切片段AG大小为408 bp、178 bp、230 bp,酶切片段GG大小为408 bp。取上述聚合酶链反应产物2 μL,内切酶1 μL,10×NEB缓冲液2 μL,灭菌离子双蒸水5 μL,反应总体积10 μL。37℃酶切至少1 h终止酶切反应。反应产物用2%琼脂糖凝胶,GelRed染色,140 V电压、300 mA电流稳压电泳40 min,凝胶系统成像,观察结果并照相。样本测序及PCR引物由生工生物工程(上海)股份有限公司完成。
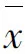
2 结 果
AA组患者的高龄者比例、吸烟者比例高于GG组,LDL-C水平和NIHSS评分均高于GG组和GA组(均P<0.05),而MMSE评分低于GG组和GA组(均P<0.05)。见表1。
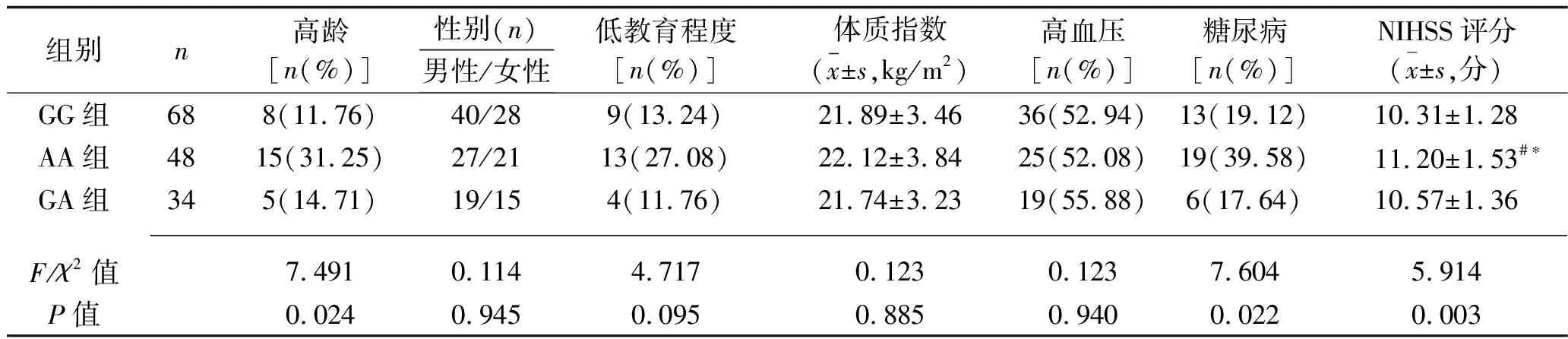
表1 3组患者临床资料的比较
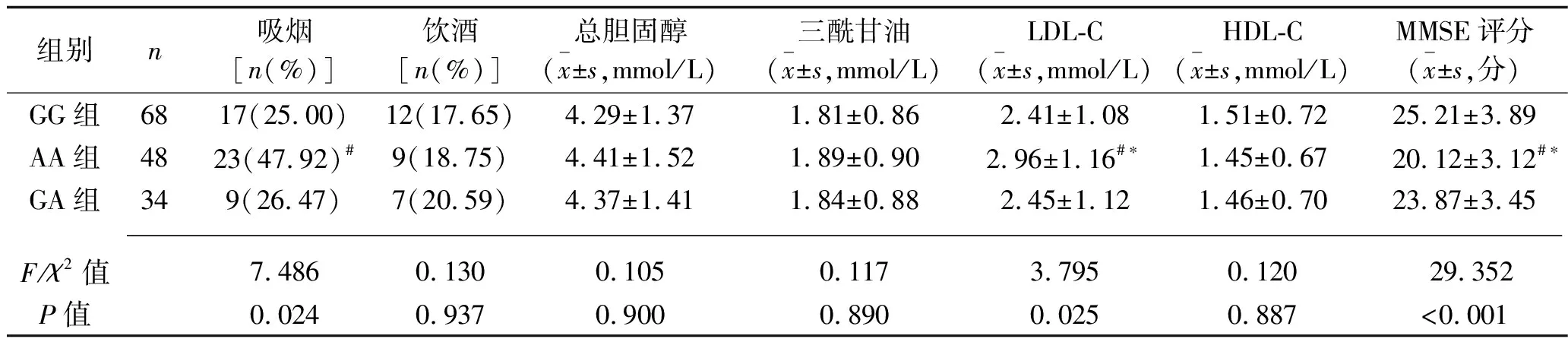
组别n吸烟[n(%)]饮酒[n(%)]总胆固醇(x±s,mmol/L)三酰甘油(x±s,mmol/L)LDL-C(x±s,mmol/L)HDL-C(x±s,mmol/L)MMSE评分(x±s,分)GG组6817(25.00)12(17.65)4.29±1.371.81±0.862.41±1.081.51±0.7225.21±3.89AA组4823(47.92)#9(18.75)4.41±1.521.89±0.902.96±1.16#∗1.45±0.6720.12±3.12#∗GA组349(26.47)7(20.59)4.37±1.411.84±0.882.45±1.121.46±0.7023.87±3.45 F/χ2值7.4860.1300.1050.1173.7950.12029.352P值0.0240.9370.9000.8900.0250.887<0.001
3 讨 论
PEAR1是一种参与血小板活化和巨核细胞生成的Ⅰ型跨膜受体,在血小板和内皮细胞上均有表达,参与多种血管性疾病和血栓形成[6]。PEAR1基因突变与血小板的激活和心血管不良结局有关[7]。研究表明,PEAR1是一种新的血小板受体,其磷酸化可促进αⅡbβ3信号的激活放大,使大量血小板脱颗粒,引起血小板之间不可逆的聚集反应[8]。人体PEAR1基因定位于1q23.1,约30 kb,包括23个外显子和22个内含子,PEAR1多个位点的SNP与血小板功能及血管功能密切相关,PEAR1基因不同位点的变化可对血小板反应性产生一定的影响[9]。
PEARl在血液循环中的血小板表面呈低水平表达,在二磷酸腺苷、交联胶原蛋白相关肽CRP-XL及其他因素刺激下,PEAR1的表达上调,促使血小板膜糖蛋白Ⅱb与Ⅲa结合构成纤维蛋白原受体,两者再与纤维蛋白原结合,进而加速血栓形成[10]。研究表明,PEAR1基因能够发挥激活血小板、降低巨核祖细胞的增殖、促进血小板的聚集反应等作用,并与冠心病、脑卒中等心脑血管疾病密切相关[11]。国内学者鲁燕等[12]的研究表明,冠心病患者发生阿司匹林抵抗与PEAR1基因多态性密切相关,PEAR1基因型GG患者对阿司匹林的应答性最好,而PEAR1基因型AA患者对阿司匹林存在严重抵抗。陈静静等[13]也发现,PEAR1基因rs12041331位点A等位基因与缺血性脑卒中患者发生阿司匹林抵抗有关。
由于PEARl SNP与正常人血小板功能反应有关,目前针对SNP研究的相关位点主要有rs12401331、rs9550270、 rs4661012、rs11264579、rs3737224、rs1273215、rs1256688等,其中关于rs12041331对血小板聚集功能的影响研究较多。Keramati等[14]发现,在通过测序鉴定出的PEAR1基因532个变体中,内含子1变体rs12041331与所有血小板聚集表型显著相关,全基因组关联分析鉴定亦显示携带变体rs12041331者的血小板聚集功能最强。Pi等[15]发现,PEAR1基因多态性,特别是位点rs12041331和位点rs12566888,与冠状动脉粥样硬化性心脏病的发病密切相关,PEAR1基因多态性并不能表明川崎病发生的易感性,但rs12041331多态性与川崎病中冠状动脉瘤形成的风险增加有关。Faraday等[16]发现,PEAR1基因位点rs12041331内含子的变异可增加PEAR1蛋白的表达,后者除增强血小板的聚集性外,还可能存在其他潜在的功能。除此之外,还有研究表明PEAR1基因多态性可影响血小板聚集率,并与血小板功能和抗血小板药物药效学有关[9]。Backman等[17]发现,PEAR1基因位点rs12041331变异通过削弱阿司匹林的抗血小板聚集作用,进而增加心血管事件风险。石锦秀等[18]的研究显示,中国人群中PEAR1基因位点rs12041331的野生G等位基因的分布频率为0.61,突变A等位基因的频率为0.39,PEAR1基因突变与血小板高活性具有相关性,PEAR1基因突变型(AG和AA)人群的血小板聚集率显著高于野生型(GG)人群,突变基因型(AG和AA)患者使用阿司匹林(或联合氯吡格雷)时的心肌梗死发生率和死亡率增高,随着PEAR1的突变基因位点数量增加,血小板聚集率也逐渐增加。李建设等[19]在114例初发脑梗死患者中检出3种PEAR1(位点rs12041331)基因型,分别是野生型GG(50.9%)、杂合突变型GA(42.1%)、纯合突变型 AA(7.0%),并进一步观察到PEAR1基因突变与长期服用阿司匹林脑梗死患者的卒中复发有关,考虑PEAR1基因纯合突变可增加卒中复发的风险。
脑梗死具有高发病率、高复发率、高致残率及高死亡率的特点,是造成全世界人口死亡和残疾的重要原因之一[20]。以往临床医师都重视脑梗死患者肢体功能的恢复,而忽视了脑梗死后认知功能障碍的恢复,从而错过了脑梗死后认知功能恢复的最佳时机,其造成的严重后果并不亚于肢体残疾,也给整个家庭和社会都带来沉重的负担[21]。认知功能减退是急性脑梗死患者最常见的表现之一,卒中后认知功能障碍包括了从卒中后认知障碍非痴呆至卒中后痴呆的不同程度的认知障碍。其发生机制目前仍不明确,导致早期诊断及治疗较为困难[22]。经过积极治疗和干预,可以延缓部分早期的卒中后认知障碍非痴呆患者的疾病进程。一旦发展到了卒中后痴呆阶段,多表现为阶梯式加重、波动病程的认知功能障碍,治疗难度明显加大[23]。卒中后认知功能障碍主要危险因素包括高龄、低受教育程度、复发性卒中等[24],故需引起重视,做到早期评估、早期预防。
本研究结果显示,AA组患者的高龄者比例、吸烟者比例高于GG组,LDL-C水平和NIHSS评分均高于GG组和GA组(均P<0.05),提示PEAR1基因位点rs12041331的纯合突变者有更多的卒中危险因子,且一旦发病,神经功能受损更为严重。此外,AA组的MMSE评分低于GG组和GA组(P<0.05),尽管GA组MMSE评分也低于GG组,但差异无统计学意义(P>0.05),这也初步提示PEAR1基因位点rs12041331的SNP可能与初发脑梗死患者卒中后认知功障碍的发生有关。
综上所述,PEAR1基因位点rs12041331的纯合突变可能增加初发脑梗死患者卒中后神经功能缺损程度,以及认知功障碍的发生风险。评估PEAR1基因多态性对评估初发脑梗死患者卒中后认知功障碍有一定的价值,这对于合理应用相关药物,加强患者的综合管理,改善患者预后,提高生活质量具有重要的意义。然而,由于PEAR1基因突变可以发生在多个基因位点上,而且存在种族差异[25],本研究可能存在着一定的局限性。今后的研究应该涉及多类人群,扩大样本量,从更多的基因位点上着手研究其与脑梗死患者卒中后认知功障碍的相关因素。
