基于ChIP-seq筛选睾丸支持细胞中雄激素受体靶基因初步研究
2021-08-18张建文
邓 琼,王 铸,张 颖,孙 睿,张建文,梁 辉
(南方医科大学 附属深圳龙华人民医院,广东 深圳 518109)
雄激素及其受体在精子发生过程中具有重要的生理作用[1]。雄激素是类固醇激素家族成员,主要由睾丸间质细胞分泌,作用主要包括促进雄性附性器官的发育、促进第二性征出现、维持性欲并保证正常的生殖力。迄今为止,雄激素作用的受体唯一被公认的只有AR(Androgen receptor)。Ar基因突变或者雄激素水平低下可引起精子发生障碍及男性不育。有研究报道,睾丸中不同类型细胞的特异性Ar基因敲除小鼠可出现不同水平的精子发生障碍[2-3],其中,生精细胞Ar基因特异性敲除小鼠与野生型小鼠相比未发现明显差异,Ar基因全敲(ARKO)小鼠和支持细胞Ar基因特异性敲除(SCARKO)小鼠的精子发生过程分别停止在精母细胞减数分裂前期的粗线期和细线期[4]。上述一系列的敲除小鼠研究结果表明,雄激素主要通过睾丸支持细胞中的AR调控精子发生。
雄激素通过经典信号途径和非经典信号途径发挥作用。非经典途径也可称为非基因组作用,雄激素通过位于细胞膜上的AR激活细胞质内的磷酸化通路[5],导致cAMP反应元件结合蛋白转录因子(CREB)的磷酸化,调控一系列基因的表达[6]。经典途径也称为基因组作用,雄激素扩散进入细胞内,与AR结合形成复合体,由细胞质转移至细胞核,并与染色质上的激素反应元件结合,激活或抑制靶基因的转录。到目前为止,已发表的文献中AR靶基因包括Rhox5[7]和Ube2b[8]等已被广泛认可。Karel等报道,应用高通测序技术比较野生型小鼠与SCARKO小鼠睾丸的基因表达谱,鉴定了大量的差异表达基因[9]。我们前期也鉴定了一系列Ar的候选靶基因,包括了Daxx[10]、Sept11[11]以及USP24[12]。寻找并鉴定更多雄激素及其受体的靶基因,对阐明雄激素及其受体介导精子发生的分子机制,解析其调控精子发生的网络具有非常重要的科学意义。
在本研究中,我们分离大鼠睾丸支持细胞原代培养,以睾酮刺激48h收集细胞进行染色体免疫共沉淀测序(Chromatin immunoprecipitation followed by sequencing,ChIP-seq),生物信息学分析后验证测序结果。本研究结果有助于丰富雄激素基因组作用的科学内涵,进一步解析雄激素和AR调控精子发生的分子机制,继而为精子发生障碍引起的生精障碍或男性不育症的诊断和治疗提供新的思路。
1 材料方法
1.1 实验动物
8周龄的C57BL6小鼠(雄性)来源于广东省医学实验动物中心(广东佛山),ARKO小鼠为北京大学深圳医院桂耀庭教授课题组惠赠。小鼠到达后,在自由采食饮水、16h光照/8h黑暗的条件下稳定饲养7天以上。本研究经南方医科大学附属深圳龙华人民医院动物伦理委员会批准(LHRY-1907014)。
1.2 小鼠睾丸支持细胞的分离培养
课题组已经稳定建立了小鼠睾丸支持细胞的分离培养体系[13]。分离细胞试剂均购于Sigma Aldrich,包括胶原酶(C5138)、DNaseⅠ(DN25)、透明质酸酶(H3506)和胰蛋白酶(T1426)。分离步骤简而言之,取健康雄鼠,采用CO2麻醉后脱颈法处死,解剖取出睾丸组织,在冰上预冷的PBS中(含100μg/ml链霉素和100IU/ml青霉素)清洗,去除血液及杂质,镊子轻轻剥离白膜,加PBS清洗3次。加入37℃预热的5ml消化液1(DMEM/F12中含0.1%胶原酶和少量DNaseⅠ),在37℃条件下震荡(60rpm,下同)孵育20min。静置1min弃上清,PBS清洗组织3次。加37℃预热的5ml消化液2(DMEM/F12中含0.1%胶原酶,0.1%透明质酸酶和少量DNaseⅠ),37℃震荡孵育10min。500rpm离心1min后弃上清,加PBS清洗3次。加37℃预热的5ml消化液3(DMEM/F12中含0.1%胶原酶,0.1%透明质酸酶,0.25%胰蛋白酶和少量DNaseⅠ),37℃震荡孵育20min。加入细胞完全培养液(DMEM/F12中含10%FBS,100μg/ml链霉素和100IU/ml青霉素)终止消化,轻轻吹打至单个细胞,并将细胞悬液以40μm细胞筛(BD Falcon)过滤。1000rpm离心5min后重悬细胞,计数,稀释,按照1million细胞/ml铺板至75cm2细胞培养瓶(Corning)。转培养瓶至37℃、5%CO2培养箱中培养。每1-2天换液一次。
1.3 染色体免疫共沉淀
实验采用ChIP-IT®Express Kit(Cat.No.53008,Active Motif),根据试剂盒说明书和实验室条件,实验具体步骤如下:细胞经丙酸睾酮(100nM)处理48h后,弃细胞培养液,加5ml Fixation Solution(完全培养液含1%福尔马林),室温水平摇床上孵育10min。弃培养基,加5ml PBS清洗(左右上下晃动5sec),弃PBS。加Glycine Stop-Fix solution(PBS含125mM Glycine),室温水平摇床上孵育5min终止固定。加细胞刮液(PBS含PMSF),刮取细胞,4℃,720g离心10min收集细胞。弃上清,加Lysis Buffer(含PMSF和PIC(Protease Inhibitor Cocktail)),冰上孵育30min。组织研磨仪低速破碎细胞,4℃,2400g离心10min收集细胞核。弃上清,加Shearing Buffer(含PMSF和PIC)重悬。按照25%power,10pulses(20sec一次,间隔30sec)破碎染色质。4℃,18000g离心10min收集染色质。转移上清至预冷的EP管内。取10μL作为对照(input)。按照如下体系添加:Protein G Magnetic Beads,25μL;ChIP Buffer 1,20μL;Shearing Chromatin,100μL;PIC,2μL;AR Antibody cocaktail(sc-816,Santa Cruz;ab74272,Abcam),1-3μg;双蒸水补足至最终体积为200μL。4℃条件下旋转孵育过夜。短暂离心后将EP管置于磁力架上静置,去上清。800μL ChIP buffer 1清洗磁珠一次。800μL ChIP buffer 2清洗磁珠两次。以50μL Elution buffer AM2重悬磁珠。室温旋转孵育15min。短暂离心后,加50μL Reverse Cross-linking buffer混匀。将EP管置于磁力架上,取上清。Input处理:加88μL ChIP buffer 2和2μL 5M NaCl。所有样本95℃,15min。室温平衡后,短暂离心,加2μL Protease K。37℃水浴1h。室温平衡后,加2μL Protease K Stop Solution。
1.4 ChIP DNA的纯化
ChIP DNA的纯化采用Chromatin IP DNA Purification Kit(Cat.No.58002,Active Motif)。加DNA 5倍体积的DNA Purification Binding Buffer,以3M醋酸钠调节pH值,每次加5μL,直至溶液变成明亮的黄色。将混合好的溶液加至离心柱中,14000rpm离心1min。弃收集管中的溶液,加750μL Wash buffer,14000rpm离心1min。弃收集管中的溶液,保持盖子敞开离心,14000rpm离心2min。将离心柱转至另一新的EP管中,加50μL DNA Purification Elution Buffer,静置1min。14000rpm离心1min。
1.5 染色体免疫共沉淀测序分析
纯化后的ChIP样本送往诺禾致源生物信息科技有限公司(天津)进行建库(包括末端修复、加A、加接头、长度筛选和PCR扩增)和高通量测序,得到原始图像数据文件经CASAVA碱基识别分析转化为原始测序文件,最后进行数据质控、序列比对、Frag_Size预测、链互相关性分析、Peak Calling、模体分析、峰注释和差异分析。
2 实验结果
2.1 小鼠睾丸支持细胞的分离、培养与鉴定
我们课题组稳定建立了小鼠睾丸支持细胞的分离和培养体系,每只小鼠可获得106个细胞。支持细胞特异表达Marker SOX-9染色证实支持细胞纯度达到95%以上[13]。
2.2 ChIP-seq数据质控和序列比对
我们以ARKO小鼠睾丸作为背景,野生型小鼠支持细胞分为睾酮处理组和对照组。ChIP-seq下机数据原始reads经过修剪之后得到clean reads,而后采用软件BWA(Burrows Wheeler Aligner)将reads与参考基因组进行比对。具体数据参见表1。
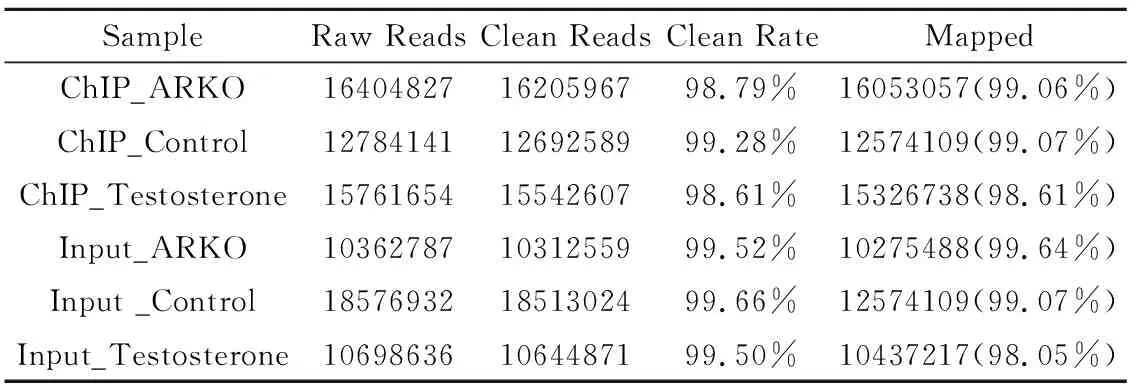
表1 原始数据质控与比对结果Table 1 Raw data quality control statistics
2.3 链互相关分析和差异分析
由于测序的reads是近似平均地分配到正负两条链上,我们可以通过计算两条链之间的相关系数,也称为链互相关系数(Strand Cross-Correlation),来检测正负链间的最优距离(图1A)。以Fold Enrich值(IP中RPM值与Input中RPM值的比值)为基础,进行层次聚(hierarchical clustering)分析(图1B)。RPM指单个样品中1M的reads富集到peak中的比例。同时,我们对差异peak的相关基因进行GO富集分析(图1C)和KEGG富集分析(图1D)。
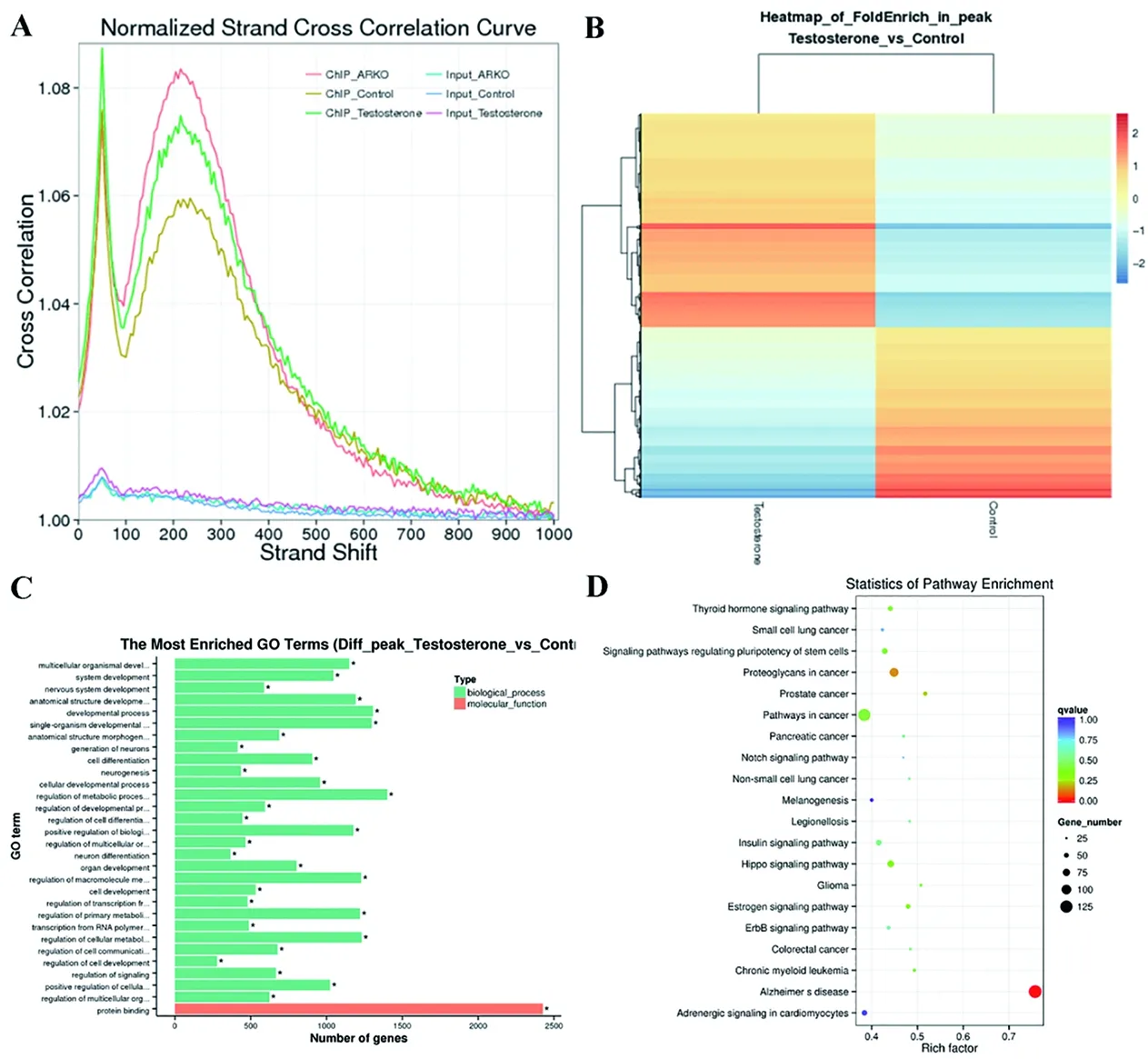
图1 链互相关分析和差异分析结果
2.4 ChIP-seq结果验证
根据差异分结果,一共检测到了8679个差异基因,其中4830个在Testosterone组表达上调,3849个表达下调。从中筛取部分进行验证。选取两种类型,其一是差异倍数大于13.3倍的,共计9个,具体基因名称见表2。其二是筛取至少检测到3次,且差异倍数大于2倍的基因,共计34个,具体见表3。
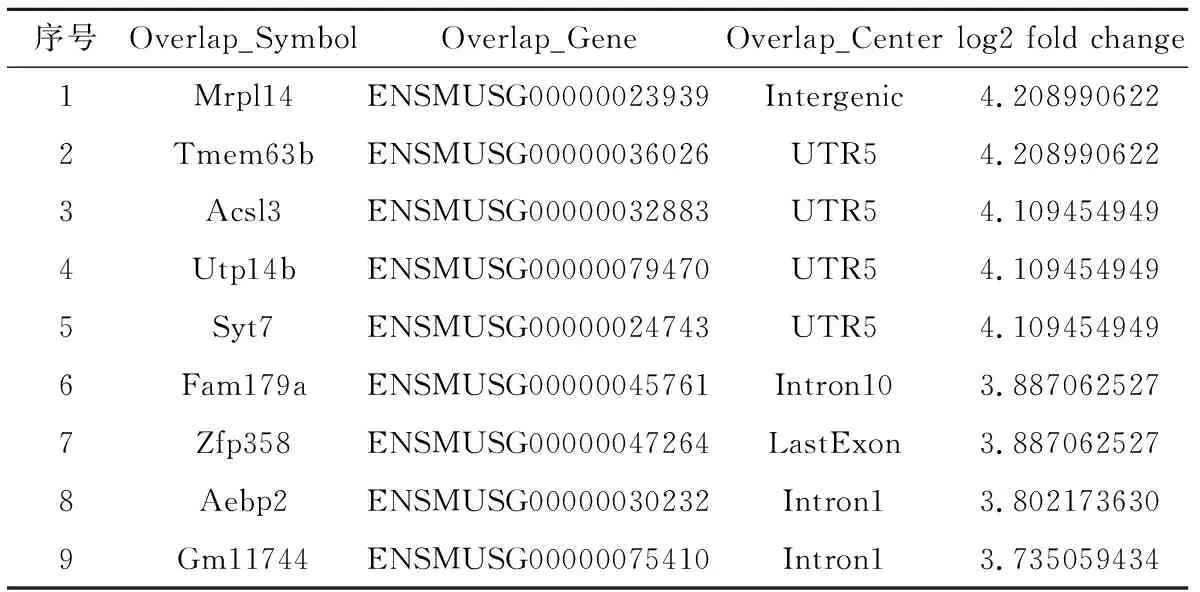
表2 差异倍数大于13.3倍的差异基因汇总表Table 2 Summary of differential genes with difference greater than 13.3
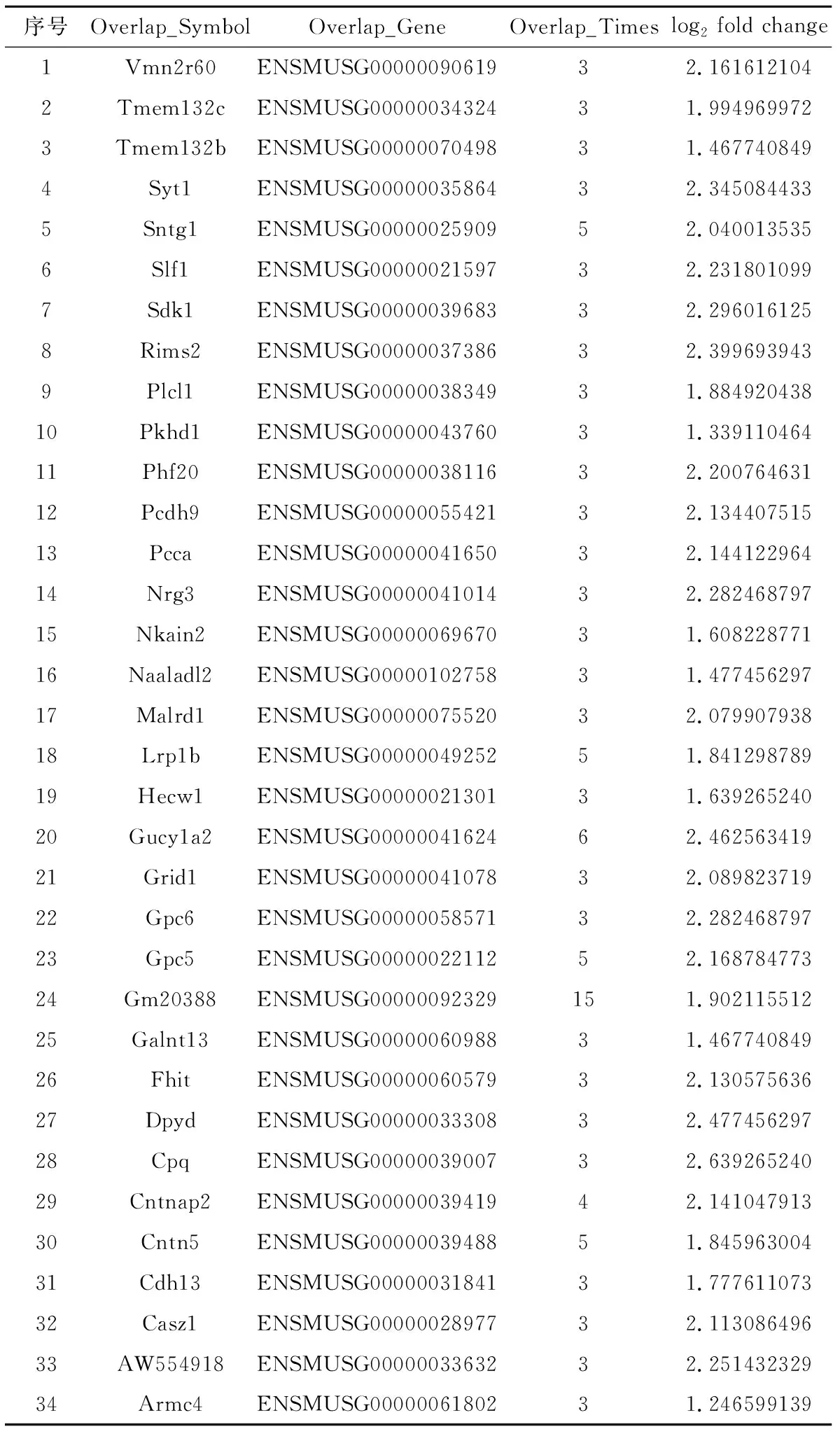
表3 差异倍数大于2倍并检测到三次以上的差异基因汇总表Table 3 Summary of differential genes with difference greater than 2-fold and detected more than three times
我们采用ARE序列比对,在筛选基因的启动子区域寻找ARE结合位点,具体结果如表4所示。除少数基因外,我们在基因的启动子区域找到了ARE结合位点。
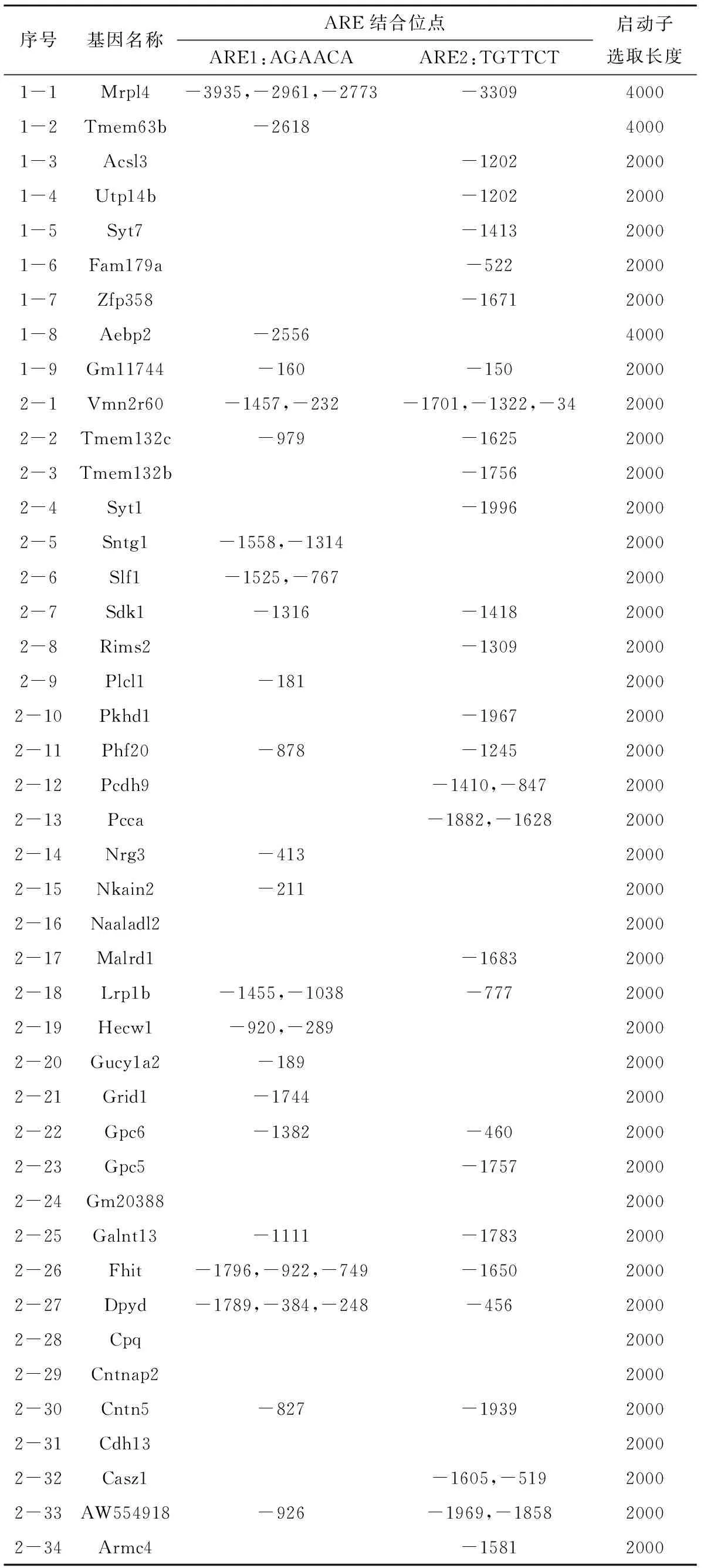
表4 筛选基因启动子ARE结合位点一览表Table 4 The list of binding sites of the selected gene promoter
3 讨论
3.1 睾丸支持细胞培养
睾丸支持细胞与相邻的细胞形成血睾屏障[14],形成有利于精子发生的微环境。睾丸支持细胞的分离培养方法有较多报道,综合多篇参考文献意见[14-16],鉴定结果表明可分离得到纯度超过95%的睾丸支持细胞,且细胞活率高,为ChIP-seq提供了保障。
3.2 ChIP-seq数据质控
由于ChIP-seq打断片段大小通常为100-500bp,从而导致部分测序reads中含有接头序列。经过修剪,将接头序列去掉。原始reads经过修剪之后得到clean reads,用于后续的分析。Clean rate比例在98.50%以上。唯一序列占整体序列数量的百分比是关注的重点,将过滤后的测序序列进行基因组定位分析,mapped的比率超过98%。
测序reads会近似平均地分配到正负链上,通过对IP和Input数据的链互相关性检仅可以获得正负链间相关系数,同时也监测到IP实验效果。图1A结果显示,IP的SCC曲线在0-100bp(打断片段大小)和100-400bp(读段大小)各有一个峰。打断片段大小处的CC值(CC_fragment_length)与整条SCC曲线CC最小值(即CC_min)的比值大于1.05。该图结果显示,ChIP-seq数据达到分析要求。
3.3 ChIP-seq结果分析和数据验证
研究采用ARKO小鼠睾丸样本作为背景对照,分析显示,与Testosterone组相比,ARKO组检测到18403个差异表达基因,其中有502个可以Testosterone组中检测到,与Contol组无交叉检测到的基因,因此,我们剔除掉了502个基因进行后续分析。
ChIP-seq的数据分析显示,Control组和Testosterone组有2136个差异表达基因。KEGG Pathway分析结果显示,Pathways in cancer和Proteoglycans in cancer等信号通路富集了一些差异表达基因。睾丸抗原(Cancer/Testis Antigen,CTA)基因在正常睾丸组织的生殖细胞和多种不同组织类型的癌细胞中特异表达[17]。生殖细胞的产生和成熟与肿瘤发生发展紧密联系在一起,它们之间存在一系列的共同特征,包括了细胞迁移、细胞永生化、全基因组去甲基化等。因此,这些在肿瘤信号通路中富集的基因有可能在精子发生和雄激素及其受体的调控网络中有重要的作用。我们从差异基因中筛选了一部分基因,并在其启动子中寻找ARE位点,超过90%的基因启动子存在ARE结合位点。这些基因是否能作为雄激素及其受体的靶基因还有待实验进一步验证。
4 结论
在本项目中,我们分离了睾丸支持细胞进行ChIP-seq,筛选了8679个差异表达的雄激素及其受体的候选靶基因,其中4830个基因在睾酮处理组表达上调,3849个表达下调。我们从差异基因中筛取了43个靶基因进行验证,其中39个基因的启动子区域找到了ARE结合位点。候选靶基因介导雄激素调控精子发生的分子机制仍有待进一步研究。本项目初步鉴定的靶基因为进一步深入系统研究雄激素及其受体AR调控精子发生的机制提供参考。
