深海热液区超嗜热古菌太平洋古球菌Palaecoccus pacificus DY20341T高温淀粉酶系分析
2021-08-17胡俊西
胡俊西,张 静,曾 湘*
(1.闽南师范大学生命科学与技术学院,福建 漳州 363099; 2.自然资源部第三海洋研究所,福建 厦门 361005)
淀粉酶(Amylase)是一类降解淀粉和糖原的酶类总称,仅水解淀粉分子链中的α-1,4-葡萄糖苷键,将淀粉链切断成为短链糊精、寡糖和少量麦芽糖及葡萄糖;普遍地存在于植物、动物和微生物中,并具有广泛的工业用途。环糊精葡糖基转移酶(Cyclodextrin Glucanotransferase, CGTase,EC 2. 4. 1. 19)是α-淀粉酶家族的重要成员,能将淀粉通过环化反应转化为环糊精。葡聚糖转移酶(α-glucanotransferase)能切断糖苷键,并转移葡聚糖(1, 4-alpha-D-glucan)至新的碳水化合物上,如葡萄糖或葡聚糖[1-2]。高温淀粉酶通常是指酶活性最适温度在60 ℃以上的淀粉酶,高温淀粉酶具有高温条件下热稳定性强、保存条件广、节约能源、成本低、易于保存和运输等特点,被广泛应用于酿酒、制糖、去污、纺织等行业[3]。
热球菌目是深海热液区一类常见的超嗜热古菌,其可以利用蛋白质、多糖类进行异养代谢,具有丰富的碳水化合物降解系统,包括对淀粉、糖原、多糖的降解。已报道的来源于热球菌目的高温淀粉酶都具有嗜热、耐酸的特性,如Pyrococcusfurious[4]、Pyrococcuswoesei[5]、ThermococcusonnurineusNA1[6]、Thermococcussp. HJ21[7]。但前期研究通常局限于单一淀粉酶的性质研究,而未对菌株淀粉酶系进行酶学和系统分析。
超嗜热古菌太平洋古球菌PalaecoccuspacificusDY20341T属于热球菌目,分离自东太平洋鸟巢海底丘热液沉积物[8],其高温淀粉酶系是适应热液环境的特殊机制之一。本研究对PalaecoccuspacificusDY20341T高温淀粉酶系的序列及酶学性质进行了分析,可为淀粉酶发酵工业高产菌株资源的开发应用提供基础。
1 材料和方法
1.1 菌株和基因组序列
太平洋古球菌PalaecoccuspacificusDY20341T(=JCM 17873T= DSM 24777T=MCCC 4A00001T)的基因组序列信息已提交GenBank数据库(序列号为CP006019)。
1.2 培养基和培养方法
TRM培养基(1 L):酵母膏1 g,蛋白胨4 g,氯化钠23 g,六水合氯化镁5 g,氯化钙0.15 g,氯化钾0.7 g,硫酸铵0.5 g,溴化钠0.05 g,氯化锶0.01 g,PIPES 3.3 g,0.5 mol/L氯化铁50 μL,1 g/L刃天青800 μL,用氢氧化钠将pH调至7.0。121 ℃,20 min灭菌后,加入单独灭菌的6%磷酸氢二钾1 mL,6%硫酸二氢钾1 mL,硫粉10 g。充入氮气去除氧气,加入终浓度为0.025%的硫化钠至培养基无色。
将菌株DY20341T种子液按1∶50接种到含TRM培养基的厌氧瓶中。80 ℃条件下恒温培养15 h,到达其生长稳定期。
1.3 粗酶液制备方法
将培养液于3 000 r/min离心5 min,去除单质硫;上清于10 000 r/min离心20 min后所得菌体用裂解缓冲液重悬,超声波低温破碎2.5 min;溶液于13 000 r/mm离心30 min,所得上清即为粗酶液。
1.4 淀粉酶粗酶液酶活性测定
1.4.1 葡萄糖标准曲线的制备 精密称取105 ℃干燥至恒重的葡萄糖标准品1 g,溶解稀释后定容于100 mL容量瓶中,配成10 mg/mL的标准贮备液,精密吸取贮备液1 mL定容至100 mL,配成0.1 mg/mL的葡萄糖标准液。精密移取葡萄糖标准液0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 μL于25 mL具塞刻度试管中,加蒸馏水至2.0 mL,再各加6%苯酚溶液1.5 mL摇匀,迅速加入浓硫酸溶液5 mL,振摇,放置10 min,置沸水浴中加热20 min,取出冷却至室温,以空白为参比测定OD540,绘制葡萄糖标准曲线。
标准曲线中葡萄糖各浓度梯度的点能形成良好线性关系,且R2>0.99。
1.4.2 酶活性测定 采用3,5-二硝基水杨酸比色法(DNS)测量还原糖的含量,表示酶活性[9]。
实验组体系为:1 mL 1%(W/V,下同)淀粉缓冲液+1 mL无菌去离子水+100 μL粗酶液;对照组体系为:1 mL 1%淀粉缓冲液+1 mL 2 mol/L氢氧化钠+100 μL粗酶液。反应30 min后立即取出,实验组和对照组同时加入1.5 mL DNS,并且实验组补加1 mL 2 mol/L氢氧化钠,每管都沸水浴10 min。各组冷却后加水补齐到15 mL,取200 μL测定OD540。
本研究中酶活性单位定义为在上述一定条件下,每分钟从1%可溶性淀粉溶液中释放出1 mmol葡萄糖的酶量定义为1个酶活性单位(U)。
1.5 酶学性质研究
1.5.1 淀粉酶蛋白的SDS-PAGE复性胶检测 用含有0.3%的可溶性淀粉的12% PAGE进行蛋白分子量和淀粉酶活性的检测。一侧电泳胶用考马斯亮蓝染色确定分子量;另一侧在含2.5% Triton X-100的50 mmol/L磷酸氢二钠(pH 7.0)溶液中室温下复性1 h,再放入乙酸钠缓冲液(pH 5.0)中,95 ℃反应1 h。用含0.15%碘液和1.5%碘化钾的溶液染色2 min,形成的透明条带即为淀粉酶活性条带。
1.5.2 酶的反应温度 将粗酶液分别置于50、60、70、80、90、100 ℃(水浴)和110 ℃(高压灭菌锅)温度下,测定淀粉酶活性。
1.6 淀粉酶序列信息分析
利用SignalP 4.1在线分析蛋白的信号肽序列[10];利用SMART数据库和Pfam数据库分析其所属家族和保守区域;利用Swiss-PdbViewer 4.0.4预测保守结构域;利用BLAST在线软件和DNAMAN软件进行相似性、保守结构域分析。
2 结果与讨论
2.1 酶学性质测定
2.1.1 酶的反应温度 菌株DY20341T的粗酶液在60~110 ℃范围内均具有淀粉酶活性,在100 ℃时酶活性最高(图1)。
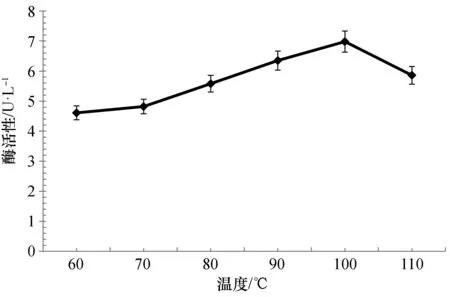
图1 温度对菌株DY20341T培养液上清中淀粉酶粗酶活性的影响
2.1.2 淀粉酶蛋白分子量的检测 由SDS-PAGE复性胶染色的结果(图2)可以看出4个淀粉酶在pH 5.0、95 ℃的条件下均有活性。条带1、2、3、4分别对应淀粉酶1(PAP09225,约77 kDa)形成的二聚体、淀粉酶2(PAP01075,约82 kDa)、淀粉酶3(PAP09095,约61 kDa)、淀粉酶4(PAP00275,约53 kDa)。推测PAP09225形成的二聚体在SDS-PAGE上的分子量约为150 kDa左右。

图2 菌株 DY20341T总蛋白聚丙烯酰胺凝胶(a)及淀粉酶复性胶(b)
2.2 淀粉酶序列分析
2.2.1 同源蛋白序列比对 根据氨基酸序列Blastp在线比对结果,PAP09225与Archaeoglobusfulgidus的环糊精糖苷转移酶(YP_002993870.1)序列相似度最高,为85.41%, 与来源于Pyrococcusfurious的PF0272(NP_578001.1)序列相似度为65%[4];PAP01075与ThermococcusbarophilusMP的环糊精糖苷转移酶(YP_004071653.1)序列相似度最高(69.46%);PAP09095与ThermococcuslitoralisDSM 5473的α-淀粉酶(ZP_09729791.1)序列相似度最高(60.84%);PAP00275与Thermococcuscleftensis的α-淀粉酶(WP_014788878.1)序列相似度最高,为82.00%。将后两者与已知α-淀粉酶进行了同源比对,可见4个典型的α-淀粉酶活性位点(图3)。
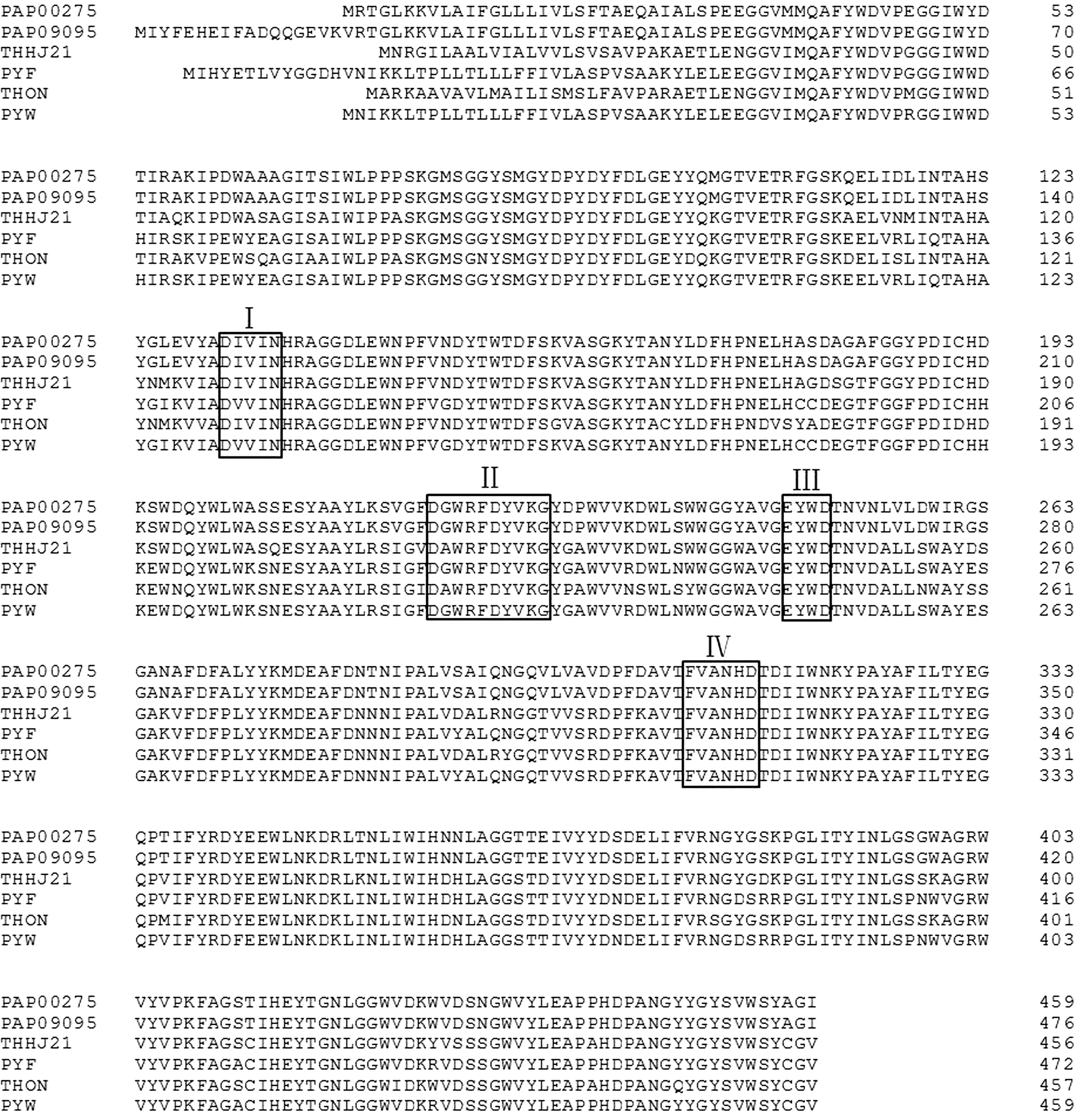
图3 来源于菌株DY20341T的α-淀粉酶(PAP00275和PAP09095)与其他淀粉酶序列的比对结果
另外,利用KEGG数据库分析了已知的20株嗜热古菌基因组序列(其中热球菌目菌株17株),发现α-淀粉酶在超嗜热古菌中的数目有较大差异(表1)。在热球菌目中,Thermococcusbarophilus、Thermococcussibiricus、Pyrococcussp. ST04、Pyrococcussp. NA2中没有α-淀粉酶,而Thermococcuskodakaraensis、PyrococcusfuriosusDSM 3638和PalaeococcuspacificusDY20341T则含有两个α-淀粉酶。可见,热球菌目菌株淀粉及糖原代谢具有多样性,是其个体选择适应环境的一种方式。
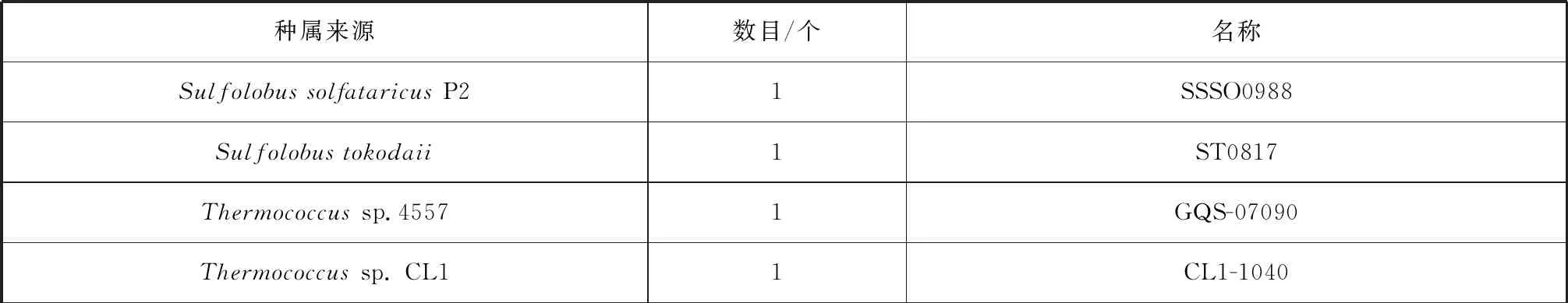
表1 利用KEGG数据库分析得到的已知嗜热古菌α-淀粉酶数目
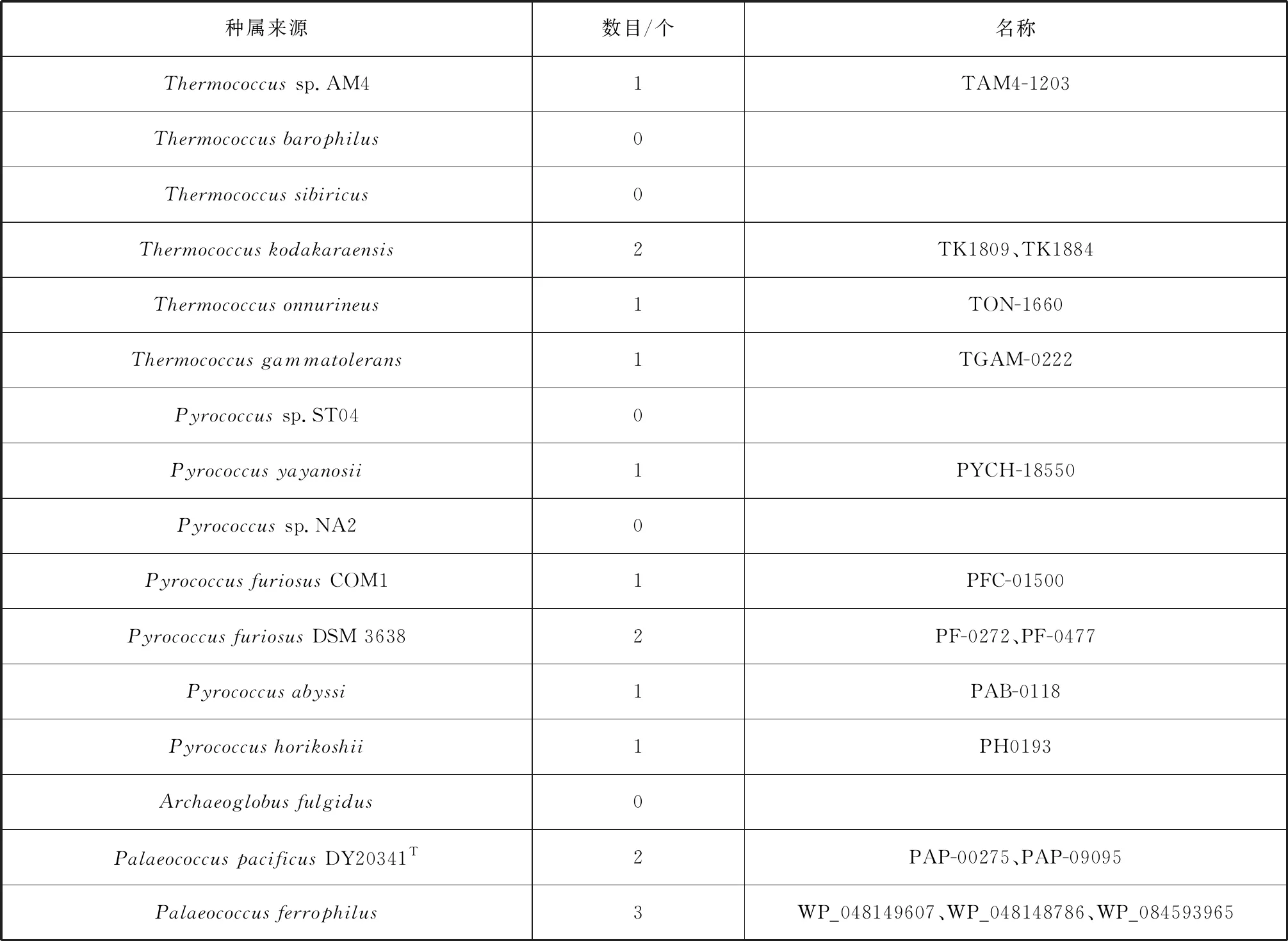
续表1
2.2.2 信号肽、活性位点、保守区域分析 利用SignalP-4.1在线预测4个淀粉酶信号肽:PAP00275的1~28位的氨基酸是信号肽,29~30位预计为切割位点,为胞外酶;PAP01075的1~19位的氨基酸是信号肽,预测其为胞外酶;PAP09095和PAP09225中没有信号肽,为胞内酶。
将4个蛋白的氨基酸序列提交到Pfam数据库中进行比对分析(表2)。PAP01075、PAP09095、PAP00275属于α-淀粉酶家族的成员,且都只有在α-淀粉酶的催化区域有预测的活性位点。PAP09225和PAP00275序列中还包含有DUF结构域的序列。DUF结构域最早是在原核生物的转移酶中发现的结构域,功能未知。Imamura等(2003)推测他们与转糖基的作用有关[11]。

表2 利用Pfam数据库预测4个淀粉酶的所属家族和活性位点
PAP09225属于糖苷水解酶GH-57家族(Glycosyl Hydrolase Family 57),GH-57家族是一个糖苷水解酶家族,除了能够水解二糖和多糖的糖苷键,还能水解糖和非糖物质之间的糖苷键,具有淀粉酶催化活性。该家族成员大多来自极端微生物,包括α-淀粉酶、4-α-葡聚糖转移酶、普鲁兰酶等[12]。根据保守序列比对和进化分析推测PAP09225是一个胞内4-α-葡聚糖转移酶(EC 2.4.1.25)。其空间结构与Thermococcuslitoralis1K1X类似,N-端的结构域A中的pseudo-TIM桶状折叠,是催化残基所在的保守区域。SDS-PAGE结果显示PAP09225是一个二聚体,这与1K1X晶体结构的研究结果[11]一致。
PAP01075是胞外环糊精葡糖转移酶(EC 2.4.1.19),含有环糊精糖苷转移酶氨基酸序列所共有的4个保守区域。与其序列最相似和进化关系最近的是ThermococcusbarophilusMP的环糊精葡糖转移酶(YP_004071653.1)。
PAP09095与PAP00275均属于α-淀粉酶(EC 3.2.1.1)的GH-13家族。PAP09095是胞内α-淀粉酶,含有α-淀粉酶4个保守区域。与最近的同源蛋白氨基酸序列比对后发现,在N端多出的100个氨基酸是锌指SWIM区域蛋白,但功能未知。PAP00275是胞外淀粉酶,具有α-淀粉酶保守的(β/α)8TIM桶状结构,含有α-淀粉酶全部4个保守区域,与Pyrococcuswoesei耐热α-淀粉酶(3QGV)的序列和空间结构相似度极高(图4)。

图4 耐热α-淀粉酶的三维结构模型
2.3 其他淀粉/糖类转运系统
在菌株DY20341T基因组中共发现5个与糖类转运相关的ABC转运系统。Mal-I和 Mal-IV, 包括 malEFGK,可转运三糖和更长链的多糖,包括淀粉;Mal-II与Thermococcussibiricus的最相近,特异转运麦芽低聚糖;Mal-III转运系统可识别和转运麦芽糖和海藻糖; 另一个糖类转运系统Mal-V可转运糖类,包括乙酰葡萄糖胺。
3 结论
生理分析结果表明菌株DY20341T可以降解淀粉作为碳源[8],存在完整的胞外降解、转运和糖酵解途径[12]。其分泌胞外淀粉酶(PAP00275)和胞外环糊精葡糖转移酶(PAP01075),将淀粉等长链糖原降解生成麦芽糖和葡萄糖。由Native-PAGE可以看出,胞外淀粉酶PAP00275具有相对较高的酶活。部分淀粉和糖原可直接转运至胞内,由胞内淀粉酶(PAP09095)和胞内4-α-葡聚糖转移酶(PAP09225)进一步降解糖原和多糖为单糖。在菌株DY20341T胞内,被降解后的单糖作为能源可进入糖酵解途径(Embden-Meyerhof pathway)和不完整的三羧酸循环[13]。本研究结果证实,与其他热球菌目菌株相比,太平洋古球菌PalaeococcuspacificusDY20341T具有更丰富的淀粉降解体系,且其产生的淀粉酶均在高温下具有较好的活性,是该菌株适应热液区原位高温环境的一种适应机制。
