海洋酸化对经济海藻坛紫菜叶状体的光照强度和温度适应范围的影响
2021-08-17李梦雅唐小虹张立日王文磊纪德华陈昌生谢潮添
李梦雅,许 凯,唐小虹,张立日,徐 燕,王文磊,纪德华,陈昌生,谢潮添
(集美大学水产学院,福建 厦门 361021)
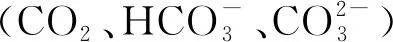

坛紫菜(Pyropiahaitanensis)是一种我国南方沿海栽培的重要经济海藻,其年产量占紫菜总产量的75%以上,主要栽培在我国福建、浙江和广东[13]。它可以作为食品、工业原料,也被认为是修复近岸养殖海区环境和增加碳汇的理想海藻[14]。阳光是包括海藻在内的光合生物的能量来源,而温度可以改变酶活性,影响藻体生长、代谢、光合作用及适温范围[15-16]。因此,光和温度是调控坛紫菜生长发育的两个最主要因素,也是决定其产量形成的关键因素[17]。坛紫菜海上养殖周期可长达近6个月,由于时间跨度大,天气变化复杂,坛紫菜经历剧烈的光和温度变化。在台风和阴雨天,叶状体连续几天处于低光环境,晴天则处于强光环境;而在养殖期间,福建近海海域的表层水温变化范围为7.9~30.4 ℃[18-20]。坛紫菜幼苗的生长适温为23~26 ℃左右,若温度过低则生长缓慢,厚度增长,品质下降,而持续高温则导致烂苗,严重降低产量[21]。近年来,气候变暖导致高温回暖天气频发,养殖户损失巨大[22]。因此,有必要研究坛紫菜叶状体对高温和强光的耐受能力,以及海洋酸化对其耐受能力的影响,这将有助于评估在气候变化背景下近海生态系统的稳定性。
1 材料与方法
1.1 坛紫菜样品
本研究材料坛紫菜Z-61是集美大学水产学院通过杂交方法选育获得的耐高温品系,以自由丝状体形式保存在福建省坛紫菜种质资源库[23]。自由丝状体经30 ℃高温促熟,然后转移到21 ℃充气促进壳孢子放散,壳孢子萌发获得叶状体幼苗。用天然灭菌海水参照PES培养基配方添加营养盐[24],充气培养坛紫菜叶状体,每两天更换新鲜培养液。培养温度为21 ℃,光照强度为50 μmol/(m2·s),L∶D=12∶12。选取25 cm左右长的健康藻体用于实验。
1.2 海洋酸化处理
往配好的新鲜培养基中添加CO2饱和的海水(向4 ℃海水中通入高纯度CO2气体,直至pH小于4.0,即得CO2饱和海水),设置3个pH水平:8.2(对照)、7.5和7.0。海水总碱度用电位滴定仪(Mettler-Toledo G20,瑞士)测定,盐酸浓度用优级纯级别的Na2CO3标定。根据海水pH和总碱度,用CO2SYS软件计算海水碳酸盐化学参数[25]。pH为 8.2、7.5和7.0的培养基的CO2浓度分别为(424±17)×10-6、(2 420±116)×10-6、(7 916±240)×10-6。
1.3 温度梯度实验
温度变化模拟养殖海域的实际情况[18-20]采用光照恒温培养箱进行温度梯度实验:短期温度实验为4 h,设置12个温度水平(6、9、12、15、18、21、24、27、30、33、36、39 ℃);长期温度实验为6 d,设置5个温度水平(11、16、21、26、31 ℃)。其余培养条件与藻体培养条件相同。
1.4 光梯度实验
短期光梯度实验为4 h,设置8个光梯度,光照强度范围为0~1 400 μmol/(m2·s)。长期实验为3 d,设置5个光梯度分别为40、80、150、250、550 μmol/(m2·s)。长期光梯度实验模拟坛紫菜养殖区福建省在养殖季节的地表平均日光照强度[26]。
1.5 生理指标测定
用Diving-PAM (Diving PAM, Walz, 德国)测定藻体的光系统Ⅱ的Fv/Fm,暗适应时间为15 min,饱和脉冲光照强度为8 000 μmol/(m2·s)。用黑白瓶法测定光合放氧速率和呼吸速率。将藻体加到透明的BOD瓶中密闭培养,不加藻体的为空白瓶。黑瓶用锡箔纸包裹遮光,白瓶放在实验设定光照强度下。培养4 h,测定瓶中的溶解氧浓度。溶解氧测定方法参考《水质 溶解氧的测定 碘量法》[27],利用电位滴定仪(Mettler-Toledo G20,瑞士)自动检测滴定终点并识别等当点。黑瓶和空白瓶的差值为呼吸所消耗的溶解氧,白瓶和空白瓶的差值为净光合作用所释放的溶解氧。用纱布吸干藻体表面水分,通过测量培养前后的鲜重差异,计算比生长速率(μ)。
1.6 统计
用Excel 2017和SPSS 18.0 软件进行统计分析,通过双因素方差分析(Two-Way ANOVA)和Tukey多重比较分析不同处理间的差异。
2 结果与讨论
2.1 实验结果
2.1.1 海洋酸化提高坛紫菜叶状体对高温胁迫的耐受能力 在pH 为8.2处理下短期培养4 h后,Fv/Fm值先随温度增加而缓慢增加,温度升高到24 ℃时Fv/Fm值最高。随后,Fv/Fm值随温度增加而缓慢降低,温度升高到36 ℃时Fv/Fm值大幅度下降,39 ℃处理下Fv/Fm值最小[图1(a)]。海洋酸化显著增加坛紫菜叶状体光系统II对低温和高温的耐受能力,表现为:在6、9、36 ℃处理下,与对照相比,海洋酸化显著增加了Fv/Fm值,增幅大于11%(p<0.05)。但在极端高温39 ℃处理下,酸化并未产生显著影响(p>0.05)。并且温度和海洋酸化对叶状体Fv/Fm值产生交互效应(p<0.01)。
与对照相比,酸化没有改变净光合速率对温度的响应趋势,随着温度升高,净光合速率呈现先增加后减少的特征,其最大和最小值分别出现在18、39 ℃[图1(b)]。但在所有12个温度水平下,海洋酸化均增加了净光合速率的平均值,其中7个温度存在显著差异(p<0.05)。与Fv/Fm值不同的是,在高温(36 ℃和39 ℃)下,海洋酸化将净光合速率分别增至对照的1.36倍和20.00倍(p<0.05)。呼吸速率明显随温度增加而增加,海洋酸化仅在低温(6 ℃和9 ℃)下显著降低呼吸速率[p<0.05,图1(c)],与对照相比下降约78%。
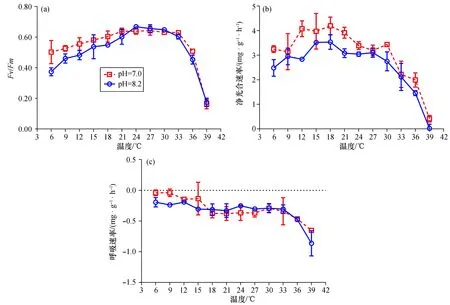
图1 坛紫菜叶状体的Fv/Fm、净光合速率和呼吸速率对短期温度变化的响应
在正常海水(pH 8.2)下培养6 d后,坛紫菜叶状体Fv/Fm值随温度上升而增加,至26 ℃时达到最大值,在31 ℃时大幅度下降。6 d酸化对Fv/Fm值并未产生显著影响[p>0.05,图2(a)],仅在31 ℃处理下,海洋酸化导致Fv/Fm的平均值高于对照。海洋酸化对坛紫菜生长速率的影响显著[p<0.05,图2(b)] ,在31 ℃高温胁迫下,正常海水培养的叶状体死亡溃烂,生长速率降低至负值;而酸化海水(pH 7.5)培养的叶状体比生长速率仍能维持在约0.1 d-1,显著高于对照(p<0.01)。Fv/Fm值和生长数据表明,海洋酸化能提高叶状体的耐高温能力。此外,温度和海洋酸化对坛紫菜叶状体的生长产生交互效应(p<0.01)。

图2 坛紫菜叶状体的Fv/Fm和比生长速率对长期温度变化的响应
2.1.2 海洋酸化提高坛紫菜叶状体对强光的耐受能力 短期培养实验表明,在光照强度为250、600、1 400 μmol/(m2·s)下,pH降至7.5导致叶状体净光合速率增加了46%以上[p<0.05,图3(a)]。在600 μmol/(m2·s)的光照强度下,海洋酸化处理的叶状体的Fv/Fm值显著比对照高22%[p<0.05,图3(b)];但在其他光照强度下,海洋酸化并未产生显著影响(p>0.05)。这表明在高光下,光系统Ⅱ的Fv/Fm受到的抑制显著低于对照,结合净光合速率数据,表明酸化提高了光系统Ⅱ对高光的耐受能力,使其在高光下仍具有更好的生理状态。

图3 坛紫菜叶状体的净光合作用速率和Fv/Fm对短期光照强度变化的响应
长期培养实验表明,海洋酸化对坛紫菜叶状体的光合作用有促进作用,在550 μmol/(m2·s)光照强度下,两个低pH处理均显著提高了净光合速率及总光合速率,增幅均超过25%[p<0.05,图4(a)、(c)]。除pH为7.0和550 μmol/(m2·s)光照强度处理外,酸化对呼吸速率没有明显影响[p>0.05,图4(b)]。在250 μmol/(m2·s)光照强度下,酸化提高Fv/Fm值约25%[p<0.05,图4(d)]。此外,海洋酸化还显著提高了坛紫菜叶状体的生长速率(p<0.05,图5),pH为7.0时叶状体的比生长速率提高27%以上(p<0.05),pH为7.5时提高33%以上(p<0.05),而两个低pH处理之间无显著性差异(p>0.05)。
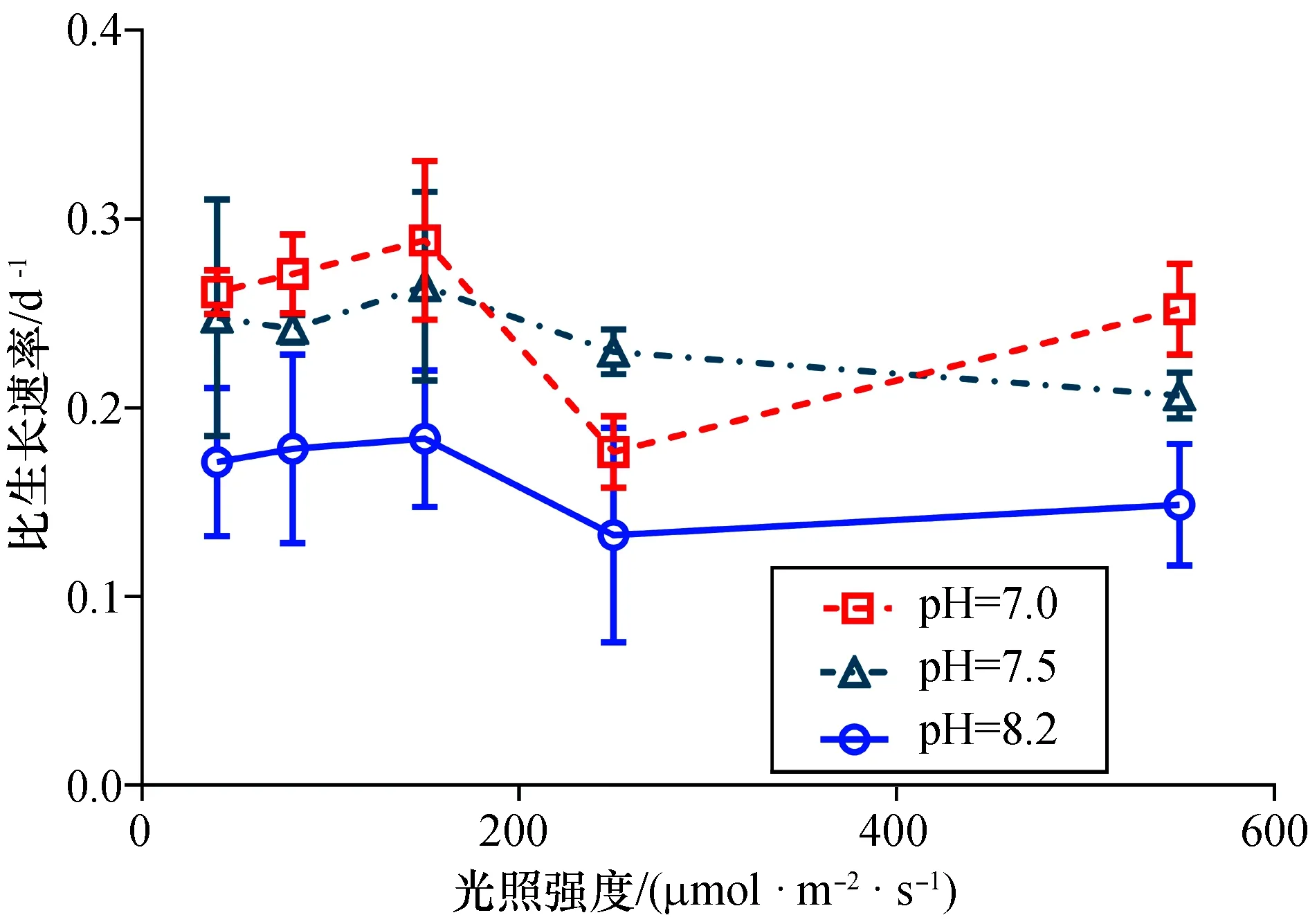
图5 坛紫菜叶状体的比生长速率对长期光照强度变化的响应
2.2 讨论
在养殖环境中,坛紫菜自然经历剧烈的温度和光照强度的变化。本研究表明,坛紫菜叶状体具有较宽的温度和光照强度生长范围,高温和强光处理时间延长(3~6 d)会显著抑制光合作用和生长。但降低pH可以显著减弱高温和强光对光合速率和比生长速率的抑制作用,说明海洋酸化显著提高了坛紫菜叶状体耐受高温和强光的能力。作为海洋红藻,坛紫菜的光合作用受限于海水中CO2浓度,因此需消耗大量能量运转二氧化碳浓缩机制(CCM)来提高胞内CO2浓度[28]。而海洋酸化使得藻类更容易获得CO2,可以减少投入CCM的能量用于抵御胁迫环境并促进生长[29],这可能是海洋酸化对坛紫菜生长表现出正面效果的原因之一。
坛紫菜叶状体适宜生长温度为16~24 ℃,水温过高会导致坛紫菜胞内活性氧显著增加[30],进而导致坛紫菜藻体溃烂,严重减少养殖户收入。但养殖区水温变化范围很广,最低为8 ℃,最高为30 ℃[18]。本研究发现,连续6 d的高温处理导致坛紫菜死亡,但酸化处理可以让坛紫菜叶状体在高温胁迫下依然维持一定的生长(图2)。这说明海洋酸化提高了坛紫菜叶状体对高温的耐受能力(图2),这一结论与前人研究结果[31]一致。将坛紫菜暴露于短时极高温(40 ℃)下时,对照培养的叶状体Fv/Fm值下降了70%以上,而高CO2环境下生长的藻体Fv/Fm值只下降了约40%,可见酸化可以减弱高温胁迫对坛紫菜叶状体的损伤[29]。因此,在一定程度上未来坛紫菜栽培产业可能受益于海洋酸化。
光是植物进行光合作用的能量来源,但过强的光却可能引起光抑制,进而降低生长速率甚至导致藻体死亡[28,32]。海洋酸化对龙须菜的影响与光照强度有关,在低光照强度下,海洋酸化对龙须菜的生长无明显差异,但在中等光照强度下,海洋酸化显著提高其生长速率40%以上[33]。本研究发现,在40~550 μmol/(m2·s)的光照强度范围内,酸化能提高坛紫菜的净光合速率,促进生长(图4、5)。此外,550 μmol/(m2·s)的强光处理显著降低Fv/Fm值,但酸化可以减轻其降幅,说明酸化可以提高坛紫菜对高光的耐受能力。Fv/Fm值为光系统Ⅱ的最大量子效率,而光照是影响Fv/Fm值的重要因素之一[34]。因而,Fv/Fm是一种准确、灵敏的光响应检测指标,可以反映光照强度变化对藻体生理状态产生的影响,在光抑制的检测中甚至比光合放氧速率更为灵敏[35-36]。Demmig-adams等(1992)认为在强光下,植物的光系统Ⅱ损伤是Fv/Fm值降低的主要原因[37]。因而,我们推测,海洋酸化通过缓解强光对光系统Ⅱ的损伤,提高了坛紫菜叶状体对强光的耐受能力。

图4 坛紫菜叶状体的净光合速率、呼吸速率、总光合速率和Fv/Fm对长期光照强度变化的响应
3 结论
全球环境变化已成为影响人类可持续发展的关键因素,而大气CO2浓度升高则是导致全球变暖和海洋酸化的元凶。本研究表明,海洋酸化会提高坛紫菜叶状体对温度和光胁迫的耐受能力,并将提高坛紫菜的净光合速率,促进生长。因此,在一定程度上坛紫菜栽培产业可能受益于海洋酸化,而野生坛紫菜也可能在潮间带生态系统中获得更多的竞争优势。
