共轭微孔聚合物多孔硬炭的KOH活化碳化与储锂性能
2021-08-17张庆堂白永保
张庆堂, 张 亚, 白永保
(兰州理工大学 石油化工学院,甘肃 兰州 730050)
锂离子电池具有高能量密度、长使用寿命以及环保等优点,被广泛的应用于便携式电子设备以及电动汽车市场[1-2]。动力电池的快速发展对负极材料的比容量、倍率性能以及循环寿命等提出了更苛刻的要求。锡基材料[3]、过渡金属氧化物[4]以及硅基材料[5]都是具有高比容量的负极材料。但是它们在循环过程中体积变大,循环性能都较差。因此,碳基材料仍是锂离子电池负极材料应用和研究的重点。碳基材料以其稳定性好、成本低、安全性高等优点,在商业化锂离子电池负极材料中得到了广泛的应用[6]。然而,因石墨极低的理论比容量(372 mAh·g-1),已经不能适应锂离子电池的发展[7]。多孔硬炭(PHC) 具有发达孔结构、较高的可逆容量以及相容性好等优点,成为开发高性能锂离子电池理想的电极材料之一[8]。但由于多孔硬炭的倍率性能差,限制了其广泛的应用。通过改变多孔硬炭的结构(如掺杂[9-10]和化学活化[11-13]等)进而改善其电化学性能是普遍采用的手段。一般来说,化学活化主要是通过增加比表面积以及孔体积,从而来提高电极材料的电化学性能。化学活化一般采用活化剂(ZnCl2[12]、KOH[13]等)与含碳物质混合,然后进行活化碳化。
共轭微孔聚合物(CMP)是含有共轭结构的三维网络多孔有机聚合物,通常由金属催化的交叉偶联反应合成[14]。因具有较高的热稳定性、大的比表面积以及良好的化学性能而被人们广泛关注[15-17]。同时,其结构可调,利用不同分子长度的单体可以调节其比表面积和孔容。而且碳含量高,在高温处理过程中质量损失小,其炭化物可以很好的保持形貌结构,这为合成特定形貌结构的多孔碳提供了一种新的可能。与活性炭相比,其炭化物PHC比表面积不大,导致其比容量不高。为了进一步提高其比容量,优化其电化学性能,通过KOH活化碳化获得活化多孔硬炭(K-PHC),并研究其结构和电化学性能。
以1,3,5-三乙炔基苯为单体,经Pd(II)/CuI催化的Sonogashira-Hagihara偶联自聚反应[18],合成了CMP纳米颗粒(Scheme 1)。将其与KOH混合,在氩气保护下,KOH活化碳化得到K-PHC。作为对比,在相同条件下直接碳化CMP得到PHC。采用N2吸附比表面仪和SEM对K-PHC和PHC两种材料的形貌结构进行了分析;利用恒流充放电研究了K-PHC和PHC的电化学性能。
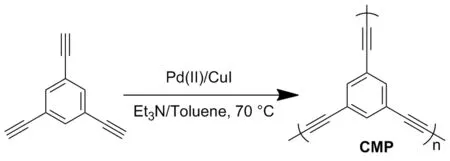
Scheme 1
1 实验部分
1.1 仪器与试剂
JSM-6701F型扫描电子显微镜;CT2001A型蓝电电池测试系统;ASAP 2020型氮气吸脱附测试仪。
所用试剂均为分析纯。
1.2 制备
(1)CMP的制备
依次称取1,3,5-三乙炔基苯900 mg,双(三苯基膦)二氯化钯(II) 127.5 mg、碘化亚铜33 mg, N2脱气20 min后加入6 mL甲苯和6 mL三乙胺,继续脱气20 min。然后升温至70 ℃,冷凝回流36 h(Scheme 1)。反应结束后自然冷却至室温,所得产物依次用三氯甲烷、丙酮、去离子水、甲醇过滤洗涤除去催化剂及未反应的单体。然后将洗涤后的样品进行甲醇索氏抽提72 h(80 ℃)进一步纯化,真空干燥24 h得CMP。
(2) PHC的制备
在氩气的气氛下,将所制备的CMP置于管式炉中进行热解。升温至350 ℃保温2 h,然后再升温至650 ℃保温4 h,最后自然冷却至室温得到PHC。
(3) K-PHC的制备
称取KOH 0.6 g和CMP纳米颗粒0.2 g加入到20 mL的无水乙醇中,搅拌至充分混合,然后将混合物转移到真空干燥箱中充分干燥。干燥后的样品置于管式炉中进行热解,在氩气的气氛下,350 ℃下保温2 h, 650 ℃下保温4 h。将所得产物置于0.1 mol/L的HNO3溶液中超声30 min,然后用乙醇和去离子水洗涤若干次以除去KOH,最终得到K-PHC产物。
1.3 电池组装及电化学性能
用乙醇作分散剂,将活性物质(K-PHC、 PHC)、 Super P和水性粘合剂(LA132)按质量比(8/1/1)称于玛瑙研钵中,研磨2 h使其充分混合。使用涂布器将所制备的混合物均匀的涂于直径为12 mm的圆形铜箔上,制成负极极片。对电极采用金属锂片,隔膜为聚丙烯膜(Cellgard-2400),电解液采用0.1 mol/L的LiPF6/(EC/EMC/DMC)。在手套箱(氩气氛围)中组装成扣式电池(CR2032)。采用蓝电电池测试系统,电压窗口为0~3.0 V,对所组装的电池进行恒流充放电测试(室温)。
2 结果与讨论
2.1 形貌及孔结构
图1a和1b为PHC和K-PHC的SEM图,图1c和1d为PHC和K-PHC的粒径分布图。

nm
由图可知,两种材料都是由一些近球状的纳米颗粒堆积而成。相比于K-PHC,PHC的颗粒尺寸较大,主要分布在35~50 nm。经过KOH活化,K-PHC的颗粒分布更加均匀,尺寸主要集中分布在30~36 nm。这说明,在KOH活化的过程中,纳米颗粒被KOH刻蚀,尺寸有所减小。一般来说,颗粒尺寸减小,能增加电极材料与电解液的接触面积,使活性物质与电解液接触更充分,缩短锂离子的扩散路径,从而提高材料的电化学性能。
采用氮气吸脱附测试仪对K-PHC和PHC的孔径分布以及比表面积进行了分析,结果如图2所示。图2(a)是K-PHC和PHC的吸附曲线,图2(b)是K-PHC和PHC的孔径分布图。通过分析,K-PHC和PHC的比表面积分别为1234.5 m2·g-1和950.9 m2·g-1。根据密度泛函理论(DFT)分析,两种材料都具有一定的微孔和介孔结构,K-PHC的孔径范围为1.5~147.5 nm, PHC的孔径范围为1.5~100.5 nm。可以看出,K-PHC的孔径分布较宽。较大的比表面积和丰富的孔结构,有利于电极材料与电解液的接触,缩短锂离子的扩散路径,从而提高材料的倍率性能。

P/P0
2.2 电化学性能
图3为K-PHC和PHC负极材料的首次和第二次充放电曲线(0.1 A·g-1)。

mAh·g-1
如图3(a)所示,PHC的首次充放电比容量分别为879.7和2046.5 mAh·g-1,库伦效率为42.9%, K-PHC的首次充放电比容量分别为972.1和2438.2 mAh·g-1,库伦效率为39.9%。可以看出,K-PHC和PHC的初始效率很低,这是由于在初次放电过程中SEI膜的形成以及电解液的分解,出现了较大的不可逆容量损失。其中,与PHC相比,K-PHC材料的初始库伦效率更低。这是因为K-PHC具有相对较大的比表面积,电极与电解液的接触的更充分,形成SEI膜时,消耗了更多的电解液。图3(b)是K-PHC和PHC的第二次充放电曲线图,可以看出,K-PHC的充放电比容量和库伦效率依次为899.2 mAh·g-1、 1061.3 mAh·g-1和84.7%。同样地,PHC的第二次充放电比容量和效率分别为726.1 mAh·g-1、 879.7 mAh·g-1和82.5%。相比于首次,K-PHC和PHC的库伦效率都有明显的提高。
图4(a)是K-PHC和PHC在各种电流密度下的倍率性能图。

图4 K-PHC和PHC的倍率性能图(a)和循环图(b)
可以看出,随着电流密度的增大,K-PHC和PHC的容量都出现了衰减现象。但在较大的电流密度下,容量基本趋于稳定。在各个电流密度下,K-PHC的容量都整体高于PHC的容量。当电流密度从0.1 A·g-1逐步提升到5.0 A·g-1, K-PHC的比容量分别为924.5、 737.8、 587.3、 463、 428.3、 370.4、 338.2、 303和262.2 mAh·g-1(每个电流密度下的第五次放电比容量)。同样地,PHC的比容量依次为705.8、 501.4、 389.5、 311.3、 302.7、 269.2、 177.2、 157.5和145.8 mAh·g-1。当电流密度再次降到0.1 A·g-1时,K-PHC仍可达到887.9 mAh·g-1的高比容量。
可见,K-PHC具有更加优异的倍率性能,这是因为通过使用KOH对CMP进行活化碳化,可以使比表面积显著的增加,同时也能使样品出现更多的介孔结构。大的比表面积可以使电极材料与电解液的接触更加充分,丰富的介孔结构也可以为锂离子的快速扩散提供通道,极大地缩短了锂离子的扩散路径。从而,相比于PHC,K-PHC表现出更为良好的倍率性能。图4(b)是0.6 A·g-1的电流密度下K-PHC和PHC的循环图。由图可知,K-PHC和PHC的初始放电比容量分别为554.5和315.7 mAh·g-1,循环300次以后,放电比容量分别为627.2和520.6 mAh·g-1,都有非常高的容量保持率,表明两种材料都具有良好的循环性能。K-PHC的比容量整体都比PHC的比容量高,表现出更优异的循环性能。
以1,3,5-三乙炔基苯为单体,经Pd(II)/CuI催化的Sonogashira-Hagihara偶联自聚反应,合成了CMP。再以CMP为前驱体,通过高温碳化制备PHC和K-PHC,并对其性能进行了研究。结果表明:经过KOH活化,K-PHC表现出更大的比表面积和丰富孔结构;在0.1 A·g-1的电流密度下,K-PHC的初次充放电比容量分别为972.1和2438.2 mAh·g-1,循环300圈后(0.6 A·g-1电流密度下)容量高达627.2 mAh·g-1,表现出好的循环稳定性和高的可逆容量。
