瘦素对绵羊卵泡颗粒细胞增殖/凋亡的影响
2021-08-17贾凯琪郭翔宇党文庆李雅婷马晓燕吕丽华
贾凯琪,郭翔宇,党文庆,李雅婷,马晓燕,王 锴,吕丽华
(山西农业大学动物科学学院,山西太谷030801)
原始卵泡库的大小决定了雌性哺乳动物的生殖能力,卵泡发育在雌性生殖中起着重要的作用。研究发现,脂肪因子在卵巢生理活动中发挥着重要作用,尤其是瘦素,由肥胖基因编码[1]。研究发现,瘦素缺陷小鼠的卵泡受损,卵泡颗粒细胞凋亡增强,繁殖异常[2]。颗粒细胞(GCs)在卵泡形成和发育过程中发挥重要作用,通过间隙连接为卵母细胞提供营养[3],其增殖和凋亡影响着卵巢功能的维持和发挥。目前,在人类[4]、小鼠[3]、牛[5]、猪[6]和羊[7]等动物的卵泡膜细胞和GCs 中发现了瘦素受体。瘦素受体的选择性剪接可产生 6 种形式的受体(OB-Ra 至 OB-Rf)[8],其中,OB-Rb 是一种功能性的瘦素受体,介导细胞内信号转导。瘦素受体酪氨酸位点突变的Y123F 小鼠血清E2水平下降、生殖器官不成熟导致不孕以及发生代谢异常[9]。近年来研究表明,瘦素不仅通过下丘脑/垂体参与促性腺激素的分泌,而且循环或局部产生的瘦素也可以直接调节卵巢功能[10]。瘦素信号结合跨膜受体OB-Rb 通过Janus 激酶信号转导和转录激活因子(JAK/STAT)途径发挥作用[11-12]。当Janus 激酶 2(JAK2)被激活时,OB-Rb 在不同的酪氨酸位点被进一步磷酸化,随后信号转导和转录激活因子3(STAT3)通过磷酸化活化形成二聚体,进而调控靶基因的表达[13-14]。目前,瘦素已经被证明可以通过JAK2/STAT3 通路抑制人卵泡GCs 中抗缪勒激素mRNA 的表达[15]。体外添加低浓度瘦素促进鹅体内GCs 的增殖和抑制GCs 的凋亡[16],抑制猪体内GCs 的凋亡[17]和水牛体内GCs 的凋亡[18]。然而,瘦素介导这些变化的机制以及JAK2/STAT3 是否在这一过程中发挥作用仍不清楚。
本研究通过添加不同浓度的瘦素处理绵羊卵泡GCs,探讨瘦素通过JAK2/STAT3 信号通路对GCs 的调控作用,旨在为提高雌性动物的繁殖性能提供理论依据。
1 材料和方法
1.1 试验材料
在发情季节从山西省太原市清徐县绵羊屠宰基地采集成年、健康雌性绵羊的卵巢。
1.2 主要试剂
重组羊瘦素购自ProSpec 公司,胎牛血清FBS购自CellMax 公司,青链霉素混合液、SDS-PAGE 凝胶制备试剂盒、MTT 试剂盒、1×PBS 缓冲液(pH 值7.2~7.4)、DAPI、PMSF 均购自北京索莱宝科技有限公司,DMEM/F12 基础培养液购自 HyClone 公司,EdU 细胞增殖检测试剂盒购自RIBOBIO 公司,BSA、Triton X-100 购自 Sigma-Aldrich 公司,反转录试剂盒购自 TaKaRa,JAK2 抗体、P-STAT3 抗体购自 CST 公司,STAT3 一抗购自 ABclonal 公司,Bcl-2一抗、封闭蛋白奶粉、PMSF 均购自博士德生物工程有限公司,FSHR 一抗、β-actin polyclonal antibody购自BioWorld,OB-Rb 抗体购自生物工程(上海)股份有限公司,IRDye800CW Goat anti-Rabbit 购自LI-COR,RIPA 裂解液购自上海碧云天生物技术有限公司。
1.3 细胞收集
收集卵巢,经消毒后置于DPBS 溶液中,在短时间内尽快运回实验室。不同直径的卵泡中卵泡颗粒细胞具有不同转录组谱[19],在体外培养时,根据卵泡的发育阶段,本试验仅从2~5 mm 的卵泡中分离卵泡颗粒细胞。分离的卵泡用酒精浸泡后置入预冷的DPBS 中,将卵泡在表面皿中(含DPBS)剪开,沿卵泡内壁轻刮,获取壁层颗粒细胞,用15 mL 的离心管收集。1 000 r/min 离心5 min,弃去上清,用完全培养基(DMEM/F12 基础培养基+1%双抗+10%FBS)重悬沉淀,离心洗涤2 次,用完全培养基重悬的细胞悬液铺于培养皿,置于细胞培养箱(37 ℃,5%CO2)培养用于后续试验。
1.4 试验方法
1.4.1 卵泡颗粒细胞鉴定 GCs 铺于12 孔板中,达到50%左右细胞融合率时,弃液体,加入PBS 溶液轻轻晃动细胞板,洗去多余培养液。4%多聚甲醛固定液室温孵育30 min,PBS 洗涤后每孔加入1%Triton X-100 溶液 37 ℃通透 30 min,PBS 溶液洗涤后每孔再加入 500 μL 1% BSA 37 ℃封闭 1 h,PBS溶液洗涤。试验孔加入200 μL FSHR 一抗(1∶100稀释),阴性对照加入200 μL PBS,4 ℃孵育 12 h。PBS 洗涤,绿色荧光二抗避光37 ℃孵育1 h(1∶200 稀释)。PBS 避光洗涤。每孔滴加DAPI 原液100 μL,37 ℃避光孵育 20 min,PBS 避光洗 4 次,每次5 min。荧光显微镜进行拍照记录。
1.4.2 卵泡颗粒细胞增殖 取生长状态旺盛的细胞接种于24 孔板中,铺匀,贴壁后,用加入不同浓度瘦素(0、10、25、50、100 ng/mL) 的无血清培养基(DMEM/F12 基础培养基+1%双抗)培养细胞24 h后,按 1 000∶1 稀释 EdU 溶液,配制为 50 μmol/L的 EdU,向每孔中加入 500 μL,孵育 2 h,PBS 洗涤1~2 次;4%多聚甲醛固定30 min,弃去液体;添加2 mg/mL 的甘氨酸于试验孔,脱色摇床洗脱5 min,弃去;加入PBS,脱色摇床孵育5 min,弃去;再加入渗透剂(0.5%Triton X-100 的 PBS)摇床孵育 10 min,PBS 洗去多余渗透剂;添加 500 μL1×Apollo 染色反应液于试验细胞孔中,置于摇床上避光处理30 min,弃去反应液;加入渗透剂脱色摇床清洗10 min,重复2~3 次,弃去渗透液;每孔再加入1×Hoechst33342反应液,室温条件下避光摇床孵育30 min,弃去反应液;PBS 洗涤1~3 次,使用荧光显微镜进行观测拍照。
1.4.3 qPCR 扩增 在6 孔中培养细胞,细胞贴壁后,用加入不同浓度瘦素(0、10、25、50、100 ng/mL)的无血清培养基培养24 h 后,收集细胞,向培养孔中加入1 mL Trizol,通过抽提、沉淀、溶解等步骤提取RNA。用NanoDrop ND-1000 仪器评估RNA 的质量,RNA 样品的 OD260/OD280值在 1.8~2.0 范围内可使用。使用TaKaRa 公司反转录试剂盒将所提取的RNA 反转录为cDNA。将该cDNA 作为模板进行qPCR 扩增。引物序列如表1 所示,由华大基因合成,β-actin作为内参基因。依据Prime ScriptTMRTreagent Kit with gDNA Eraser 说明书,反应体系为 10 μL。反应程序为:95 ℃ 30 s 进行预变性;95 ℃ 5 s,60 ℃30 s,72 ℃ 15 s,进行 45 个循环(PCR 反应阶段);95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s(熔解曲线阶段)。

表1 基因引物序列
1.4.4 Western blotting 收集不同浓度瘦素处理24 h后的颗粒细胞,向每孔加入含有蛋白酶抑制剂PMSF的蛋白裂解液200 μL,低温裂解30 min,收集样品。向样品中加入蛋白上样缓冲液(体积比4∶1),将样品混匀离心,在金属浴中变性10 min,取出后放在冰上等待加样。通过SDS-PAGE 电泳分离蛋白,依据Maker 大小,切下含目的蛋白的凝胶,通过转膜程序将其转移至NC 膜上,5%脱脂奶粉室温封闭90 min,用 TBST 稀释一抗 β-actin(1∶10 000)、JAK2(1∶1 000)、STAT3(1∶500)、Bcl-2(1∶500)、BAX(1∶1 000)、P-STAT3(1∶1 000),4 ℃孵育过夜。用TBST 稀释羊抗兔 IgG(1∶18 000),孵育 1 h。采用Odyssey CLX 远红外扫描系统检测NC 膜结果,β-actin作为内参蛋白进行结果分析。
1.5 数据分析
EdU 结果用Image J 软件计数和分析细胞增殖数。qPCR 结果采用 2-ΔΔCt法计算靶基因 mRNA 的相对丰度表达,β-actin为内参基因。Western blotting蛋白条带的灰度值由Image J 软件分析得出。在保证正态性和方差齐性后,采用SPSS 22.0 单因素方差分析(ANOVA)对数据进行分析,GraphPad Prism 7.0 软件用于绘图。试验数据用平均值±标准差表示,P<0.05 显示差异显著。
2 结果与分析
2.1 免疫荧光结果
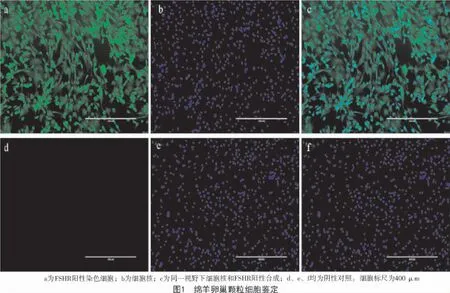
卵泡激素受体(FSHR)特异性表达于卵泡颗粒细胞,经免疫荧光染色的卵泡颗粒细胞如图1 所示。由图1 可知,95%以上的颗粒细胞表达FSHR受体,可用于后续试验。
2.2 颗粒细胞增殖能力
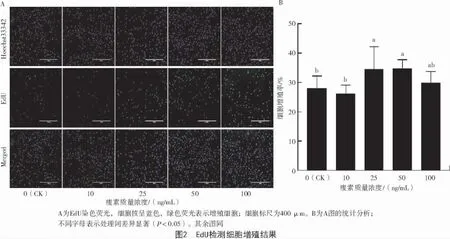
EdU 检测细胞增殖情况如图2-A 所示。通过Image J 分析表明,与对照组(0 ng/mL)相比,25、50 ng/mL 瘦素处理24 h 后细胞增殖率显著升高(P<0.05)(图 2-B)。
2.3 瘦素对相关基因表达的影响
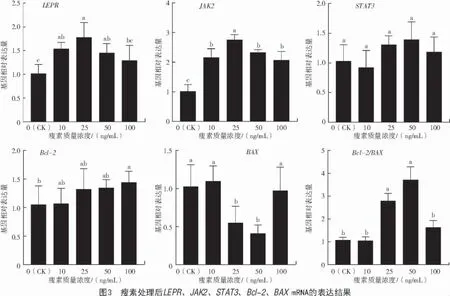
由图3 可知,与对照组(0 ng/mL)相比,添加不同浓度瘦素后,LEPR、JAK2的mRNA 表达均显著提高(P<0.05),抑凋亡基因Bcl-2在添加100 ng/mL瘦素后表达升高(P<0.05),促凋亡基因BAX在添加 25、50 ng/mL 瘦素后表达显著降低(P<0.05)。Bcl-2/BAX在 25、50 ng/mL 瘦素时表达显著升高(P<0.05)。
2.4 瘦素对相关蛋白表达的影响
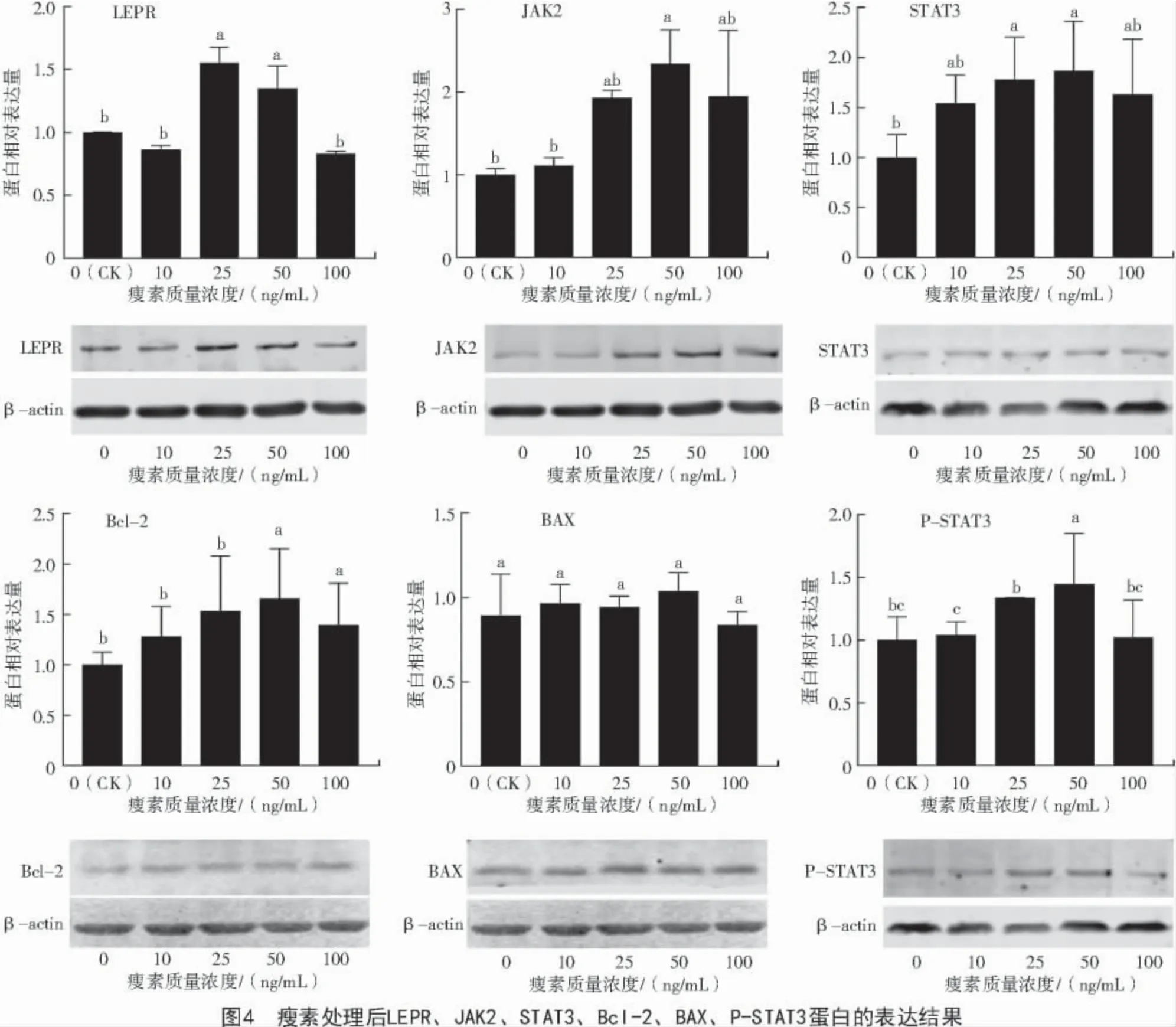
在蛋白水平,与对照组(0 ng/mL)相比,加入不同浓度瘦素后,LEPR 在 25、50 ng/mL 时表达显著升高,JAK2 在50 ng/mL 时表达显著升高,STAT3在 25、50 ng/mL 时表达显著升高,P-STAT3 表达在50 ng/mL 时显著增加(P<0.05),Bcl-2 在 50 ng/mL时表达量显著升高(图4)。
3 结论与讨论
卵泡GCs 是卵泡的功能细胞,GCs 凋亡可引发卵泡闭锁的发生。当发生卵泡闭锁时,GCs 凋亡率明显升高,在小卵泡中表现明显[20-21],凋亡相关基因Bcl-2 和BAX 的比值呈现显著下降趋势[22],进一步说明GCs 凋亡可用于评价卵泡健康状况。卵泡GCs具有强大的分泌功能。卵母细胞可以通过它们之间的间质连接获得必要的营养,以发育成熟[23]。
本研究表明,外源瘦素对绵羊GCs 的生长有促进作用。EdU 结果显示,与对照组相比,25 ng/mL 或50 ng/mL 瘦素促进 GCs 增殖。据报道,10 ng/mL 瘦素可促进鹅卵泡GCs 增殖[16],这与本试验结果一致,但瘦素浓度略有不同,可能是由于物种差异所致。100 ng/mL 瘦素促进Bcl-2基因的表达,研究发现,细胞凋亡过程中Bcl-2/BAX值可间接反映细胞的凋亡被抑制程度,25 ng/mL 或50 ng/mL 瘦素作用于GCs 时,Bcl-2/BAX值升高,证明细胞凋亡被抑制。瘦素的抑凋亡作用也在OVCAR-3 卵巢癌细胞上被证实,这可能是由于增殖相关基因表达的增加和促凋亡相关基因表达的降低[24]。转染Leptin-siRNA 于人卵巢 GCs 24 h 后,GCs 增殖减弱,Bcl-2表达受到抑制,BAX表达增强[25],与本研究结果相反,沉默瘦素基因表达后,凋亡基因表达改变,从相反的角度验证了本研究的结果。当细胞培养液中添加25 ng/mL瘦素培养绵羊腔前卵泡时,可提高卵泡的发育以及卵母细胞成熟率[26-27],卵泡体外存活率的提高可能与瘦素对卵泡GCs 的作用有关。体外培养液中添加25 ng/mL 瘦素与本试验结果得出的25 ng/mL 的瘦素对GCs 的增殖作用一致。牛卵母细胞体外培养液中加入1 000 ng/mL 瘦素,受精后第5 天成熟卵母细胞发育到8- 细胞期的百分率高于对照组[28]。PANDA 等[27]也研究表明,在水牛卵母细胞体外培养基中添加瘦素可提高卵裂率和囊胚率,获得高质量的卵母细胞。短期优化饲养绵羊血清中瘦素水平提高,可增加卵泡GCs 中OB-Rb 的表达,使卵泡在最后一个非排卵波中的存活时间延长[29]。本试验也证明,体外培养体系中瘦素浓度的增加可增加LEPR的表达。综上所述,目前和以往的研究表明,瘦素在调节卵巢GCs 生长中起着重要作用。
研究发现,在细胞发生增殖、凋亡或进行免疫调节过程中,JAK2/STAT3 通路都参与其中[30]。瘦素通过JAK2/STAT3 途径调节针对视前黑素皮质素(POMC)神经元 mRNA 的 miRNAs 的表达[31]。瘦素还通过JAK2/STAT3 途径对小鼠脑缺血再灌注损伤和氧糖剥夺(OGD)原代皮层神经元培养具有神经保护作用[32]。瘦素通过JAK2/STAT3 信号途径促进肝细胞癌细胞的生长和迁移[33]。本研究对绵羊GCs 增殖过程中瘦素与JAK2/STAT3 信号通路之间的相互作用进行了验证。通过检测与JAK2/STAT3通路相关的JAK2 和STAT3 信号分子的表达,发现 LEPR、JAK2、STAT3 和 P-STAT3 在 mRNA 和蛋白表达上增加,说明外源性瘦素处理激活了绵羊GCs 中的JAK2/STAT3 信号通路,可以进一步进行验证。
综上所述,瘦素促进卵泡GCs 的增殖,提高了Bcl-2/BAX值,其中,50 ng/mL 瘦素对 GCs 的促增殖抑凋亡作用最佳。同时,瘦素提高了GCs 中瘦素受体的表达,激活了JAK2/STAT3 通路。
